





人教版(2024)九年级下册(2024)课题2 常见的酸和碱优质教学ppt课件
展开1.通过对稀盐酸、稀硫酸性质的探究,进一步归纳酸的通性,能准确书写化学方程式,描述实验现象。2.能运用实验的方法获取信息,运用比较概括的方法对获取的信息进行加工。3.通过溶液导电性实验,解释酸具有相似化学性质的微观原因,体验从个性到共性,宏观到微观的思维方法。
那么酸在发生化学反应时,一般在什么条件下进行呢?
硫酸 盐酸 硝酸
碳酸 醋酸
紫色石蕊溶液遇酸变红,无色酚酞溶液遇酸不变色。
酸能与活泼金属反应生成氢气。
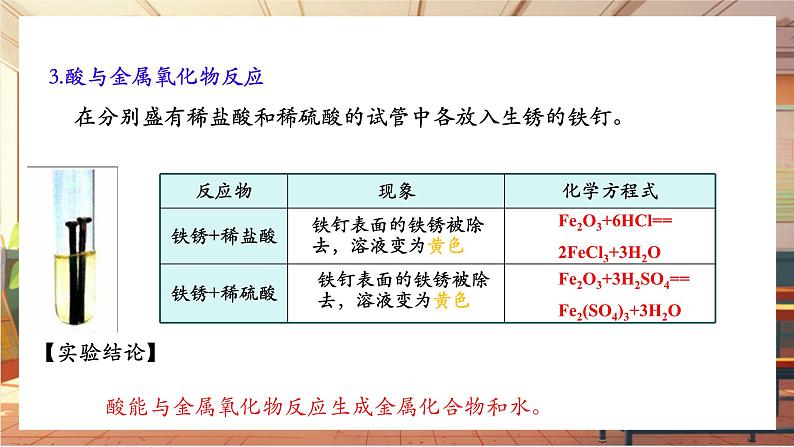
Fe2O3+6HCl==2FeCl3+3H2O
铁钉表面的铁锈被除去,溶液变为黄色
Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
3.酸与金属氧化物反应
在分别盛有稀盐酸和稀硫酸的试管中各放入生锈的铁钉。
酸能与金属氧化物反应生成金属化合物和水。
思考:利用酸和金属氧化物的反应可以清除铁制品表面的锈,除锈时能否将铁制品长时间浸在酸中?为什么?
反应初期:酸溶液与铁锈发生了反应
铁锈消失后:酸溶液又与铁发生了反应
Fe2O3+6HCl==2FeCl3+3H2OFe2O3+3H2SO4==Fe2(SO4)3+3H2O
Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑
例题 归纳是学习的重要方法,某同学在复习盐酸的性质时,归纳出盐酸的化学性质(如图所示,连线表示相互反应),请根据下列图示和要求回答问题。
(1)为了验证性质①,小红将紫色石蕊试液滴加到稀盐酸中,溶液变________。(2)若反应②的现象为生成浅绿色溶液,该反应的化学方程式为_____________________________,该反应的基本反应类型是____________。(3)若反应③生成黄色溶液,则该溶液中金属阳离子的符号为________。
Fe+2HCl==FeCl2+H2↑
二、酸具有相似化学性质的原因
分别试验稀盐酸、稀硫酸、蒸馏水和乙醇的导电性(可以将小灯泡换成发光二极管)。
烧杯中物质的稀盐酸或稀硫酸时,小灯泡发光,若为蒸馏水或乙醇,则不发光
蒸馏水和乙醇不导电,而稀盐酸、稀硫酸却能导电
在不同的酸溶液中都含有相同的H+,所以,酸有一些相似的性质。
能与金属氧化物反应Fe2O3+6HCl == 2FeCl3 +3H2OFe2O3+3H2SO4 ==Fe2(SO4)3 +3H2OCuO+2HCl==CuCl2+H2OCuO+H2SO4CuSO4+H2O
1. 小明想除去卫生间瓷砖上的铁锈痕迹,在用清水洗涤之前,他从家中选择了一种最合适的物质对铁锈进行处理,这种物质是( ) A.汽油 B.食盐水 C.白醋 D.米酒
2.将生锈的铁钉放在盐酸中,最先看到的现象是铁锈逐渐溶解,溶液由无色变成黄色,反应的化学方程式为: ,当时间稍长时,又看到有气泡生成,反应的化学方程式为: 。
Fe2O3+6HCl==2FeCl3+3H2O
初中化学人教版(2024)九年级下册(2024)课题3 常见的盐完整版教学课件ppt: 这是一份初中化学人教版(2024)九年级下册(2024)<a href="/hx/tb_c4056743_t3/?tag_id=26" target="_blank">课题3 常见的盐完整版教学课件ppt</a>,文件包含103常见的盐第2课时盐的化学性质复分解反应课件共16张PPTpptx、103常见的盐第2课时盐的化学性质复分解反应教案表格式doc等2份课件配套教学资源,其中PPT共16页, 欢迎下载使用。
九年级下册(2024)第十单元 常见的酸、碱、盐课题2 常见的酸和碱优秀教学课件ppt: 这是一份九年级下册(2024)<a href="/hx/tb_c4056742_t3/?tag_id=26" target="_blank">第十单元 常见的酸、碱、盐课题2 常见的酸和碱优秀教学课件ppt</a>,文件包含102常见的酸和碱第4课时中和反应课件共14张PPTpptx、102常见的酸和碱第4课时中和反应教案表格式doc等2份课件配套教学资源,其中PPT共14页, 欢迎下载使用。
人教版(2024)九年级下册(2024)课题2 常见的酸和碱精品教学ppt课件: 这是一份人教版(2024)九年级下册(2024)<a href="/hx/tb_c4056742_t3/?tag_id=26" target="_blank">课题2 常见的酸和碱精品教学ppt课件</a>,文件包含102常见的酸和碱第3课时常见的碱课件共15张PPTpptx、102常见的酸和碱第3课时常见的碱教案表格式doc等2份课件配套教学资源,其中PPT共15页, 欢迎下载使用。













