






2020-2021学年第二节 盐的性质教课内容课件ppt
展开这是一份2020-2021学年第二节 盐的性质教课内容课件ppt,共34页。PPT课件主要包含了提出问题,盐有哪些化学性质,实验探究,讨论揭秘,NaH,NaCl+H2CO3,课后反馈,新知旧识等内容,欢迎下载使用。
1、利用部分酸碱盐的溶解性表, 归纳出常见盐的溶解性并记忆; 2、能自己总结出盐的化学性质; 3、会运用复分解反应发生的条 件,判断反应能否发生。
知识回顾:把铁钉放到硫酸铜溶液中的现象
1.盐 + 金属 = 新盐 + 新金属
CaCO3 + 2 HCl ===
【讨论】Na2CO3 、NaHCO3、CaCO3在组成上有什么共同点? Na2CO3和NaHCO3能否与稀盐酸反应?如果能反应,请问它们又会生成什么物质?
CaCl2 + H2CO3
请回忆实验室制取二氧化碳的化学方程式?生成的气体是如何检验的呢?
CO2+Ca(OH)2=CaCO3↓+H2O
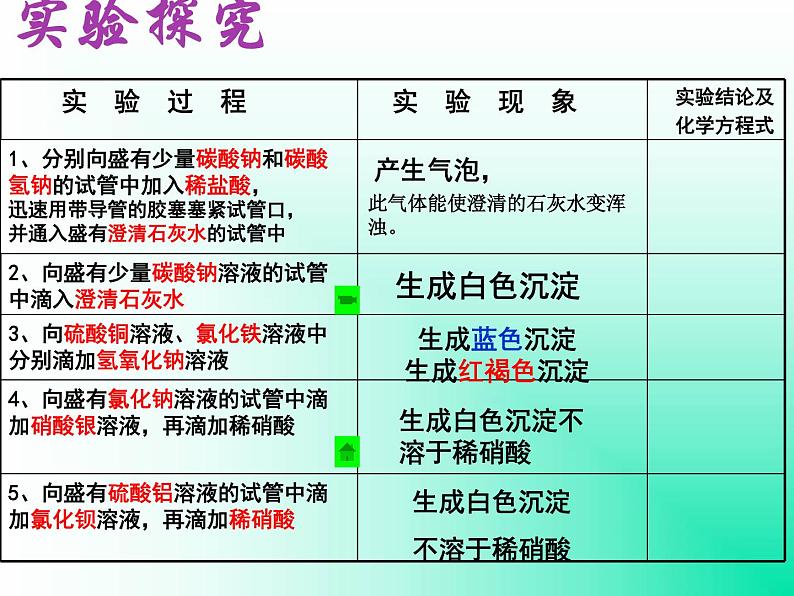
生成蓝色沉淀生成红褐色沉淀
生成白色沉淀不溶于稀硝酸
生成白色沉淀 不溶于稀硝酸
迅速用带导管的胶塞塞紧试管口,并通入盛有澄清石灰水的试管中
此气体能使澄清的石灰水变浑浊。
1、与盐酸反应产生二氧化碳的物质的组成里,一定含碳酸根吗?有哪些可能?如何鉴别含有碳酸根或碳酸氢根的物质?
2、你能总结出盐可以与哪几类物质反应,又生成哪类物质吗?3、酸与盐、碱与盐、盐与盐之间发生的反应,属于化合、分解、置换反应类型吗?有何特点?酸与碱作用属于什么反应类型?你能用通式表示这种反应类型吗?4、分析、归纳上述几个酸、碱、盐之间的化学反应,它们的生成物有什么特点?
2.盐 + 酸 = 新盐 + 新酸
3.盐 + 碱 = 新盐 + 新碱
4.盐 + 盐 = 新盐 + 新盐
下列四个反应跟以前所学的反应有哪些不同?从单质、化合物的角度及反应物、生成物的结构关系讨论各反应的共同点。 Na2CO3+Ca(OH)2 2NaOH+CaCO3↓ Na2SO4+ BaCl2 BaSO4 ↓+ 2NaCl
Na2CO3 + 2 HCl 2NaCl + H2CO3
NaHCO3 + HCl NaCl + H2CO3
(1)定义: 两种化合物互相交换成分,生成另外两种化合物的反应。
(2)特征:里里外外,价不变
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓Na2CO3+ CaCl2==CaCO3 ↓+ 2NaCl
( AB + CD AD + CB )
Cl+ CO3
2、定化学式(外跟外结合,内跟内结合):
2NaCl+H2O+CO2
由两种或两种以上物质生成另一种物质的反应
由一种物质生成两种或两种以上其它物质的反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
由两种化合物互相交换成分生成另外两种化合物的反应
C + AB →A +CB
AB + CD→ AD+ BC
讨论: NaOH + HCl = NaCl +H2O
1、酸与碱作用生成盐和水的反应是否属于复分解反应? 为什么?
2、以下反应是否是复分解反应:CO2 +2NaOH =Na2CO3 +H2OFe2O3+6HCl =2FeCl3+3H2O
指出下列反应各属于什么反应类型:
2KClO3 2KCl+ 3O2 ↑( )
2Cu + O2 2CuO ( )
C+ 2CuO 2Cu + CO2↑ ( )
2HCl + Ca(OH)2 CaCl2 + 2H2O ( )
2HCl +CaCO3 CaCl2 + H2O + CO2↑( )
分析、归纳下列几个酸、碱、盐之间的复分解反应,它们的生成物有什么特点?(现象) Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓ Na2SO4 + BaCl2 = BaSO4 ↓+ 2NaCl NaOH + HCl == NaCl + H2O
Na2CO3 + 2 HCl === 2NaCl + CO2↑+H2O
NaHCO3 + HCl === NaCl +CO2↑+H2O
(3)复分解反应发生的条件
两种化合物交换成分时,必需有 沉淀或气体或水生成。
想一想:化学方程式是否正确?
KNO3+NaOH=NaNO3+KOH
练习书写下列化学方程式:
①Na2CO3+H2SO4-②NH4Cl+ AgNO3-③FeCl3+ NaOH-④ AgNO3+Cu-
附录 1 部分酸、碱和盐的溶解性表(20摄氏度) P114
【思考】1、AgNO3 + HCl ---------- 2、 K2CO3+ Ca(OH)2----- 3、Na2CO3+ CaCl2 -------- 4、Na2SO4 + HCl ----------
5、H2SO4 + BaCl2--------6、Ba(OH)2+ KCl --------7、CuSO4 + NH4NO3----- 8、HNO3 + NaOH -------
【思考】 1、AgNO3 + HCl -------- 2、 K2CO3+ Ca(OH)2--- 3、Na2CO3+ CaCl2 ----- 4、Na2SO4 + HCl -------
5、H2SO4 + BaCl2-------6、Ba(OH)2+ KCl ------7、CuSO4 + NH4NO3--- 8、HNO3 + NaOH -----
CaCO3↓+ KOH
CaCO3↓+ NaCl
BaSO4↓+ HCl
NaNO3 + H2O
下列物质间能否发生复分解反应?若能,写出有关反应的化学方程式。1.硫酸和硝酸钠溶液2.氢氧化钠溶液和硝酸3.硫酸钠溶液和氯化钡溶液4.硝酸和碳酸钾溶液5.硝酸钾溶液和氢氧化钠溶液
写出下列反应的方程式,并讨论它们是否属于复分解反应。1.盐酸除铁锈。2.氢氧化镁中和胃酸3纯碱制烧碱。4硫酸铜溶液与氢氧化钠溶液反应。5.硫酸溶液与碳酸钠反应
6HCl+2Fe2O3===2FeCl3+3H2O
Mg(OH)2+2HCl==MgCl2+2H2O
Ca(OH)2+Na2CO3==2NaCl+CaCO3↓
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
H2SO4+Na2CO3==Na2SO4+H2O+CO2↑
下列物质能否发生反应?写出能发生反应的化学方 程式,并注明反应类型(1)银与稀盐酸 (2)铜与硫酸锌溶液 (3)铝与硝酸银溶液(4)硫酸和硝酸钠溶液(5)氢氧化钾溶液和硝酸(6)氯化钠溶液和硝酸银溶液(7)碳酸钾溶液和盐酸(8)硫酸铜溶液和氯化钡溶液
警钟长鸣
复分解反应一般是指酸、碱、盐之间在溶液里进行的反应。对反应物而言,还要注意:1、酸和碱的反应中,一般强酸(盐酸、硫酸、硝 酸)与所有的碱都能反应;2、酸和盐反应中,盐可以不溶于水,但一定要能 溶于酸;3、碱和盐、盐和盐反应中,参加反应的碱和盐一 般都要能溶于水。
2、分别将下列各组物质同时放入水中,能发生复分解反应的是( )。H2SO4 + Ba(NO3)2 B) HCl+CaCO3C) HCl+Na2SO4 D)HNO3+AgCl E) Cu(OH)2+NaCl F)NaOH+CaCO3G)NaOH+KCl H)KOH+MgCl2I)BaCO3+Na2SO4 J)K2SO4+AgCl K)KCl+Na2SO4 L)AgNO3+MgCl2
碳酸根离子或碳酸氢根离子的检验方法: 取少量样品放入试管中,向其中滴加稀盐酸,迅速用带导管的胶塞塞紧试管口,并将导管的另一端通入盛有澄清石灰水的试管中,如果有气泡产生,且澄清石灰水变浑浊,则证明样品中含碳酸根离子或碳酸氢根离子。
复分解反应发生的条件:两种化合物互相交换成分,生成 物中有沉淀或有气体或有水生成。
相关课件
这是一份初中化学北京课改版九年级下册第二节 盐的性质课堂教学课件ppt,共20页。PPT课件主要包含了教学目标,达标反馈等内容,欢迎下载使用。
这是一份北京课改版九年级下册第二节 盐的性质课前预习ppt课件,共18页。PPT课件主要包含了复分解反应,问题的提出,H2O,H2SO4,CuOH2,SO4,酸+碱盐+水,碱的溶解规律,NO3,酸+盐新酸+新盐等内容,欢迎下载使用。
这是一份2020-2021学年第二节 盐的性质复习课件ppt,共20页。PPT课件主要包含了走进厨房,观察生活,观察生活1,碳酸氢钠和醋酸反应,观察生活2,CaO,CuSO4,H2O,观察生活3,观察生活4等内容,欢迎下载使用。













