

高中化学苏教版 (2019)必修 第一册第三单元 人类对原子结构的认识第2课时学案及答案
展开
这是一份高中化学苏教版 (2019)必修 第一册第三单元 人类对原子结构的认识第2课时学案及答案,共11页。学案主要包含了原子核外电子的排布,原子结构示意图等内容,欢迎下载使用。
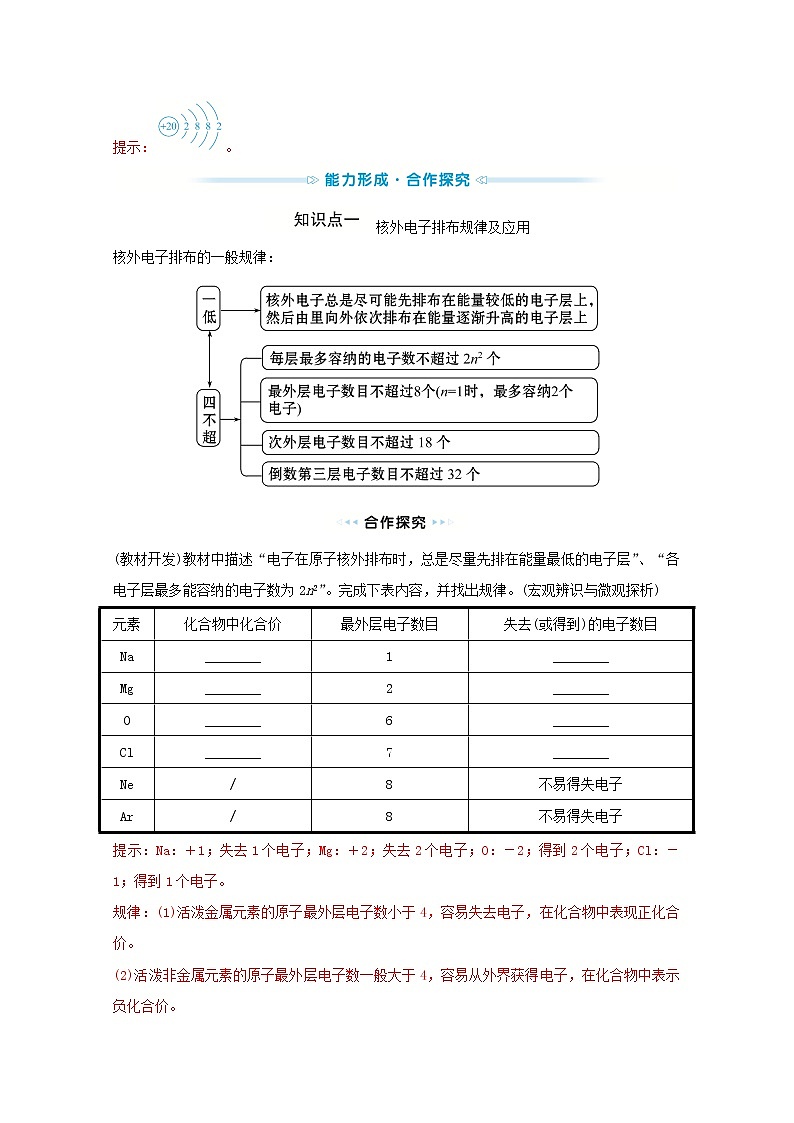
第2课时 原子核外电子排布一、原子核外电子的排布1.电子的能量:(1)在多电子原子中,电子的能量不同。(2)电子能量与运动区域。电子能量较低→运动区域离核较近;电子能量较高→运动区域离核较远。2.电子层:(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域运动,把不同的区域简化为不连续的壳层,称作电子层。(2)电子层的表示方法及与能量的关系。表示方法n1234567字母KLMNOPQ离核远近由近到远能量高低由低到高3.电子的分层排布:电子总是尽量先从内层排起,当一层充满后再填充下一层,即原子核外电子排布时,先排K层,充满后再填充L层。各电子层最多容纳电子的数目为2n2个。1.(知识关联)核电荷数为11的钠原子,其质子数是多少?核外电子数是多少?原子中质子数、核外电子数之间有何关系?提示:钠原子的质子数为11,核外电子数为11。原子中,质子数=核外电子数。2.钠原子的核外电子中能量最低的电子层是哪一层,能容纳几个电子?提示:K层,能容纳两个电子。二、原子结构示意图1.钠原子的结构示意图如下,请注明其意义:2.画出常见微粒结构示意图:氟原子:;镁原子:3.原子和离子中微粒间的数量关系:(1)原子:核外电子数=质子数=核电荷数,如N原子(2)阳离子:核外电子数=质子数-所带电荷数,如Na+的结构示意图:(3)阴离子:核外电子数=质子数+所带电荷数,如S2-的结构示意图:1.(知识关联)依据核外电子排布规律,请画出下列各原子的原子结构示意图。(1)O________;(2)Ne________;(3)Mg________;(4)Ar________。提示:2.在(1)O、(2)Ne、(3)Mg、(4)Ar中,形成稳定电子层结构的有哪些?提示:(2)Ne、(4)Ar。最外层为8个电子,形成了稳定结构。3.根据核外电子排布规律写出钙原子的结构示意图。提示:。核外电子排布规律及应用核外电子排布的一般规律:(教材开发)教材中描述“电子在原子核外排布时,总是尽量先排在能量最低的电子层”、“各电子层最多能容纳的电子数为2n2”。完成下表内容,并找出规律。(宏观辨识与微观探析)元素化合物中化合价最外层电子数目失去(或得到)的电子数目Na________1________Mg________2________O________6________Cl________7________Ne/8不易得失电子Ar/8不易得失电子提示:Na:+1;失去1个电子;Mg:+2;失去2个电子;O:-2;得到2个电子;Cl:-1;得到1个电子。规律:(1)活泼金属元素的原子最外层电子数小于4,容易失去电子,在化合物中表现正化合价。(2)活泼非金属元素的原子最外层电子数一般大于4,容易从外界获得电子,在化合物中表示负化合价。(3)稀有气体原子最外层有8个(He有2个)电子,化学性质稳定,不易得失电子。【典例】下列说法正确的是( )A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子B.最外层电子达到稳定结构的微粒只能是稀有气体的原子C.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子D.某元素原子的最外层只有2个电子,则该元素一定是金属元素【解题指南】解答本题需要注意理解以下两个方面:(1)阴阳离子的核外电子排布有可能与稀有气体原子相同。(2)金属元素原子的最外层电子数目小于4,但最外层电子数目小于4的原子不一定是金属元素的原子。【解析】选C。电子排布为2、8、8结构的微粒还可能为S2-、Cl-等,A项错误;O2-、F-、Cl-、Li+、Na+、Mg2+等微粒最外层电子数均达到了稳定结构,B项错误;F-、Na+、Mg2+、Al3+核外电子排布均为2、8结构,与Ne原子的电子层结构相同,C项正确;He原子的最外层只有2个电子,但He元素是稀有气体元素,D项错误。【规律方法】元素化合价与得、失电子数目的关系(1)元素原子的核外电子排布,特别是原子最外层电子数决定元素的化学性质。(2)金属元素的原子失去电子,表现为正化合价,化合价数值=失去电子的数目=原子最外层电子数。(3)非金属元素的原子得到电子,表现为负化合价。最低负化合价的数值=达到稳定结构所得电子的数目。 (1)某原子核外电子排布为2、7结构,该原子是什么原子?提示:F原子。核外电子总数为9,质子数=核外电子数=9,为F原子。(2)该原子在化学反应中易得电子还是易失电子?提示:F原子最外层电子数目为7,在化学反应中易得到一个电子。(3)写出该元素与钠元素组成化合物的化学式。提示:NaF。F原子最外层电子数目为7,在化学反应中易得到一个电子,F元素在化合物中的化合价为-1价,Na在化合物中的化合价为+1价。(2021·苏州高一检测)有A、B、C、D四种元素(核电荷数均小于18),且它们的原子序数依次增大。其中A元素是宇宙中最轻的元素,B元素原子的核外电子总数是其最内层电子数的3.5倍;C为金属元素且原子的最外层电子数和最内层电子数相等;D元素可以与A元素形成AD型化合物。(1)写出四种元素的元素符号:A________;B________;C________;D________。(2)画出C元素的离子结构示意图:______________________________________。(3)写出A、B、D形成的化合物在水中的电离方程式:_______________________。【解析】A元素是宇宙中最轻的元素,则A为H元素;B元素原子的核外电子总数是其最内层电子数的3.5倍,则为N元素(N的电子总数为7,最内层电子数为2);C为金属元素且原子的最外层电子数和最内层电子数相等,则C为Mg元素,最外层电子数为2。D元素可以与A元素形成AD型化合物,则AD为HCl。答案:(1)H N Mg Cl (2)(3)NH4Cl===NH+Cl-核外电子排布的表示方法——结构示意图1.原子结构示意图:(1)用小圆圈和圆圈内的符号及数字表示原子核和核电荷数。(2)用弧线表示电子层。(3)弧线上的数字表示该电子层上的电子数。(4)原子结构示意图中,核内质子数=核外电子数。如钠的原子结构示意图:2.离子结构示意图:(1)当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期稀有气体元素原子相同的电子层结构(电子层数相同,每层上所排布的电子数也相同)。如(2)非金属元素的原子得电子形成简单离子时,形成和同周期稀有气体元素原子相同的电子层结构。如根据指定微粒的结构示意图分析有关问题:(1)同一元素的原子和离子构成有什么差异?(证据推理与模型认知)提示:核电荷数或质子数相同,核外电子数不同。(2)原子形成阳离子或阴离子后,其电子层结构有何变化?(证据推理与模型认知)提示:原子形成阳离子后,要减少一个电子层,形成阴离子后,电子层数不变,但最外层电子数增多,它们都达到了稳定结构。(3)原子或离子中质子数(或核电荷数)与核外电子数是否相等?有什么规律存在?(宏观辨识与微观探析)提示:①原子:核电荷数(质子数)=核外电子数。②阳离子:核电荷数(质子数)=阳离子的核外电子数+阳离子的电荷数。③阴离子:核电荷数(质子数)=阴离子的核外电子数-阴离子的电荷数。【合作探究】(情境思考)下列粒子的结构示意图中,错误的有哪些?提示:①②④⑤。①错误,K层最多只能容纳2个电子;②错误,Cl的核电荷数为17,最外层电子数为7;④错误,最外层电子不能超过8个;⑤错误,L层上电子为8个,M层上电子为5个【典例】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答下列有关问题。(1)与离子相对应的元素的符号是________,与原子相对应的离子的结构示意图是____________。(2)电子层结构相同的是________(填写字母,下同),性质最稳定的是__________,最容易失去电子的是__________,最容易得到电子的是________。(3)可直接相互结合形成的化合物的化学式是______________(写一个即可,下同),可经过得失电子后再相互结合形成的化合物的化学式是________________。【解题指南】解答本题需要注意理解以下两个方面:(1)根据结构示意图正确推出原子(离子)名称。(2)元素的性质与原子结构中的最外层电子数的关系。【解析】(1)在A~E这五种粒子中,A是Cl,B是O2-、C是Ne,D是Na,E是Mg2+。Ne的特殊稳定结构决定了它不能形成离子。(2)电子层结构相同,即电子层数和各个电子层上的电子数目都相同,但与原子核内质子数无关。O2-、Ne和Mg2+都具有稳定的电子层结构,但最稳定的是Ne。(3)阳离子与阴离子可直接相互结合形成化合物;活泼金属元素的原子与活泼非金属元素的原子经过得失电子后可相互结合形成化合物;在化合物里,Na显+1价,Mg显+2价、Cl显-1价、O显-2价。答案:(1)O、Mg (2)BCE C D A (3)MgO NaCl(合理即可)【母题追问】(1)在核电荷数1~10的元素内,列举两个与B的电子层结构相同的离子,写出离子的符号:__________。提示:N3-、F-。在核电荷数1~10的元素内,N原子的核外共有7个电子,其最外层上是5个电子,N原子得到3个电子后形成的N3-与B的电子层结构相同;F原子的核外共有9个电子,其最外层上是7个电子,F原子得到1个电子后形成的F-与B的电子层结构相同。(2)写出与C电子层结构相同的+3价阳离子的符号。提示:Al3+。与氖原子电子层结构相同的+3价阳离子是Al3+。【规律方法】原子(离子)结构示意图书写时的注意事项一、要正确区分原子结构示意图和离子结构示意图(通过比较核内质子数和核外电子数)。二、将电子排布的几个规律加以融合,不能片面理解,要从整体上加以把握,正确对核外电子进行排布。三、示意图的绘制应符合标准,注意图形的完整性,如:圆圈内的“+”不能省略。有A、B、C三种元素,核电荷数均小于18。已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素的两倍,A元素原子第三层电子数为第一层电子数的三倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍。请回答下列问题:(1)A的原子结构示意图:____________;A元素的名称:________。(2)B的原子结构示意图:____________;B元素的名称:________。(3)C的离子结构示意图:____________;C元素的符号:__________。【解析】因为最内层最多容纳2个电子,又已知A元素第三层电子数是第一层电子数的3倍,所以第三层电子数为2×3=6,则A为硫。B元素与A元素电子层数相同且最外层的电子数为6÷2=3,则B为铝。已知C元素原子的核电荷数是电子层数的4倍,质子数为最外层电子数的6倍,4与6的最小公倍数为12,可见该元素原子的核内质子数应为12的倍数,又因为核电荷数小于18,故为镁元素。答案:(1) 硫(2) 铝(3) Mg三言两语话重点(1)原子核外电子排布规律的“1个最低”和“3个最多”:①“1个最低”——核外电子总是尽量先排布在能量最低的电子层里;②“3个最多”——各电子层最多容纳电子数2n2;最外层电子数最多8个;次外层电子数最多18个。(2)最外层电子数是次外层电子数的“2、3、4”倍的元素分别为C、O、Ne。1.(2021·泰州高一检测)下列关于原子核外电子排布规律的说法错误的是( )A.K层是能量最低的电子层B.原子失电子时先失去能量低的电子C.核外电子总是优先排布在能量较低的电子层上D.N层为次外层时,最多可容纳的电子数为18【解析】选B。A项,K层为第1层,电子的能量最低,正确;B项,原子先失去能量高的电子,即最外层电子,错误;C项,电子先排布能量低的电子层上,正确;D项,最外层电子数不超过8,次外层不能超过18,正确。【补偿训练】下列叙述正确的是( )A.电子的能量越低,运动区域离核越远B.核外电子的分层排布即核外电子的分层运动C.稀有气体元素原子的最外层都排有8个电子D.当M层是最外层时,最多可排布18个电子【解析】选B。原子核外的电子的分层排布是指核外电子在不同的区域运动,能量越低的电子运动区域离核越近,A错;核外电子的分层排布即核外电子的分层运动,B正确;稀有气体元素中He的原子最外层只有2个电子,C错;M层为最外层时,最多只能排8个电子,D错。2.(2021·扬州高一检测)已知最外层电子数相同的原子具有相似的化学性质。下列原子中与氧原子化学性质相似的是( )【解析】选D。A中最外层为4个电子,B中最外层为8个电子,C中最外层为2个电子,D中最外层为6个电子。氧原子的最外层为6个电子,最外层电子数相同的原子,化学性质是相似的,D项正确。【补偿训练】某元素的原子核外有三个电子层,M层的电子数是L层电子数的,则该元素的原子为( )A.Li B.Al C.Si D.K【解析】选C。三个电子层即K、L、M,K层2个电子,L层8个电子,可知M层4个电子,该元素的核外电子排布为2、8、4,是硅元素。3.(2021·泉州高一检测)据报道,科学家新合成了一种抗癌、治癌的药物,其化学式可表示为10B20。下列叙述不正确的是( )A.10B为硼元素的一种原子B.10B20为硼元素的一种单质C.10B20的中子数与核外电子数相同D.10B的原子核外电子排布为【解析】选D。10B为硼元素的一种原子,A正确;10B20为硼元素的一种单质,B正确;10B20的中子数与核外电子数相同,C正确;10B原子的核电荷数为5,且最外层只有3个电子,D不正确。4.(2021·莆田高一检测)已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z。X原子的电子层数与它的核外电子总数相同,Z原子有两个电子层,外层电子数是内层的电子数的三倍,则(1)X是________,Z是________;Y原子结构示意图____________。(2)由Y和Z组成,且Y和Z的质量比为7∶20的化合物的分子式是____________。(3)X、Z可以形成两种化合物A和B,A中原子个数比为2∶1,则A的摩尔质量是________。B中两原子个数比为1∶1,实验室常用B制备少量的氧气,写出该反应的化学反应方程式____________。【解析】元素X、Y、Z质子数都小于18,X原子的电子层数与它的核外电子总数相同,则X为H元素;Z原子有两个电子层,外层电子数是内层的电子数的三倍,最外层电子数为6,则Z为O元素;由于质子数X+Y=Z,故Y质子数=8-1=7,故Y为N元素。(1)X是H元素,Z是O元素;Y为N元素,原子结构示意图为;(2)m(N)∶m(O)=7∶20,可知n(N)∶n(O)=∶=2∶5,故该化合物为N2O5;(3)H、O可以形成两种化合物A和B,A中X、Z原子个数比为2∶1,则A为H2O,则A的摩尔质量是18 g·mol-1;B中两原子个数比为1∶1,则B为H2O2,实验室常用H2O2制备少量的氧气,反应的化学反应方程式为2H2O22H2O+O2↑。答案:(1)H元素 O元素 (2)N2O5(3)18 g·mol-1 2H2O22H2O+O2↑
相关学案
这是一份高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用学案设计,共4页。
这是一份苏教版 (2019)必修 第一册专题2 研究物质的基本方法第三单元 人类对原子结构的认识第2课时导学案,共9页。学案主要包含了原子核外电子排布等内容,欢迎下载使用。
这是一份高中专题2 研究物质的基本方法第三单元 人类对原子结构的认识第二课时学案及答案,共9页。










