





人教版 (2019)选择性必修1第三节 盐类的水解教案配套课件ppt
展开一、盐溶液的酸碱性1.实验探究(1)实验操作:①pH计测定:取待测盐溶液于烧杯中,插入pH计,读出数值;
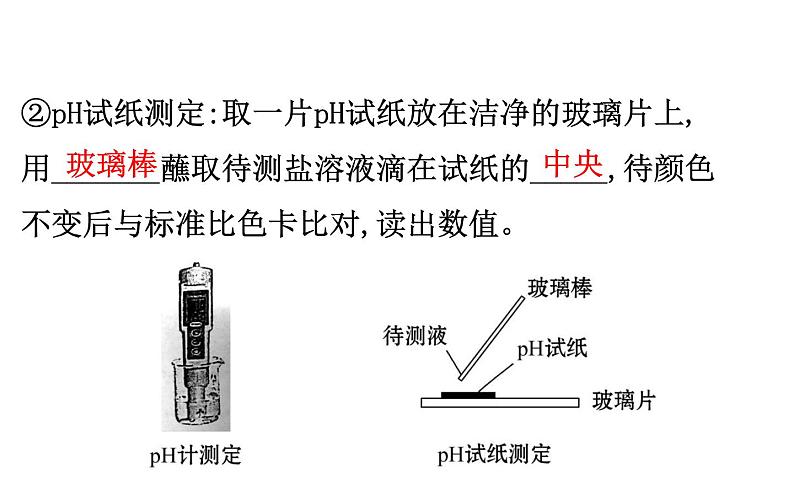
②pH试纸测定:取一片pH试纸放在洁净的玻璃片上,用_______蘸取待测盐溶液滴在试纸的_____,待颜色不变后与标准比色卡比对,读出数值。
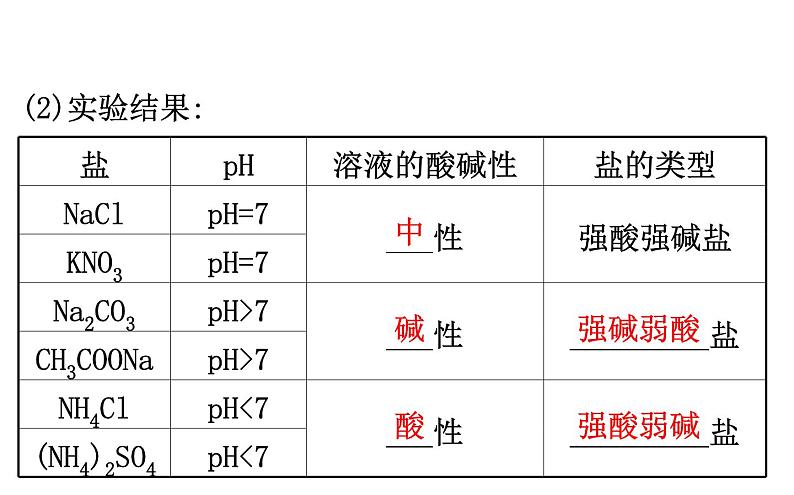
2.实验结论(1)强酸强碱盐的水溶液显中性;(2)强碱弱酸盐的水溶液显___性;(3)强酸弱碱盐的水溶液显___性。
【做一做】常温下,下列盐溶于水,溶液显酸性的是____________。 A.NH4NO3 B.NaClO C.Na2S D.NaNO3提示:A。NH4NO3属于强酸弱碱盐,溶液显酸性;NaClO、Na2S属于强碱弱酸盐,溶液显碱性;NaNO3属于强酸强碱盐,溶液为中性。
3.盐溶液呈现不同酸碱性的原因以NH4Cl溶液为例:
【做一做】仿照NH4Cl溶液分析CH3COONa溶液显碱性的原因。提示:醋酸钠溶液中存在如下平衡:
CH3COO-和H+结合生成弱电解质CH3COOH,使水的电离平衡向电离方向移动,使溶液中c(H+)
二、盐类水解1.概念在水溶液中盐电离产生的_____与水电离产生的___离子或_______离子结合生成弱电解质的反应。
2.表示方法(1)用化学方程式表示:盐+水 酸+碱如AlCl3的水解:__________________________。(2)用离子方程式表示:盐的弱离子+水 酸(或碱)+OH-(或H+)如Na2CO3的水解(分步进行):第一步:______________________;第二步:______________________。
AlCl3+3H2O 3HCl+Al(OH)3
C +H2O HC +OH—
HC +H2O H2CO3+OH—
3.水解规律(1)强酸弱碱盐:电离产生的___离子发生水解,使c(H+)__c(OH-),溶液显___性;(2)强碱弱酸盐:电离产生的___离子发生水解,使c(H+)__c(OH-),溶液显___性。
【情境思考】Na2CO3俗称纯碱,国际贸易中又名苏打或碱灰,是一种重要的无机化工原料,主要用于平板玻璃、玻璃制品和陶瓷釉的生产,还广泛用于生活洗涤、酸类中和和食品加工等。在日常生活中,苏打也有很多用途,比如它可以直接作为洗涤剂使用,在蒸馒头时加一些苏打,可以中和发酵过程中产生的酸性物质。
你能证明Na2CO3溶液中存在水解平衡吗?提示:向Na2CO3溶液中加入固体CaCl2,溶液的pH下降。
知识点一 盐类水解的实质和规律【重点释疑】1.盐类水解的实质
(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。如:碳酸的酸性大于次氯酸,则相同浓度的Na2CO3溶液的水解程度小于NaClO溶液。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。如:碳酸的电离常数Ka1小于NH3·H2O的电离常数Kb,故NH4HCO3溶液显碱性。
(5)“同强显中性”——①强酸强碱盐溶液显中性;②盐中的阳离子对应的碱的电离常数Kb与盐中的阴离子对应的酸的电离常数Ka相等时,盐溶液显中性。如Kb(NH3·H2O)=Ka(CH3COOH),故CH3COONH4溶液显中性。
【特别警示】(1)离子能够发生水解的盐溶液并不一定显酸性或碱性,也可能显中性,如CH3COONH4溶液。(2)相同条件下水解程度越大的离子生成的电解质越弱,这种离子结合H+或OH-的能力越强。
(3)书写离子方程式时“====”和“ ”的应用要慎重。N 水解:N +H2O NH3·H2O+H+,而铵盐与强碱反应则为N +OH—====NH3·H2O。
【思考·讨论】(1)pH均为4的H2SO4溶液和NH4Cl溶液中,水电离出的c(H+)相等吗? 提示:不相等。H2SO4抑制水的电离,NH4Cl能水解,促进水的电离,所以NH4Cl溶液中水的电离程度大。(2)某盐溶液显中性,该盐一定是强酸强碱盐吗?提示:不一定。也可能是弱酸弱碱盐,如CH3COONH4溶液显中性。
(3)等浓度的醋酸钠的pH小于次氯酸钠溶液的pH,由此能否确定醋酸与次氯酸的酸性强弱?提示:由“越弱越水解”可知,等浓度的醋酸钠的水解程度小于次氯酸钠溶液的水解程度,由此确定醋酸的酸性大于次氯酸。
【案例示范】【典例】(2019·福州高二检测)25 ℃时浓度都是1 ml·L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中c(X-)=1 ml·L-1,BX的溶液pH=4,BY的溶液pH=6。下列说法正确的是( )
A.电离平衡常数K(BOH)小于K(HY)B.AY溶液的pH小于BY溶液的pHC.稀释相同倍数,溶液pH变化BX等于BYD.将浓度均为1 ml·L-1的HX和HY溶液分别稀释10倍后,HX溶液的pH大于HY
【思维建模】解答本类试题思维流程如下:
【解析】选A。A项,根据BY溶液的pH=6,B+比Y-更易水解,则BOH比HY更难电离,因此电离平衡常数K(BOH)小于K(HY);B项,根据AX、BX、BY溶液的pH,则AX为强酸强碱盐,BX为强酸弱碱盐,BY为弱酸弱碱盐,则AY为弱酸强碱盐,溶液的pH>7,故AY溶液的pH大于BY溶液的pH;C项,
稀释相同倍数,BX、BY溶液的pH均增大,且BX溶液的pH变化大于BY溶液;D项,HX为强酸,HY为弱酸,浓度相同时,稀释10倍后,HY的电离程度增大,但仍不可能全部电离,故HX溶液的酸性强,pH小。
【母题追问】在室温时,等浓度AOH、BOH溶液中水的电离程度哪个大?(证据推理与模型认知)提示:BOH溶液中水的电离程度大。碱性:AOH>BOH,AOH溶液中c(OH-)大,对水的电离抑制程度大。
【迁移·应用】 盐MN溶于水存在如下过程:
下列有关说法中不正确的是( )A.MN是强电解质B.总反应离子方程式为N-+H2O====OH-+HNC.该过程使溶液中的c(OH-)>c(H+)D.MOH为强碱
【解析】选B。由MN====M++N-可看出MN是强电解质,A正确;从反应过程可以看出,总反应离子方程式为N-+H2O OH-+HN ,N-与水电离出来的H+结合为弱电解质HN,因此溶液中c(OH-)>c(H+),B错误,C正确;溶液中M+没有发生水解,即其对应的碱MOH为强碱,D项正确。
【补偿训练】1.常温下,下列物质的水溶液pH小于7的是( )A.NaCl B.CH3COONa C.FeCl3 D.NaHCO3【解析】选C。A项是强酸强碱盐 ,溶液呈中性;B、D项是强碱弱酸盐,溶液呈碱性;C项是强酸弱碱盐,溶液呈酸性。
2.物质的量浓度相同的下列溶液中,按pH由小到大的顺序排列的是( )A.Na2CO3 NaHCO3 NaCl NH4ClB.Na2CO3 NaHCO3 NH4Cl NaClC.(NH4)2SO4 NH4Cl NaNO3 Na2SD.NH4Cl (NH4)2SO4 Na2S NaNO3
【解析】选C。首先判断(NH4)2SO4和NH4Cl是强酸弱碱盐,溶液呈酸性;NaCl和NaNO3是强酸强碱盐,溶液呈中性;Na2CO3、NaHCO3和Na2S是强碱弱酸盐,溶液呈碱性。(NH4)2SO4、NH4Cl溶液因N 水解而呈酸性,(NH4)2SO4中N 浓度大于NH4Cl溶液中的N 浓度,其水解产生的c(H+)较大,故前者pH小。
3.(2020·日照高二检测)由一价离子组成的四种盐:AC、BD、AD、BC的溶液,在常温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则 ( )
【解析】选A。强酸强碱盐溶液呈中性;强酸弱碱盐溶液呈酸性;强碱弱酸盐溶液呈碱性;弱酸弱碱盐溶液可能呈中性、酸性、碱性。根据题意AC、BD溶液的pH=7,说明电离程度:AOH=HC,BOH=HD;AD溶液的pH>7,说明电离程度:AOH>HD;BC溶液的pH<7,说明电离程度:BOH
【素养提升】pH传感器,用来检测被测物中氢离子浓度并转换成相应的可用输出信号的传感器。pH传感器,通常由化学部分和信号传输部分构成。pH传感器可以测定大型反应槽或制程管路中的pH。实验室中使用pH传感器可以快速测定溶液中pH的变化,某化学兴趣小组进行了如下实验:
在烧杯中加入50 mL 0.01 ml·L-1的Na2CO3溶液,插入pH传感器。打开数字采集器并采集pH 数据, 打开磁力搅拌器,直到电脑屏幕显示的pH稳定。实验1:先慢慢加入Na2CO3粉末, 再慢慢加入NaHCO3粉末,实验结果见图1。实验2:先慢慢加入NaHCO3粉末, 再慢慢加入Na2CO3粉末,实验结果见图2。
(1)Na2CO3溶液呈碱性的原因是什么?提示:Na2CO3 电离出的C 属于弱酸的酸根,与水电离出的H+发生反应生成HC ,溶液中c(H+)减小,使水的电离平衡H2O H++OH-向正反应方向移动,c(OH-)增大,造成溶液中c(OH-)>c(H+),溶液呈碱性。
(2)实验1中向盛有Na2CO3溶液的烧杯中先加入Na2CO3粉末后加入NaHCO3粉末,图像先上升后下降的原因是什么?
提示:先慢慢加入Na2CO3粉末,溶液中c(C )增大,平衡C +H2O HC +OH-向正反应方向移动,c(OH-)增大,溶液pH上升,图像呈上升趋势,碱性增强;再慢慢加入NaHCO3粉末,溶液中c(HC )增大,平衡C +H2O HC +OH-向逆反应方向移动,c(OH-)减小,溶液pH下降,图像呈下降趋势,碱性减弱。
(3)实验2中向盛有Na2CO3溶液的烧杯中先加入NaHCO3粉末后加入Na2CO3粉末,图像先下降后上升的原因是什么?
提示:先慢慢加入NaHCO3粉末,溶液中c(HC )增大,平衡C +H2O HC +OH-向逆反应方向移动,c(OH-)减小,溶液pH下降,图像呈下降趋势,碱性减弱;再慢慢加入Na2CO3粉末,溶液中c(C )增大,平衡C +H2O HC +OH-向正反应方向移动,c(OH-)增大,溶液pH上升,图像呈上升趋势,碱性增强。
知识点二 盐类水解方程式的书写【重点释疑】1.盐类水解离子方程式的书写
2.常见5种盐类水解反应的离子方程式的书写一般形式:盐的弱碱阳离子(或弱酸根离子)+H2O 弱碱(或弱酸)+H+(或OH-)。
【易错提醒】书写盐类水解方程式的常见错误(1)把“ ”误写为“====”。如Fe3++3H2O====Fe(OH)3+3H+是错误的,正确的为Fe3++3H2O Fe(OH)3+3H+。(2)水解产物量很小时,标上“↑”或“↓”。如Al3++3H2O Al(OH)3↓+3H+是错误的,正确的为Al3++3H2O Al(OH)3+3H+。
(3)多元弱酸根离子的水解不分步表示。如:C +2H2O H2CO3+2OH-是错误的,正确的为C +H2O HC +OH-,HC +H2O H2CO3+OH-。
【思考·讨论】(1)NaHS水解的方程式写作HS-+H2O H3O++S2-正确吗?为什么? 提示:不正确。HS-+H2O H3O++S2-是HS-的电离方程式,水解方程式应写为HS-+H2O H2S+OH-。
(2)FeCl3溶液与NaHCO3溶液混合:Fe3++3HC Fe(OH)3↓+3CO2↑提示:错误。Fe3+与HC 互相促进水解,能进行到底,用等号表示。
【案例示范】【典例】(2020·聊城高二检测)下列离子方程式属于盐的水解,且书写正确的是( )A.FeCl3溶液:Fe3++3H2O====Fe(OH)3↓+3H+B.Na2S溶液:S-+2H2O H2S+2OH-C.NaHCO3溶液:HC +H2O H2O+CO2+OH-D.NH4Cl溶液:N +H2O NH3·H2O+H+
【解题指南】解答本题需注意以下3点:(1)首先必须辨清该物质是一步水解还是分步水解。(2)其次要注意“ ”“↑”“↓”等符号的使用。(3)水解程度很小一般不写水解产物的分解产物。
【解析】选D。A项, 应用“ ”且Fe(OH)3不应标“↓”;B项,S2-应分步水解;C项,应该写H2CO3,不应拆开。
【母题追问】(1)等物质的量浓度的B、C、D三种溶液中,阴离子浓度最大的是____________。 提示:B。等物质的量浓度的B、C、D三种溶液中,若不考虑阴离子的水解,阴离子浓度相同,但S2-+H2O HS-+OH-,阴离子数目增加,则浓度增大。
(2)等浓度的NaHCO3溶液和Na2CO3溶液相比,哪个pH大?提示:由碳酸的分步电离知,Ka1>Ka2,则Na2CO3的水解程度大于NaHCO3,故等浓度情况下,Na2CO3溶液的pH更大。
【迁移·应用】 下列水解离子方程式表达正确的是( )A.CH3COONa的溶液:CH3COO-+H2O====CH3COOH+OH-B.AlCl3的溶液:Al3++3H2O====Al(OH)3↓+3H+C.Na2CO3的溶液:C +H2O====H2CO3+2OH-D.NH4Cl的溶液:N +H2O NH3·H2O+H+
【解析】选D。水解反应属于可逆反应,离子方程式应用“ ”,故醋酸钠溶液中的水解离子反应为CH3COO-+H2O CH3COOH+OH-,故A错误;AlCl3水解离子方程式应用“ ”,由于水解反应是微弱的,不能用“↓”,所以应为Al3++3H2O Al(OH)3+3H+,故B错误;Na2CO3溶液中的水解反应分步进行,且以第一步为主,水解离子方程式应为C +H2O HC +OH-,故C错误;NH4Cl溶液中的水解离子方程式书写合理,故D正确。
【补偿训练】1.下列表示水解且离子方程式正确的是( )A.CH3COO-+H2O CH3COOH+OH-B.P +3H2O H3PO4+3OH-C.HS-+H2O S2-+H3O+D.ClO-+H2O HClO+OH-
【解析】选A。A项,CH3COO-水解显碱性,正确;B项,P 分步水解,错误;C项,HS-+H2O S2-+H3O+是HS-的电离方程式,错误;D项,连接符号应为“ ”,错误。
2.下列水解化学方程式或水解离子方程式正确的是( )A.F-+H2O HF+OH- B.N +H2O NH4OH+H+ C.CH3COOH+NaOH CH3COONa+H2OD.NaCl+H2O NaOH+HCl
【解析】选A。B项中的NH4OH应为NH3·H2O;C项为酸碱中和反应,其化学方程式应为CH3COOH+NaOH====CH3COONa+H2O,不是水解方程式;D项中NaCl不水解。
3.(1)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是______; ②若为弱酸强碱盐,其水解的离子方程式是_____。 (2)BiCl3的水解产物中有BiOCl生成。写出BiCl3水解反应的方程式:_______。
【解析】(1)若为强酸弱碱盐,则An+发生水解,水解反应的离子方程式为An++nH2O A(OH)n+nH+;若为弱酸强碱盐,则Bm-发生水解,水解的离子方程式是Bm-+H2O HB(m-1)-+OH-。(2)根据水解产物,可写出水解的化学方程式BiCl3+H2O BiOCl+2HCl。
答案:(1)①An++nH2O A(OH)n+nH+ ②Bm-+H2O HB(m-1)-+OH-(2)BiCl3+H2O BiOCl+2HCl
【素养提升】净水剂最常用的是絮凝剂,絮凝剂包括两大类:无机絮凝剂、有机絮凝剂。无机絮凝剂为高价金属盐,如硫酸铝、硫酸铁、氯化铁、四氯化钛及无机酸和碱。
(1)用离子方程式表示硫酸铝净水的原理。提示:Al3++3H2O Al(OH)3(胶体)+3H+,胶体具有吸附作用,可以净水。
(2)高铁酸盐(钠、钾)是六价铁盐,可用于水的消毒和净化。①高铁酸盐能够消毒的原因是什么?提示:高铁酸盐是六价铁盐,有效成分是高铁酸根,具有很强的氧化性,因此能通过氧化作用进行消毒。
②高铁酸盐为何又能起到净水的作用?写出有关离子方程式。提示:消毒时高铁酸盐的还原产物是Fe3+,在溶液中发生水解Fe3++3H2O Fe(OH)3(胶体)+3H+,胶体能够将水中的悬浮物聚集形成沉淀,能高效净水。
(3)工业中常利用四氯化钛水解制备TiO2,写出化学方程式。提示:TiCl4+(x+2)H2O TiO2·xH2O↓+4HCl
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教课课件ppt,共42页。PPT课件主要包含了正反应,逆反应,cOH-,在HCl气流中,FeOH3,Fe2O3,Al3+,HBHA,氧化镁或氢氧化镁,③②①等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三节 盐类的水解示范课课件ppt: 这是一份人教版 (2019)选择性必修1第三节 盐类的水解示范课课件ppt,共42页。PPT课件主要包含了图3-3-3,图3-3-4等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三节 盐类的水解教课课件ppt: 这是一份人教版 (2019)选择性必修1第三节 盐类的水解教课课件ppt,共35页。PPT课件主要包含了强酸强碱盐,强碱弱酸盐,强酸弱碱盐,2实验结论,OH-,NH3·H2O,H+或OH-,弱电解质,溶于水,水的电离等内容,欢迎下载使用。













