




必修2第一节 化学能与热能教学ppt课件
展开
这是一份必修2第一节 化学能与热能教学ppt课件,共16页。PPT课件主要包含了知识回顾等内容,欢迎下载使用。
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
相邻的原子(或离子)间强烈的相互作用力。
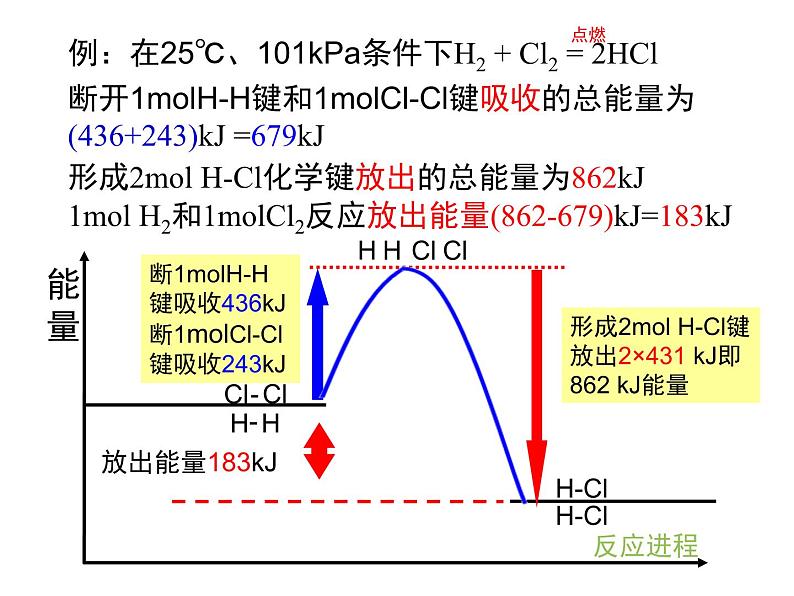
断开1ml H-H键要吸收的能量为436kJ。
断开1ml Cl-Cl键要吸收的能量为243kJ。
形成1ml Cl-Cl键放出的能量为243kJ。
[例 如] 在250C、101KPa的条件下:
形成1ml H-H键放出的能量为436kJ。
形成1ml化学键时释放的能量或断裂1ml化学键时吸收的能量。
H-H键能为436kJ/ml。
一、化学键与化学反应能量变化的关系
(二)化学键与热能间的内在联系:
1、化学键的断裂和形成是化学反应中能量变化的主要原因。
[思考]一个化学反应吸收能量还是放出能量是由什么决定的呢?
断开1mlH-H键和1mlCl-Cl键吸收的总能量为(436+243)kJ =679kJ
形成2ml H-Cl化学键放出的总能量为862kJ
1ml H2和1mlCl2反应放出能量(862-679)kJ=183kJ
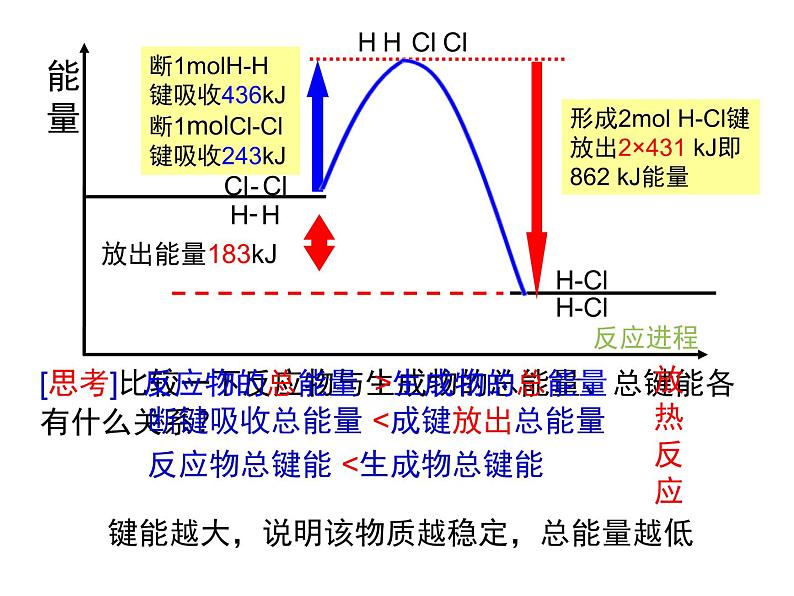
[思考]比较一下反应物与生成物的总能量、总键能各有什么关系?
断键吸收总能量 生成物的总能量
反应物总键能 成键放出总能量
反应物的总能量 生成物总键能
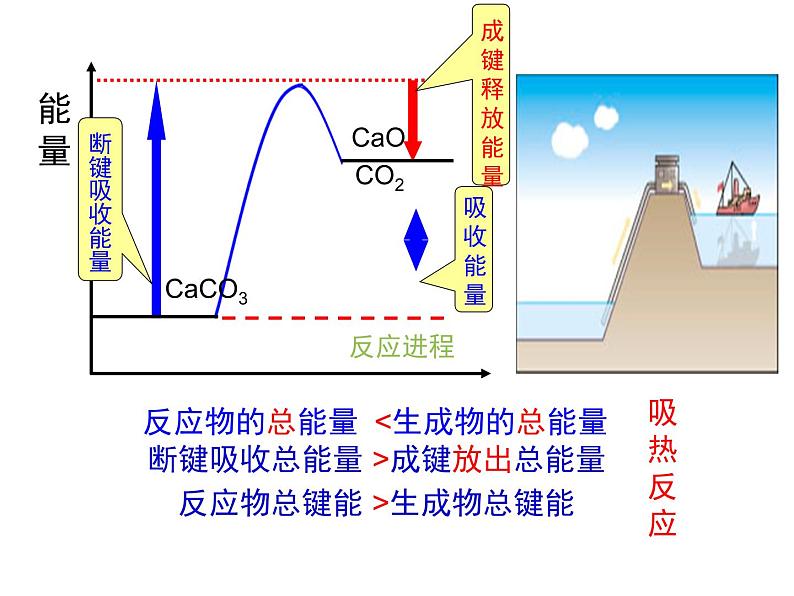
2、化学反应吸收能量或放出能量的决定因素:
微观:取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小。
宏观:决定于反应物的总能量与生成物的总能量的相对大小。
断键吸收总能量 > 成键放出总能量
3、化学反应中能量变化遵循能量守恒定律。
1、当物质发生化学反应时,断开反应物中的化学键要 ,而形成生成物中的化学键要 。一个化学反应是释放能量还是吸收能量取决于 。
反应物总能量与生成物总能量的相对大小
2、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( ) A. A的能量一定高于C B. B的能量一定高于D C. A和B的总能量一定高于C和D的总能量 D. 该反应为放热反应,故不必加热就一定发生
3、下列说法正确的是( )A .需要加热才能发生的反应一定是吸热反应B .任何放热反应在常温条件下一定能发生反应C .反应物和生成物所具有的总能量决定了反应结果是放热还是吸热D .吸热反应在一定条件下也能发生反应
4、下列各图中,表示正反应是吸热反应的是( )
5、常温常压下,已知反应:2H2+O2=2H2O,有关键能为:H-H:436kJ/ml、O-O:496kJ/ml、H-O:463KJ/ml,这个反应是放热还是吸热反应?
2H2 + O2 = 2H2O
相关课件
这是一份人教版 (新课标)必修2第一节 化学能与热能授课ppt课件,共34页。PPT课件主要包含了反应中的能量变化,思考与交流,酸碱浓度要准确,减少热量的散失,放出热量,吸收热量,化学反应,两个定律,D甲烷与O2反应,巩固练习等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)必修2第一节 化学能与热能教学课件ppt,共25页。PPT课件主要包含了知识回顾,化学反应的本质,化学键的断裂和形成,旧键的断裂,新键的生成,吸收能量,放出能量,化学能,实验2-1,铝片与盐酸的反应等内容,欢迎下载使用。
这是一份高中化学第二章 化学反应与能量第一节 化学能与热能教学ppt课件,共21页。PPT课件主要包含了水能载舟亦能覆舟,水能灭火,亦能点火,暖宝宝等内容,欢迎下载使用。










