




人教版(2024)九年级上册(2024)课题2 化学方程式教案配套课件ppt
展开同学们有吃烧烤的经历吗?大家知道木炭在燃烧过程中发生了什么样的变化吗?你能用文字表达式表示此反应吗?
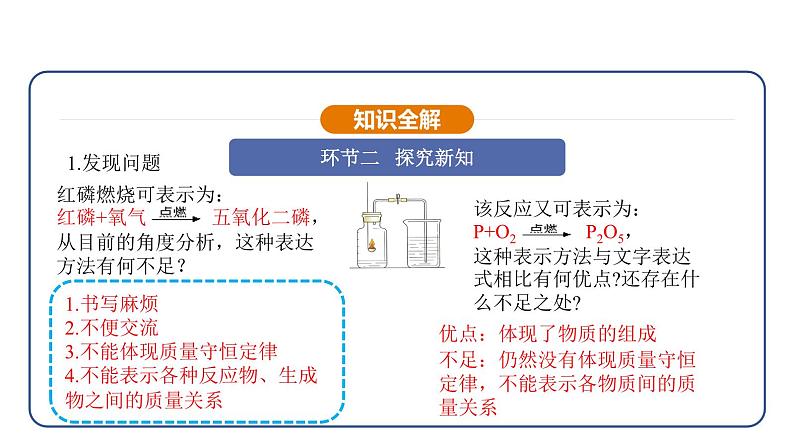
1.书写麻烦2.不便交流3.不能体现质量守恒定律 4.不能表示各种反应物、生成物之间的质量关系
1.通过完善符号表达式的讨论探究过程,了解化学方程式能提供的宏观及微观信息,初步认识化学特有的宏观-微观-符号三重表征的思维模式。2.通过科学史实体会科学家表征化学反应的智慧,了解化学学科由宏观到微观、由定性到定量的发展过程,初步认识定量研究对化学发展的推动作用。3.了解书写化学方程式应遵守的原则并能正确书写简单的化学方程式。
我们知道,元素可用元素符号表示,纯净物可用化学式表示,能不能用一个比较完美的方式表示化学反应呢?
知识点1 化学方程式的意义
红磷燃烧可表示为:红磷+氧气 五氧化二磷,从目前的角度分析,这种表达方法有何不足?
该反应又可表示为:P+O2 P2O5,这种表示方法与文字表达式相比有何优点?还存在什么不足之处?
优点:体现了物质的组成
不足:仍然没有体现质量守恒定律,不能表示各物质间的质量关系
1.书写麻烦 2.不便交流 3.不能体现质量守恒定律 4.不能表示各种反应物、生成物之间的质量关系
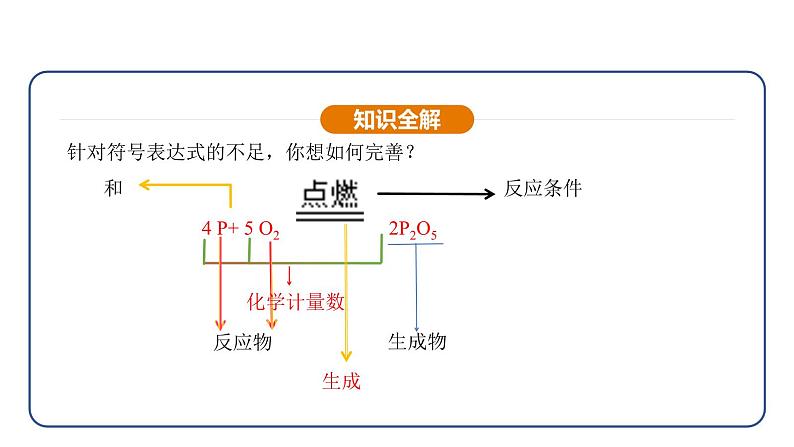
针对符号表达式的不足,你想如何完善?
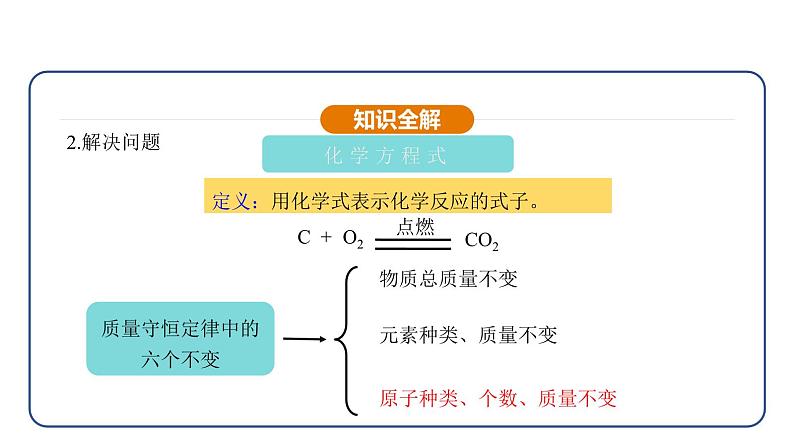
质量守恒定律中的六个不变
原子种类、个数、质量不变
定义:用化学式表示化学反应的式子。
如:实验室用过氧化氢溶液制取氧气的化学方程式为
2H2O2 2H2O+ O2↑
2H2O 2H2↑+ O2 ↑
3.解读化学方程式的信息结合这两个化学方程式,你能从化学方程式中获得哪些信息?
①反应物 反应条件 生成物
②微观粒子数目比 2 : 2 : 1
③质量比 (2×34) : ( 2×18) : (1×32)
④过氧化氢的化学性质:可分解
2H2O 2H2↑+ O2 ↑
①反应物是水,生成物是氢气和氧气;反应条件是通电;
②反应中,水、氢气和氧气的分子数目比为2 : 2 : 1;
③反应中,水、氢气、氧气的质量比为36 : 4 : 32=9 : 1 : 8;
④水在通电条件下,可以分解;
⑤利用该反应可制取氢气和氧气;
⑥该反应属于分解反应……
2H2O 2H2↑+ O2 ↑
(1)物质变化(宏观)的角度——读出反应物、生成物和反应条件①水在通电条件下,生成氢气和氧气。②水在通电条件下,分解生成氢气和氧气。(2)质量角度——读出反应中各物质间的质量比③通电时,每36份质量的水完全分解生成4份质量的氢气和32份质量的氧气。(3)微观角度——读出微观粒子的名称及其数目④通电时,每2个水分子完全分解生成2个氢分子和1个氧分子。
1.化学方程式的书写原则
C+O2 CO2
(1)必须以客观事实为基础,不能凭空臆造事实上不存在的物质和化学反应;
(2)要遵守质量守恒定律,等号两边各原子的种类和数目必须相等。
知识点2 化学方程式的书写
2.化学方程式的书写步骤
以书写磷在空气中燃烧的化学方程式为例:
(1)在短线两边写出反应物与生成物的化学式并标明反应发生条件;
注意:点燃≠燃烧、加热≠高温、通电≠电解
(2)用计量数配平化学方程式,遵守质量守恒定律;
(3)标注生成物状态“↑”或“↓”;
(4)检查化学式书写是否正确,化学方程式是否配平,反应条件是否正确,生成物状态符号标注是否恰当,最后将短线改为等号。
(2)配平时,只能在化学式前配上一定的化学计量数,而不能改变化学式中右下角的数字。
(3)化学计量数1可以省略不写,各化学式前的计量数必须是最简整数比。
(1)化学方程式等号两边不能有相同的化学式。
①当生成物中有气体,而反应物中没有气体时,要在气体物质的化学式右边标注“↑”。
②对于溶液中的反应,如果反应物中无固体,生成物中有固体,在固体物质的化学式右边要注“↓”。
(4)细节符号要标清:什么情况下要标“↑”“↓”。
③如果反应物和生成物中都有气体,气体生成物就不需注“↑”。
④溶液中的反应如果反应物和生成物中都有固体,固体生成物也不需注“↓”。
知识点3 化学方程式的配平
这种方法对一些简单的方程式很有效,凑数进行配平。
①找出式子两边各只出现一次,且反应前后原子数最多的原子,求其数目的最小公倍数;
②用所得最小公倍数分别除以含有该元素的化学式中的原子数目,商即为该物质的化学计量数;
③根据原子守恒,由已知化学计量数逐步配平其他物质的化学计量数。
最小公倍数2×5=10
①找出式子两边出现次数最多且短线两边该原子总数为一边奇数、一边偶数的元素;
②把奇数的化学式前配偶数(优先考虑×2);
①从反应物或生成物中找出化学式比较复杂的一种物质,将其化学计量数定为1;
②以已定“1”的化学式为基准,推求其他物质的化学计量数;
用化学式表示化学反应的式子
1.根据化学方程式不能获得的信息是( )A.反应发生所需要的条件 B.化学反应的快慢C.该反应的化学反应类型 D.各物质间的质量比
解析:从化学方程式获得的信息主要有反应物、生成物、反应条件、各物质间质量的关系,不可以获得化学反应的快慢。
2.从氢气在氧气中燃烧的化学方程式:2H2+O2 2H2O中获得以下信息:①该反应的发生条件是点燃;②该反应的反应物是氢原子和氧原子;③反应前后元素种类不变;④反应前后原子数目不变;⑤反应前后分子总数保持不变;⑥在反应中氧气和水的质量比为8∶9。其中正确的是( )A.①②③④ B.②④⑤⑥ C.①③④⑥D.②③④⑥
解析:该反应发生条件是点燃,①正确;该反应的反应物是氢气和氧气,从微观的角度分析参加反应的是氢分子和氧分子,②错误;该反应前含有氢、氧元素,反应后也只含有氢、氧元素,反应前后元素种类不变,③正确;反应前后原子个数不变,④正确;微观上,反应前有3个分子,反应后分子个数是2,反应前后分子总数发生了改变,⑤错误;反应中氧气和水的质量比为32:(18×2)=8:9,⑥正确。正确的有①③④⑥。
3.CO具有可燃性,可作燃料,对CO燃烧的化学方程式:2CO+O2 2CO2所能表达的意义,下列说法错误的是( )A.一氧化碳和氧气在点燃的条件下反应生成二氧化碳B.参加反应的CO、O2与生成的CO2的粒子个数比是2∶1∶2C.每28份质量的CO和16份质量的O2在点燃的条件下完全反应生成88份质量的CO2D.每2个一氧化碳分子和1个氧分子在点燃的条件下完全反应生成2个二氧化碳分子
解析:A.由化学方程式可知,CO和O2,在点燃的条件下生成二氧化碳,A正确;B.由化学方程式可知,参加反应的CO、 O2,与生成的CO2的粒子个数比是2:1:2,B正确;C.由化学方程式可知,每56份质量的CO和32份质量的O2,在点燃的条件下生成88份质量的CO2 ,C错误;D.由化学方程式可知,每2个一氧化碳分子和1个氧气分子在点燃的条件反应生成2个二氧化碳分子,D正确。
4.三硝酸甘油酯是一种黄色的油状透明液体,医学上可以用于治疗心绞痛,这种液体可因受到震动而爆炸,其发生爆炸的化学方程式为4C3H5N3O9 12CO2↑+10H2O↑+6X↑+O2↑,则X的化学式是( )A.N2B.COC.NH3D.NO
解析:反应物中有12个碳原子、20个氢原子、12个氮原子、36个氧原子,生成物中有12个碳原子、20个氢原子、36个氧原子,还缺少12个氮原子,又因为X前面的系数为6,所以X的化学式为N2。
5.目前有关部门做出决定,司机酒后驾车会受到严惩。交警常用一种“酒精检测仪”检查司机是否酒后驾车。其反应原理为C2H5OH+4CrO3+6H2SO4==2X+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物X,则X的化学式为( )A.Cr2O3 B.CrSO3 C.Cr2(SO4)3 D.Cr2S3
解析:根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知反应物中含有的原子种类及原子个数为C:2;H:18;Cr:4;O:37;S:6。已知生成物中含有的原子种类及原子个数为C:2;H:18;O:13。比较分析可知X中含有Cr,S,和O元素,其原子个数分别为2,3和12故X的化学式为Cr2(SO4)3
(2)未注明或注错反应条件的是_______。 (3)没有配平的是_______。(4)“↑”或“↓”号使用不恰当的是_______。
(1)化学式书写有错误的是_______。
解析:(1)③④ (2)② (3)① (4)②
6.下列化学方程式均有错误,请用序号回答:
人教版(2024)九年级上册(2024)课题2 化学方程式课文内容ppt课件: 这是一份人教版(2024)九年级上册(2024)<a href="/hx/tb_c4049547_t3/?tag_id=26" target="_blank">课题2 化学方程式课文内容ppt课件</a>,共15页。PPT课件主要包含了归纳小结,三个要领,三个关键,计算步骤,计算注意事项等内容,欢迎下载使用。
科粤版(2024)九年级上册(2024)第四单元 化学式与化学方程式4.3 化学方程式课堂教学ppt课件: 这是一份科粤版(2024)九年级上册(2024)<a href="/hx/tb_c4053434_t3/?tag_id=26" target="_blank">第四单元 化学式与化学方程式4.3 化学方程式课堂教学ppt课件</a>,共26页。PPT课件主要包含了化学方程式的定义,一个碳原子,化学方程式的意义,化学计量数为1省略,质量关系,+16×2,符合质量守恒定律,练一练,不符合客观事实,不符合质量守恒定律等内容,欢迎下载使用。
初中科粤版(2024)4.3 化学方程式教课ppt课件: 这是一份初中科粤版(2024)<a href="/hx/tb_c4053434_t3/?tag_id=26" target="_blank">4.3 化学方程式教课ppt课件</a>,文件包含43化学方程式第2课时根据化学方程式的计算pptx、神舟18号发射成功mp4等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。













