



2025版高考化学一轮复习真题精练第十一章化学实验第42练定量型化学实验课件
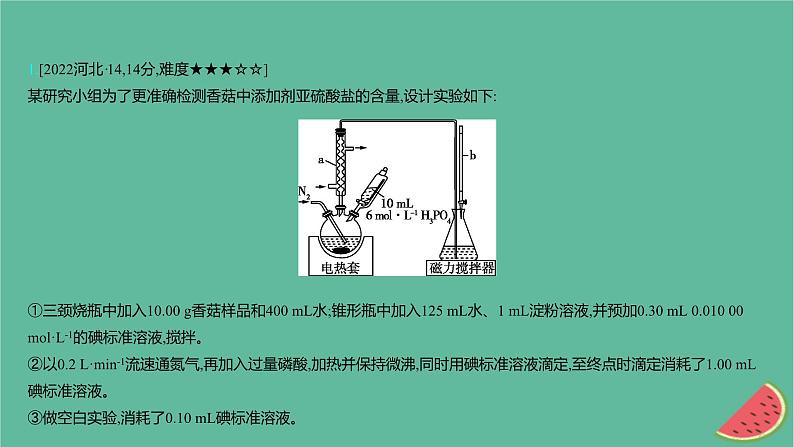
展开1.[2022河北·14,14分,难度★★★☆☆]某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:①三颈烧瓶中加入10.00 g香菇样品和400 mL水;锥形瓶中加入125 mL水、1 mL淀粉溶液,并预加0.30 mL 0.010 00 ml·L-1的碘标准溶液,搅拌。②以0.2 L·min-1流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00 mL碘标准溶液。③做空白实验,消耗了0.10 mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。已知:Ka1(H3PO4)=7.1×10-3, Ka1(H2SO3)=1.3×10-2回答下列问题:(1)装置图中仪器a、b的名称分别为 、 。 (2)三颈烧瓶适宜的规格为 (填标号)。 A.250 mL B.500 mL C.1 000 mL(3)解释加入H3PO4能够生成SO2的原因 。 (4)滴定管在使用前需要 、洗涤、润洗;滴定终点时溶液的颜色为 ;滴定反应的离子方程式为 。 (5)若先加磷酸再通氮气,会使测定结果 (填“偏高”“偏低”或“无影响”)。 (6)该样品中亚硫酸盐含量为 mg·kg-1(以SO2计,结果保留三位有效数字)。
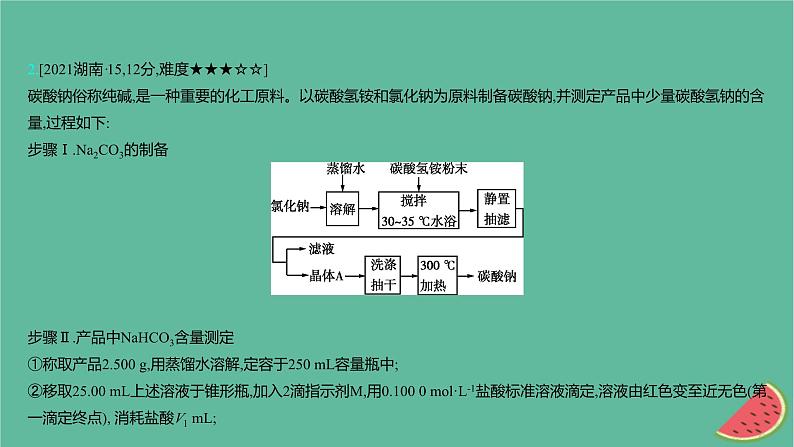
2.[2021湖南·15,12分,难度★★★☆☆]碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:步骤Ⅰ.Na2CO3的制备步骤Ⅱ.产品中NaHCO3含量测定①称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;②移取25.00 mL上述溶液于锥形瓶,加入2滴指示剂M,用0.100 0 ml·L-1盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点), 消耗盐酸V1 mL;
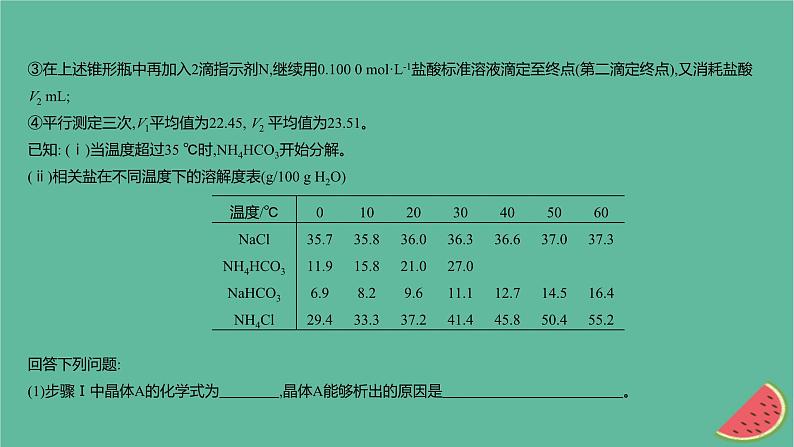
③在上述锥形瓶中再加入2滴指示剂N,继续用0.100 0 ml·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2 mL;④平行测定三次,V1平均值为22.45, V2 平均值为23.51。已知: (ⅰ)当温度超过35 ℃时,NH4HCO3开始分解。(ⅱ)相关盐在不同温度下的溶解度表(g/100 g H2O)回答下列问题:(1)步骤Ⅰ中晶体A的化学式为 ,晶体A能够析出的原因是 。
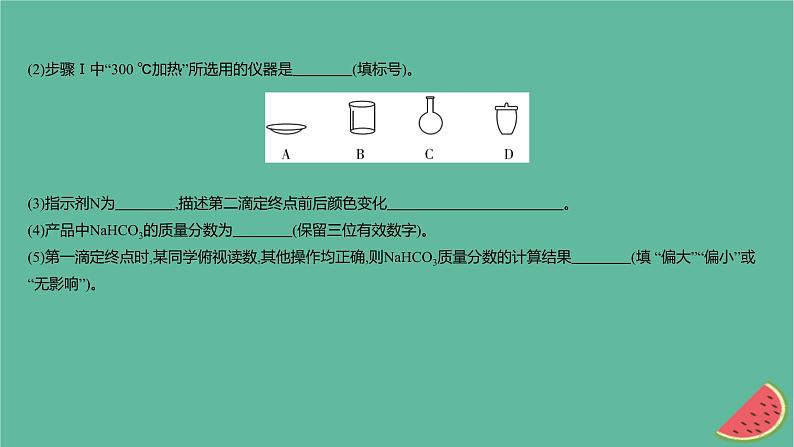
(2)步骤Ⅰ中“300 ℃加热”所选用的仪器是 (填标号)。 (3)指示剂N为 ,描述第二滴定终点前后颜色变化 。 (4)产品中NaHCO3的质量分数为 (保留三位有效数字)。 (5)第一滴定终点时,某同学俯视读数,其他操作均正确,则NaHCO3质量分数的计算结果 (填 “偏大”“偏小”或“无影响”)。
(7)步骤⑥需保证体系恢复到室温的原因是 (填序号)。 a.反应热受温度影响b.气体密度受温度影响c.反应速率受温度影响(8)Zn粉质量为a g,若测得H2体积为b mL,已知实验条件下ρ(H2)=d g·L-1,则c(CuSO4)= ml·L-1(列出计算表达式)。 (9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4) (填“偏高”“偏低”或“无影响”)。 (10)是否能用同样的装置和方法测定MgSO4溶液的浓度: (填“是”或“否”)。
【原理对接】 甲方案的测量原理是将CuSO4转化为BaSO4,然后称量出BaSO4的质量,再根据关系式BaSO4~CuSO4求出CuSO4的物质的量。因此实验中需要准确地获得BaSO4的质量。乙方案的原理是根据锌能与Cu2+、H+反应,先用足量的锌与一定量的CuSO4溶液反应,然后用足量的稀硫酸与锌反应,测量出生成的氢气的体积,由此计算出与硫酸反应消耗掉的锌的量,最后再根据与CuSO4溶液反应的锌的量求出CuSO4的物质的量,最后求出CuSO4溶液的物质的量浓度。
4.[2023全国乙·26,14分,难度★★★☆☆]元素分析是有机化合物的表征手段之一。按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。回答下列问题:(1)将装有样品的Pt坩埚和CuO放入石英管中,先 ,而后将已称重的U形管c、d与石英管连接,检查 。依次点燃煤气灯 ,进行实验。 (2)O2的作用有 。CuO的作用是 (举1例,用化学方程式表示)。
(3)c和d中的试剂分别是 、 (填标号)。c和d中的试剂不可调换,理由是 。 A.CaCl2 B.NaClC.碱石灰(CaO+NaOH) D.Na2SO3(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作: 。取下c 和d管称重。 (5)若样品CxHyOz为0.023 6 g,实验结束后,c管增重0.010 8 g, d管增重0.035 2 g。质谱测得该有机物的相对分子量为118,其分子式为 。
5.对于上述实验,下列做法正确的是( )A.进行容量瓶检漏时,倒置一次即可B.滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点C.滴定读数时,应单手持滴定管上端并保持其自然垂直D.滴定读数时,应双手一上一下持滴定管
【解析】 容量瓶检漏时,需先倒置看是否漏水,不漏水,再将容量瓶正放,旋转活塞180度,再倒置一次看是否漏水,因此进行容量瓶检漏时,需倒置两次,A错误;滴入半滴标准溶液,锥形瓶中溶液变色,且半分钟内溶液颜色不变化,才可判定达到滴定终点,B错误;滴定读数时,应单手持滴定管上端并保持其自然垂直,故C正确,D错误。
7.根据上述实验原理,下列说法正确的是( )A.可以用乙酸代替乙酸酐进行上述实验B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小D.步骤④中,若加水量不足,将导致测定结果偏大
2025版高考化学一轮复习真题精练第十一章化学实验第43练探究型化学实验课件: 这是一份2025版高考化学一轮复习真题精练第十一章化学实验第43练探究型化学实验课件,共20页。PPT课件主要包含了新考法等内容,欢迎下载使用。
2025版高考化学一轮复习真题精练第十一章化学实验第39练化学实验基本操作课件: 这是一份2025版高考化学一轮复习真题精练第十一章化学实验第39练化学实验基本操作课件,共19页。PPT课件主要包含了新考法等内容,欢迎下载使用。
2025版高考化学一轮复习真题精练第十一章化学实验第40练物质的检验分离和提纯课件: 这是一份2025版高考化学一轮复习真题精练第十一章化学实验第40练物质的检验分离和提纯课件,共20页。PPT课件主要包含了新考法等内容,欢迎下载使用。












