
河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题
展开
这是一份河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题,共21页。试卷主要包含了考生必须保持答题卡的整洁,下列关于燃烧热的说法正确的是,下列叙述不正确的是,下列能用勒夏特列原理解释的是等内容,欢迎下载使用。
周口恒大中学2023-2024学年上9月化学模拟考试
高二化学
满分:100分 考试时间:75分钟
注意事项:
1.答卷前,考生务必用黑色字迹铜笔或签字笔将自己的姓名、考生号、考场号和座位号填写在答题卡上。用2B铅笔将试卷类型(A)填涂在答题卡相应位置上,将条形码横贴在答题卡右上角“条形码粘贴处”。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效
4.考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5 Fe-56 Ag-108
一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法正确的是
A.升高温度能使化学反应速率增大,主要原因是降低了反应活化能
B.有气体参加的化学反应,增大压强一定可以增大化学反应速率
C.增大反应物浓度,可提高单位体积内活化分子的百分数,从而使有效碰撞次数增大
D.催化剂的加入能提高单位体积内活化分子百分数,从而增大化学反应速率
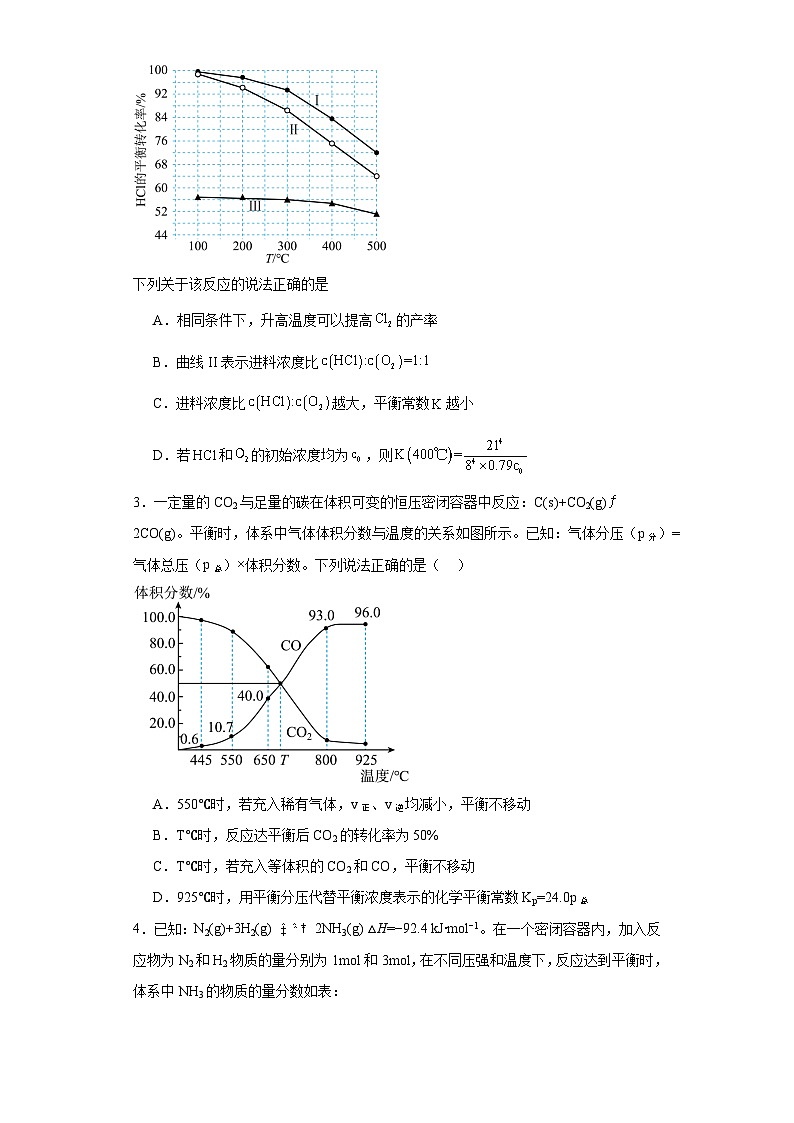
2.随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。科学家研究发现了直接氧化制备的反应:。如图为某刚性容器中,进料浓度比分别等于1:1、4:1、7:1时,的平衡转化率随温度变化的关系:
下列关于该反应的说法正确的是
A.相同条件下,升高温度可以提高的产率
B.曲线II表示进料浓度比
C.进料浓度比越大,平衡常数越小
D.若和的初始浓度均为,则
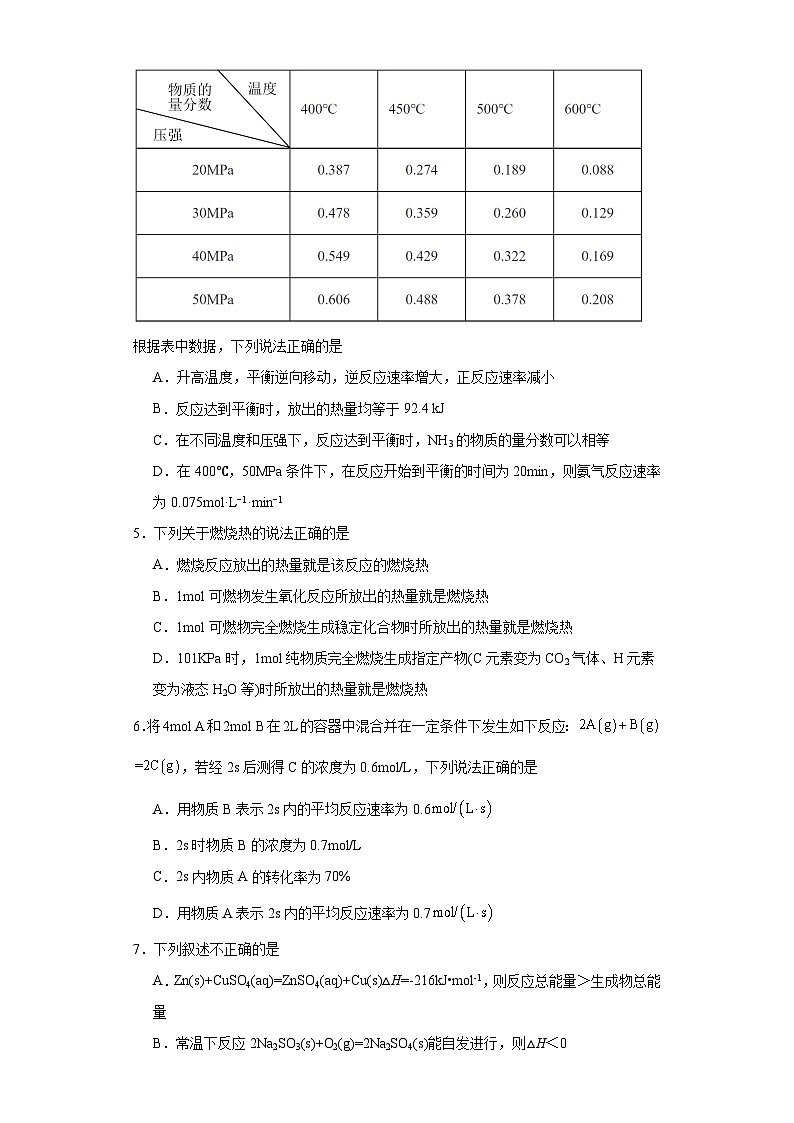
3.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.550℃时,若充入稀有气体,v正、v逆均减小,平衡不移动
B.T℃时,反应达平衡后CO2的转化率为50%
C.T℃时,若充入等体积的CO2和CO,平衡不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
4.已知:N2(g)+3H2(g) 2NH3(g) △H=−92.4 kJ∙mol−1。在一个密闭容器内,加入反应物为N2和H2物质的量分别为1mol和3mol,在不同压强和温度下,反应达到平衡时,体系中NH3的物质的量分数如表:
根据表中数据,下列说法正确的是
A.升高温度,平衡逆向移动,逆反应速率增大,正反应速率减小
B.反应达到平衡时,放出的热量均等于92.4 kJ
C.在不同温度和压强下,反应达到平衡时,NH3的物质的量分数可以相等
D.在400℃,50MPa条件下,在反应开始到平衡的时间为20min,则氨气反应速率为0.075mol·L−1·min−1
5.下列关于燃烧热的说法正确的是
A.燃烧反应放出的热量就是该反应的燃烧热
B.1mol可燃物发生氧化反应所放出的热量就是燃烧热
C.1mol可燃物完全燃烧生成稳定化合物时所放出的热量就是燃烧热
D.101KPa时,1mol纯物质完全燃烧生成指定产物(C元素变为CO2气体、H元素变为液态H2O等)时所放出的热量就是燃烧热
6.将4mol A和2mol B在2L的容器中混合并在一定条件下发生如下反应:,若经2s后测得C的浓度为0.6mol/L,下列说法正确的是
A.用物质B表示2s内的平均反应速率为0.6
B.2s时物质B的浓度为0.7mol/L
C.2s内物质A的转化率为70%
D.用物质A表示2s内的平均反应速率为0.7
7.下列叙述不正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216kJ•mol-1,则反应总能量>生成物总能量
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则不论在何种条件下都不可能自发
D.已知C(s)+O2(g)=CO2(g)△H1;C(s)+O2(g)=CO(g)△H2;则△H1<△H2
8.在体积均为1.0L的恒容密闭容器甲、乙中,起始投料量如表,在不同温度下发生反应:CO2(g)+C(s)2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是
容器
n(CO2)/mol
n(C)/mol
n(CO)/mol
甲
0.1
0.3
0
乙
0
0
0.4
A.曲线Ⅰ对应的是甲容器
B.a、b两点所处状态的压强大小关系:9pa>14pb
C.c点:CO的体积分数>
D.900K时,若起始向容器乙中加入CO、CO2、C各1mol,则v(正)>v(逆)
9.充分燃烧一定量丙烷气体放出的热量为xQ,完全吸收它生成的CO2恰好转化成酸式盐需6 mol·L-1的NaOH溶液100 mL,则丙烷的燃烧热为
A.-16xQ B.-5xQ C.-4xQ D.-2xQ
10.下列能用勒夏特列原理解释的是
A.加入催化剂能使合成氨的反应速率加快
B.红棕色的NO2加热后颜色变深
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
二、不定项选择题:本题共5小题,每小题4分,共20分。在每小题给出的四个选项中,有一项或两项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分。
11.某温度下,在2L的恒容密闭容器中充入气体A和气体B发生反应生成气体C,反应过程中各组分的物质的量随反应时间的变化如图所示。下列说法正确的是
A.t1时刻反应达到平衡状态
B.该温度下,反应的平衡常数为300
C.该反应的化学方程式可表示为:A+3B2C
D.0~10min内平均速率v(B)=0.09mol·L-1·min-1
12.温度为T时,向2.00 L恒容密闭容器中充入1.00 molCH4, 发生反应:2CH4(g)C2H2(g)+3H2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
5
15
25
35
n(CH4)/mol
1.00
0.84
0.81
0.80
0.80
改变温度,测得不同温度下达平衡时C2H2的物质的量的变化曲线如图。下列说法正确的是( )
A.温度T时,前5sH2平均速率为0.024mol/(L·s)
B.温度T时,b点v(逆)>v(正)
C.该反应的平衡常数随温度升高逐渐减小
D.温度T时,若向2.00 L恒容密闭充入2.00 molC2H2和6.00 molH2,达到平衡时,C2H2转化率大于80%
13.已知可逆反应(A、B、C均为气体)在内的平均反应速率为,,。则x为( )
A. B. C. D.
14.如图分别代表溴甲烷和三级溴丁烷发生水解的反应历程。下列说法错误的是
Ⅰ:CH3Br+ NaOH→CH3OH+NaBr
Ⅱ:(CH3)3CBr+NaOH→(CH3)3COH+NaBr
A.反应I的△H>0
B.反应Ⅱ有两个过渡态
C.增加氢氧化钠的浓度可使反应Ⅰ和Ⅱ速率都增大
D.反应过程中反应Ⅰ和Ⅱ都有C−Br的断裂和C−O键的形成
15.在容积为2L的刚性密闭容器中加入和,发生反应:。在其他条件不变的情况下,温度对反应的影响如图所示(注:T1、T2均大于300℃)。下列说法正确的是
A.该反应的
B.A点时,的转化率为
C.T2时,反应达到平衡时消耗的平均反应速率
D.T2时,该反应的化学平衡常数为
三、非选择题:本题共4小题,共50分。
16.(10分)影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的 H2O2溶液分别进行 H2O2的分解实验,实验报告如下表所示(现象和结论略)。
序号
温度/℃
催化剂
现象
结论
1
40
FeCl3溶液
2
20
FeCl3溶液
3
20
MnO2
4
20
无
①实验 1、2 研究的是 对 H2O2分解速率的影响。
②实验 2、3 的目的是 。
(2)查文献可知:Cu2+对 H2O2分解也有催化作用,为比较 Fe3+、Cu2+对 H2O2 分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
①定性分析:如图甲可通过观察 ,先定性比较得出结论。有同学提出 将 CuSO4溶液改为 CuCl2溶液更合理,其理由是 。
②定量分析:如图乙所示,实验时以收集到 40 mL 气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是 。
17.(14分)随原子序数的递增,八种短周期元素(用英文小写字母 表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)g在元素周期表的位置是 ;
(2)比较d、f 简单离子的半径大小(用化学式表示,下同) ,比较 g、h 最高价氧化物对应水化物酸性 ;
(3)d 的氢化物沸点高于 y 的氢化物沸点的原因 ;
(4)写出 f 的最高价氧化物对应的水化物与 h 的最高价氧化物对应 的水化物反应的离子方程式 ;
(5)由元素 f、h 形成的物质X与由元素 x、z 形成的化合物 Y 可发生以下 反应:
①写出 M 的电子式 ;
②写出 X 溶液与 Y 溶液反应的离子方程式 ;
18.(12分)合成氨是人类科学技术上的一项重大突破,工业合成氨的简式流程图如下
(1)天然气中的H2S杂质常用氨水吸收,写出足量的H2S与氨水反应的化学方程式: 。
(2)步骤II中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为 。
(3)下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数 。
(4)依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图 。
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是 (填序号)。简述本流程中提高合成氨原料总转化率的方法 。
19.(14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
Ⅰ.利用反应:6NO2+8NH37N2+12H2O处理
Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)SO3(g)+NO(g)-Q (Q>0)
Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)CH3OH(g)
(1)硫离子的电子结构示意图为 ,氨气分子的电子式为 ,氨气分子属于 分子(填“极性”或者“非极性”)。
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为 ,能证明其递变规律的事实是 。
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)= 。
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
参考答案:
1.D
【分析】
【详解】A.升高温度能使化学反应速率增大,主要原因是增大了反应物分子的能量,更多的分子变为活化分子,而反应活化能不变,A错误;
B.有气体参加的化学反应,若是容器的容积不变,向其中加入与体系无关的物质,使体系压强增大,但各物质的浓度不变,化学反应速率不变,B错误;
C.增大反应物浓度,可提高单位体积内分子总数,活化分子数目增大,从而使有效碰撞次数增大,但是活化分子的百分数不变,C错误;
D.催化剂的加入能降低反应的活化能,提高单位体积内活化分子百分数,从而增大化学反应速率,D正确;
故选D。
2.D
【详解】A.据图示可知,其他条件相同时,升高温度,的转化率降低,即平衡逆向移动,的产率降低,A错误;
B.越大,的转化率越低,则时对应曲线,B错误;
C.平衡常数只与温度有关,C错误;
D.若和的初始浓度均为,即进料浓度比,温度为时的转化率为84%,应用三段式计算:
初始浓度/) 0 0
变化浓度/
平衡浓度/
,D正确;
故选D。
3.C
【详解】A. 550℃时,在体积可变的恒压密闭容器中充入稀有气体,等效于扩容减压,v正、v逆均减小,平衡右移,A错误;
B. T℃时,CO2和CO体积分数为50%,1-x=2x,x=反应达平衡后 ,B错误;
C. T℃时,充入等体积的CO2和CO,CO2和CO体积分数仍为50%,不影响原来平衡状态,平衡不移动,C正确;
D. 925℃时,CO的体积分数为96%,则CO2的体积分数都为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数,,D错误;
答案选C。
4.C
【详解】A.升高温度,逆反应速率增大,正反应速率增大,升温向吸热反应进行即逆向移动,故A错误;
B.该反应都是可逆反应,N2和H2物质的量分别为1mol和3mol在容器中反应,当反应达到平衡时,放出的热量均小于92.4kJ,故B错误;
C.在不同温度和压强下,根据图中信息,反应达到平衡时,450℃、50MPa 的NH3的物质的量分数与400℃,压强在30MPa~40Mpa的NH3的物质的量分数可能相等,故C正确;
D.在400℃,50MPa条件下,在反应开始到平衡的时间为20min,,根据题意得到,a=0.75,但由于容器的体积不知,因此无法计算出氨气反应速率,故D错误。
综上所述,答案为C。
5.D
【详解】A.可燃物燃烧可以是完全燃烧也可以是不完全燃烧,而燃烧热必须是完全燃烧放出的热量,选项A错误;
B.燃烧热是1mol可燃物燃烧生成稳定氧化物放出的热量,一般H→H2O(l),C→CO2(g),S→SO2(g),选项B错误;
C.燃烧热是1mol可燃物燃烧生成稳定氧化物放出的热量,选项C错误;
D.时,纯物质完全燃烧生成指定产物(C元素变为CO2气体、H元素变为液态H2O等)时所放出的热量就是该物质的燃烧热,选项D正确。
答案选D。
6.B
【详解】
A.所以用物质B表示2s内的平均反应速率为,选项A错误;
B.2s时物质B的浓度为0.7mol/L,选项B正确;
C.2s内物质A的转化率为,选项C错误;
D.用物质A表示2s内的平均反应速率为,选项D错误。
答案选B。
7.C
【详解】A.反应Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216kJ•mol-1、是放热反应,则反应物总能量大于生成物总能量,故A正确;
B.反应2Na2SO3(s)+O2(g)=2Na2SO4(s)的熵变△S<0,常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H-T△S<0,即△H<T△S<0,故B正确;
C.CaCO3(s)=CaO(s)+CO2(g) △H>0,△S>0,则该反应在高温下能自发进行,故C错误;
D.C(s)+O2(g)=CO2(g)△H1,C(s)+O2(g)=CO(g)△H2,则|△H1|>|△H1|,但燃烧反应的焓变为负,所以△H1<△H2,故D正确;
故选C。
8.C
【详解】A.固体物质不应平衡移动,乙投入0.4mol一氧化碳相当于投入0.2mol二氧化碳,所以乙相当于两个甲容器加压,无论平衡如何移动,乙中一氧化碳浓度一定大于甲,故图中曲线Ⅰ对应的是乙容器,A错误;
B.甲容器b处
乙容器a处
若a、b两点所处温度相同,压强比等于物质的量之比,pa:pb=(0.12+0.16):(0.02+0.16)=14:9,即9pa=14pb,由于b点温度更高,故a、b两点所处状态的压强大小关系:9paC;同一主族从上到下,非金属性减弱,故O>S;
a.最高价氧化物对应水化物的酸性,与非金属性一致,但氧元素无最高正价,a不合题意;
b.气态氢化物的沸点是物理性质,与非金属无关,b不合题意;
c.单质与氢气反应的难易程度,与非金属一致,c符合题意;
d.其两两组合形成的化合物中元素的化合价,显正价的说明非金属性较弱,显负价的说明非金属较强,d符合题意;
故答案为:O>C;cd;
(3)根据Ⅰ中的反应6NO2+8NH37N2+12H2O分析可知,每转移24mol电子,消耗6molNO2,故120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,即消耗了0.3molNO2,故则0~10min时,平均速率(NO2)== 0.015mol/(L·min),故答案为:0.015mol/(L·min);
(4) a.分析反应可知,反应前后气体的体积保持不变,故体系压强保持不变不能说明反应达到平衡状态,a不合题意;
b.各组分的浓度、百分含量保持不变,说明达到化学平衡,故NO2浓度保持不变能说明反应达到平衡状态,b符合题意;
c.假设一开始加入的NO2为xmol,反应转化了ymol,则NO2和SO3的体积比保持不变可推知:x-y=y,故y为特定值,即达到化学平衡,c符合题意;
d.混合气体的平均相对分子质量在数值上等于气体的平均摩尔质量等于气体的总质量除以气体的总物质的量,气体的总质量和气体的总物质的量均保持不变,故混合气体的平均相对分子质量保持不变不能说明反应达到化学平衡,d不合题意;
故答案为:bc。
相关试卷
这是一份河南省周口恒大中学2023-2024学年高三下学期开学化学试题,共19页。试卷主要包含了考生必须保持答题卡的整洁,下列化学用语表达正确的是,下列各组物质,一定是同系物的是,下列分类或归类正确的是等内容,欢迎下载使用。
这是一份河南省周口市川汇区周口恒大中学2023-2024学年高二上学期12月月考化学试题含答案,共25页。试卷主要包含了考生必须保持答题卡的整洁,下列物质中属于弱电解质的是等内容,欢迎下载使用。
这是一份河南省周口市川汇区周口恒大中学2023-2024学年高一上学期12月月考化学试题含答案,共18页。试卷主要包含了考生必须保持答题卡的整洁,下列说法不正确的是,下列事实与胶体性质无关的是,化学与生产、生活密切相关等内容,欢迎下载使用。








