

人教版 (2019)必修 第二册第二节 乙烯与有机高分子材料导学案
展开1.甲烷、乙烯、乙炔的结构与性质比较
2.常见烃代表物的空间结构
(1)甲烷:键角为109°28′,正四面体形分子,最多有3个H原子或1个C原子和2个H原子在同一平面内,最多有2个原子在同一条直线上。
(2)乙烯:键角为120°,平面形分子,6个原子在同一平面内,最多有2个原子在同一条直线上。
(3)乙炔:键角为180°,直线形分子,4个原子在同一直线上。
(4)苯:键角为120°,平面正六边形分子,12个原子在同一平面内,最多有4个原子在同一条直线上。
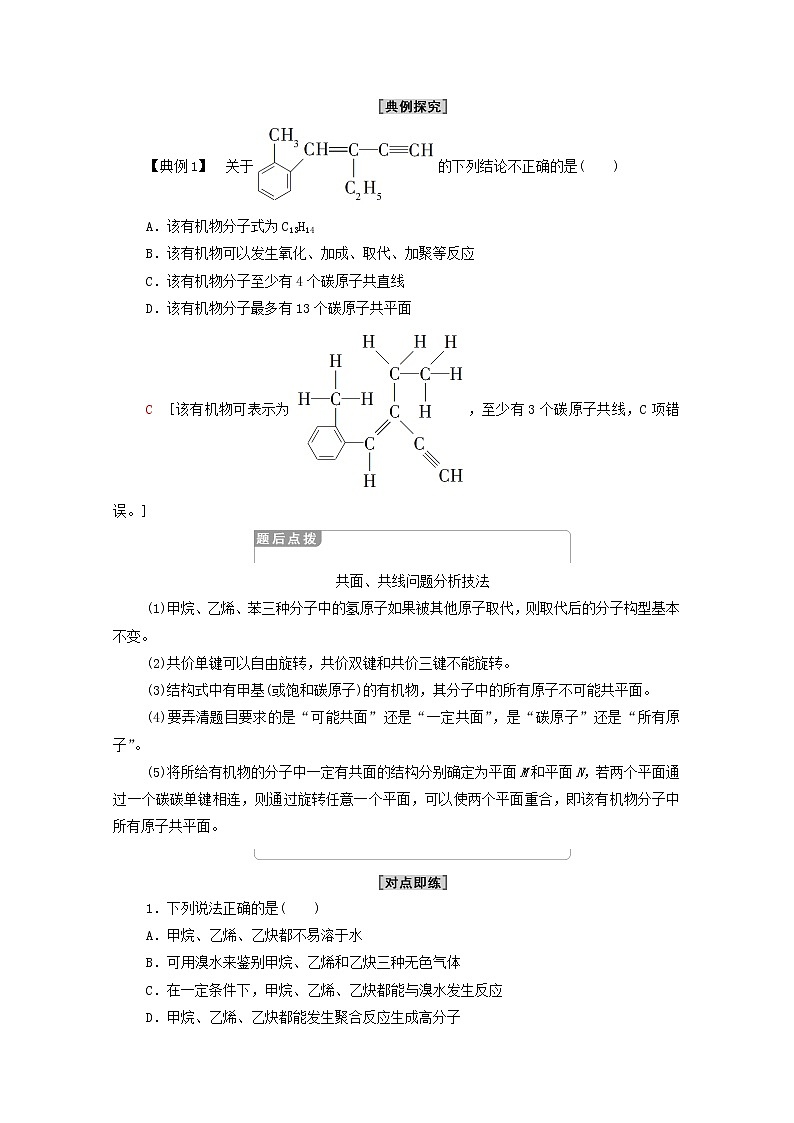
【典例1】 关于的下列结论不正确的是( )
A.该有机物分子式为C13H14
B.该有机物可以发生氧化、加成、取代、加聚等反应
C.该有机物分子至少有4个碳原子共直线
D.该有机物分子最多有13个碳原子共平面
C [该有机物可表示为,至少有3个碳原子共线,C项错误。]
共面、共线问题分析技法
(1)甲烷、乙烯、苯三种分子中的氢原子如果被其他原子取代,则取代后的分子构型基本不变。
(2)共价单键可以自由旋转,共价双键和共价三键不能旋转。
(3)结构式中有甲基(或饱和碳原子)的有机物,其分子中的所有原子不可能共平面。
(4)要弄清题目要求的是“可能共面”还是“一定共面”,是“碳原子”还是“所有原子”。
(5)将所给有机物的分子中一定有共面的结构分别确定为平面M和平面N,若两个平面通过一个碳碳单键相连,则通过旋转任意一个平面,可以使两个平面重合,即该有机物分子中所有原子共平面。
1.下列说法正确的是( )
A.甲烷、乙烯、乙炔都不易溶于水
B.可用溴水来鉴别甲烷、乙烯和乙炔三种无色气体
C.在一定条件下,甲烷、乙烯、乙炔都能与溴水发生反应
D.甲烷、乙烯、乙炔都能发生聚合反应生成高分子
A [甲烷、乙烯、乙炔都不易溶于水,A项正确;乙烯和乙炔均能使溴水褪色,两者无法用溴水来鉴别,B项错误;在一定条件下,乙烯和乙炔可与溴水中的溴发生加成反应,甲烷不能与溴水反应,C项错误;乙烯和乙炔可在一定条件下发生聚合反应生成高分子,但甲烷不能发生聚合反应,D项错误。]
2.已知HCN是直线形结构,下列有机分子中,所有的原子不可能位于同一平面的是( )
A.CH2===CH—CN
B.CH2===CH—CH===CH2
C.
D.
[答案] D
烃完全燃烧的通式为CxHy+eq \b\lc\(\rc\)(\a\vs4\al\c1(x+\f(y,4)))O2eq \(――→,\s\up10(点燃))xCO2+eq \f(y,2)H2O(x>0,y>0,下同)。
1.等物质的量(体积相同)的烃(CxHy)完全燃烧规律
(1)耗氧量多少取决于x+eq \f(y,4)的值,x+eq \f(y,4)越大,耗氧量越多。
(2)生成CO2的量的多少取决于x的值,x的值越大,生成CO2越多。
(3)生成水的量的多少取决于eq \f(y,2)的值,eq \f(y,2)的值越大,生成水的量越多。
2.等质量的不同烃完全燃烧时的耗氧规律
氢元素的质量分数越大,消耗O2越多,产生的H2O越多;反之碳元素的质量分数越大,消耗O2越少,产生的CO2则越多。等质量的烃完全燃烧时,消耗氧气的量取决于CxHy中eq \f(y,x)的值,此值越大,耗氧量越多。
3.最简式相同的烃燃烧时的规律
最简式相同的烃不论以何种比例混合,只要混合物总质量一定,完全燃烧后生成的CO2和H2O及耗氧量一定。
4.烃完全燃烧前后气体体积变化规律
CxHy+eq \b\lc\(\rc\)(\a\vs4\al\c1(x+\f(y,4)))O2eq \(――→,\s\up10(点燃))xCO2+eq \f(y,2)H2O
1 x+eq \f(y,4) x eq \f(y,2)
(1)燃烧后温度高于100 ℃,即水为气态:
ΔV=V后-V前=eq \f(y,4)-1eq \b\lc\{\rc\ (\a\vs4\al\c1(y=4时,ΔV=0,体积不变,y>4时,ΔV>0,体积增大,y<4时,ΔV<0,体积减小,y<4的烃只有C2H2))
(2)燃烧后温度低于100 ℃,即水为液态:ΔV=V后-V前=x-eq \b\lc\[\rc\](\a\vs4\al\c1(1+\b\lc\(\rc\)(\a\vs4\al\c1(x+\f(y,4)))))=-1-eq \f(y,4)<0,气体体积一定减小。
【典例2】 在105 ℃、101 kPa时,取1 L两种气态烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。有下列组合的混合烃:①C2H4和C3H4 ②CH4和C2H6 ③CH4和C3H4 ④C2H2和C3H6,其中可能符合上述要求的是 ( )
A.①② B.①③④ C.①③ D.②④
B [气态烃一般是指碳原子数小于等于4的烃。先假设该气态烃的混合物的平均分子式为CxHy。烃类燃烧的通式为CxHy+eq \b\lc\(\rc\)(\a\vs4\al\c1(x+\f(y,4)))O2eq \(――→,\s\up10(点燃))xCO2+eq \f(y,2)H2O。当温度超过100 ℃时,水为气体。根据题意,燃烧前后气体的体积不变,因此有1+x+eq \f(y,4)=x+eq \f(y,2),解得y=4。所给的4个组合中,碳原子数均小于4,符合气态烃的要求,因此只需要看氢原子数能不能平均到4即可。而要平均到4,肯定是一个比4大,一个比4小(或者均等于4)。组合①中氢原子数均为4,符合要求;组合②中氢原子数平均值肯定大于4,不符合要求;组合③中氢原子数均为4,符合要求;组合④中氢原子数一个为2,一个为6,可以平均到4,符合要求。]
“平均思想”判断有机物组成
(1)若平均分子组成中,存在1<N(C)<2,则一定有CH4;若平均分子组成中,存在2<N(H)<4,则一定有C2H2。
(2)若M混<26,则一定有CH4;若M混<28(烷烃、烯烃的混合物),则一定有CH4。
3.由两种气态烷烃组成的混合物,在标准状况下的密度为1.16 g·L-1,则关于该混合物组成的判断正确的是( )
A.一定有甲烷
B.一定有乙烷
C.一定是甲烷和乙烷的混合物
D.可能是乙烷和丙烷的混合物
A [混合气体的平均摩尔质量M=1.16 g·L-1×22.4 L·ml-1≈26 g·ml-1,即平均相对分子质量为26,在烷烃中相对分子质量小于26的只有甲烷,因此一定含有甲烷。]
4.燃烧0.1 ml两种气态碳氢化合物的混合物,生成3.58 L CO2(标准状况)和3.6 g H2O则混合气体中( )
A.一定有甲烷 B.一定有乙烷
C一定无甲烷 D.一定有丙烷
A [生成的n(CO2)=eq \f(3.58 L,22.4 L·ml-1)≈0.16 ml,生成的n(H2O)=eq \f(3.6 g,18 g·ml-1)=0.2 ml,因此该气态混合物的平均分子组成为C1.6H4,而分子中碳原子数小于1.6的碳氢化合物只有甲烷,故另一种碳氢化合物应为分子中氢原子数为4、碳原子数大于或等于2的气态碳氢化合物。]
5.等物质的量的下列烃完全燃烧,消耗O2最多的是( )
A.CH4 B.C2H6 C.C3H8 D.C5H10
D [假定各烃的物质的量为1 ml,各项代入烷烃CxHy燃烧耗氧量公式n(O2)=x+eq \f(y,4) ml,A项,eq \b\lc\(\rc\)(\a\vs4\al\c1(1+\f(4,4))) ml=2 ml,B项,eq \b\lc\(\rc\)(\a\vs4\al\c1(2+\f(6,4))) ml=3.5 ml,C项,eq \b\lc\(\rc\)(\a\vs4\al\c1(3+\f(8,4))) ml=5 ml,D项,eq \b\lc\(\rc\)(\a\vs4\al\c1(5+\f(10,4))) ml=7.5 ml。]
6.一种能使溴水褪色的气态烃,标准状况下,5.6 L该气态烃的质量为10.5 g,完全燃烧时生成16.8 L二氧化碳和13.5 g水,则该烃的分子式为________。
[解析] 能使溴水褪色,说明含有碳碳双键。标准状况下,5.6 L该气态烃的物质的量n(烃)=eq \f(5.6 L,22.4 L·ml-1)=0.25 ml,则该烃的摩尔质量为eq \f(10.5 g,0.25 ml)=42 g·ml-1,其相对分子质量为42。16.8 L CO2中含有n(C)=eq \f(16.8 L,22.4 L·ml-1)=0.75 ml,13.5 g水中含有n(H)=eq \f(13.5 g,18 g·ml-1)×2=1.5 ml,所以该烃分子中n(C)∶n(H)=0.75 ml∶1.5 ml=1∶2,由分子式符合(CH2)n的形式,解得n=eq \f(42,14)=3,所以该烃的分子式是C3H6。
[答案] C3H6
[素材一] 乙烯催熟作用的发现史
中国古代就发现将果实放在燃烧香烛的房子里可以促进采摘果实的成熟。19世纪德国人发现在泄漏的煤气管道旁的树叶容易脱落。第一个发现植物材料能产生一种气体,并对邻近植物产生影响的是卡曾斯,他发现橘子产生的气体能催熟与其混装在一起的香蕉。直到1934年甘恩(Gane)才首先证明植物组织确实能产生乙烯。随着气相色谱技术的应用,使乙烯的生物化学和生理学研究方面取得了许多成果,并证明在高等植物的各个部位都能产生乙烯,1966年乙烯被正式确定为植物激素。
[素材二] 乙烯在工业方面的应用
(1)乙烯涉及很多方面,是重要的有机化工基本原料,主要用于生产聚乙烯、氯乙烯及聚氯乙烯,乙苯、苯乙烯及聚苯乙烯以及乙丙橡胶等。
(2)在有机合成方面,广泛用于合成乙醇、环氧乙烷及乙二醇、乙醛、乙酸、丙醛、丙酸及其衍生物等多种基本有机合成原料;经卤化,可制氯代乙烯、氯代乙烷、溴代乙烷;经齐聚可制α烯烃,进而生产高级醇、烷基苯等。
(3)同时乙烯也是空气污染物之一,工业区乙烯含量达到1 ppm(百万分之一),能够生成甲醛和一氧化碳,危害人类健康。
[素材三] 硫化橡胶合成
天然橡胶容易老化,但经过硫化工艺后的橡胶不仅抗老化,而且具有较高的强度、韧性、良好的弹性和化学稳定性等。
1.根据素材一,如果把青橘子和熟苹果放在同一个塑料袋里,系紧袋口,一段时间后青橘子就可以变黄、成熟。其原因是什么?
提示:熟苹果能产生乙烯,乙烯可以调节植物生长,可用于催熟果实。
2.根据素材二,乙烯能合成聚乙烯、乙醇、溴乙烷等有机物,请写出有关化学方程式。
提示:nCH2===CH2eq \(―――→,\s\up10(催化剂))
CH2===CH2+H2Oeq \(―――――→,\s\up10(催化剂),\s\d10(加热、加压))CH3CH2OH
CH2===CH2+HBreq \(――→,\s\up10(催化剂),\s\d10(△))CH3CH2Br
3.根据素材三:
(1)天然橡胶为何容易老化?橡胶在加工过程中要加入硫黄等硫化剂进行硫化,其目的是什么?
(2)实验室盛哪些药品的试剂瓶的瓶塞不能用橡胶塞?
提示:(1)天然橡胶含有双键,易发生加成反应且易被氧化,所以易老化。硫化剂的作用是打开橡胶分子中的双键,以—S—S—将线型结构连接成为网状结构,得到化学稳定性好且既有弹性又有强度的橡胶。
(2)实验室中盛放KMnO4溶液、浓硝酸、液溴、汽油、苯、四氯化碳等药品的试剂瓶的瓶塞不能用橡胶塞。
通过素材一和素材二,让学生了解乙烯可用于催熟果实和乙烯在工业方面的应用,培养“宏观辨识与社会责任”的核心素养。通过素材三让学生了解橡胶的性能和硫化橡胶的形成原理和优良性能,培养“科学探究和社会责任”的核心素养。
1.下列关于烷烃与烯烃的性质及反应类型的对比中正确的是( )
A.烷烃只含有饱和键,烯烃只含有不饱和键
B.烷烃不能发生加成反应,烯烃只能发生加成反应
C.通式为CnH2n+2的一定是烷烃,通式为CnH2n的一定是烯烃
D.烷烃与烯烃相比,发生加成反应的一定是烯烃
D [烯烃中也可能含饱和键,如CH3—CH===CH2,A错;烯烃除发生加成反应外还易被氧化,B错;符合通式CnH2n的不一定是烯烃,如环丙烷,C错;D项正确。]
2.2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列有关聚乙炔的叙述中错误的是( )
A.聚乙炔是以乙炔为单体发生加聚反应生成的高聚物
B.聚乙炔的分子式为
C.聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D.聚乙炔树脂不加任何填充物即可成为电的良导体
D [乙炔在高温高压、催化剂条件下发生加聚反应生成聚乙炔,A正确;聚乙炔是由n个—CH===CH—组成的聚合物,分子式为,B正确;聚乙炔的链节为—CH===CH—,是一种碳原子之间单双键交替结合的结构,C正确;聚乙炔树脂经溴或碘填充之后导电性会提高到金属导体水平,成为电的良导体,D错误。]
3.(2019·全国卷Ⅲ改编)下列化合物的分子中,所有原子可能共平面的是( )
A.甲苯()
B.乙烷
C.丙炔(CH3—C≡CH)
D.1,3丁二烯(CH2===CH—CH===CH2)
[答案] D
4.a ml H2和b ml C2H2在密闭容器中充分反应后,生成c ml C2H4,将反应所得混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量为( )
A.eq \f(a+5b,2) ml B.(a+3b) ml
C.(b-c) ml D.(a+3b+2c) ml
A [根据原子守恒,反应所得混合气体完全燃烧消耗氧气的量就是a ml H2和b ml C2H2完全燃烧消耗O2的物质的量之和。根据碳元素守恒有n(CO2)=2n(C2H2)=2b ml,根据氢元素守恒有n(H2O)=n(C2H2)+n(H2)=(a+b) ml,根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O),2n(O2)=(5b+a) ml,即n(O2)=eq \f(a+5b,2) ml。]
5.(素养题)下图是异辛烷的球棍模型:
(1)根据球棍模型,写出异辛烷的结构简式:________;
异辛烷与乙烷的关系是___________________。
(2)写出异辛烷完全燃烧的化学方程式:___________________
(异辛烷用分子式表示)。1 ml异辛烷和1 ml正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的物质的量之差是________ml。
(3)异辛烷的同分异构体有很多,其中一种同分异构体X的分子结构中含有6个甲基,则X的结构简式为______________________。
(4)分子式为C8H16,碳的骨架与异辛烷相同的有机物的结构简式为_________________________________________________。
[解析] (1)结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互为同系物。(2)1 ml异辛烷和1 ml正庚烷相差1 ml“CH2”,1 ml“CH2”完全燃烧需要1.5 ml氧气,所以二者完全燃烧时消耗氧气的物质的量相差1.5 ml。
[答案] (1) 互为同系物
(2)2C8H18+25O2eq \(――→,\s\up10(点燃))16CO2+18H2O 1.5
(3)
(4) 或
探 究 任 务
1.归纳总结常见烃的结构与性质。
2.掌握烃燃烧的有关定量计算。
常见烃的结构与性质
甲烷
乙烯
乙炔
结构特点
碳原子的化合价已达“饱和”,正四面体形分子
(双键)碳原子的化合价未达“饱和”,平面形分子
—C≡C—(三键)碳原子的化合价未达“饱和”,直线形分子
含碳质量分数
eq \f(12,16)×100%=75%
eq \f(24,28)×100%≈85.7%
eq \f(24,26)×100% ≈92.3%
稳定性
稳定
活泼
活泼
取代反应
卤代
一定条件下能发生取代反应
—
加成反应
不能发生加成反应
能与H2、X2、HX、H2O等发生加成反应
能与H2、X2、HX、H2O等发生加成反应
氧化反应
燃烧时火焰明亮并呈淡蓝色
燃烧时火焰明亮且伴有黑烟
燃烧时火焰明亮且伴有浓烈的黑烟
不能使酸性KMnO4溶液褪色
能使酸性KMnO4溶液褪色
能使酸性KMnO4溶液褪色
鉴别
溴水不褪色或酸性KMnO4溶液不褪色
溴水褪色或酸性KMnO4溶液褪色
溴水褪色或酸性KMnO4溶液褪色
烃燃烧的有关计算
高考化学 考点49 常见烃的结构与性质学案(含解析): 这是一份高考化学 考点49 常见烃的结构与性质学案(含解析),共6页。学案主要包含了甲烷的结构和性质,烷烃的结构和性质,乙烯的结构与性质,苯的结构与性质等内容,欢迎下载使用。
化学选择性必修3第一单元 脂肪烃的性质及应用导学案: 这是一份化学选择性必修3第一单元 脂肪烃的性质及应用导学案,共13页。学案主要包含了特别提醒等内容,欢迎下载使用。
高中化学第3节 烃学案设计: 这是一份高中化学第3节 烃学案设计,共12页。学案主要包含了必备知识·素养奠基,关键能力·素养形成,易错提醒,思考·讨论,思维建模,母题追问,规律方法,迁移·应用等内容,欢迎下载使用。













