




所属成套资源:2022版高考化学选考山东专用一轮总复习课件(共38份)
2022版高考化学选考山东专用一轮总复习课件:专题十四盐类水解和沉淀溶解平衡 —应用篇
展开
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十四盐类水解和沉淀溶解平衡 —应用篇,共26页。
溶液中离子浓度大小的比较及其定量关系1.电解质溶液中的离子之间存在着3种定量关系(1)微粒数守恒关系(即物料守恒)如纯碱溶液中c(Na+)=2c(C )变化前=2c(C )+2c(HC )+2c(H2CO3)。NaH2PO4溶液中c(Na+)=c(H2P )变化前=c(H2P )+c(HP )+c(P )+c(H3PO4)。(2)电荷数守恒关系(即电荷守恒)如小苏打溶液中c(Na+)+c(H+)=c(HC )+2c(C )+c(OH-)。Na2HPO4溶液中c(Na+)+c(H+)=c(H2P )+2c(HP )+3c(P )+c(OH-)。
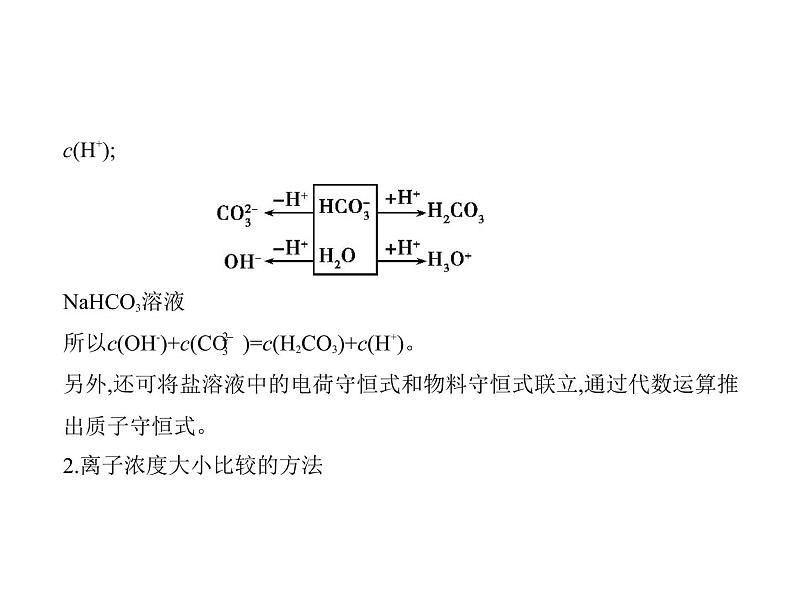
注意 1 ml C 带有2 ml 负电荷,所以电荷浓度应等于2c(C ),同理P 的电荷浓度等于3c(P )。 (3)水电离的离子数守恒关系(即质子守恒)如纯碱溶液中c(H+)水=c(OH-)水,c(H+)水=c(HC )+2c(H2CO3)+c(H+),所以c(OH-)水=c(HC )+2c(H2CO3)+c(H+)。现以Na2CO3和NaHCO3溶液为例,用以下图示帮助我们来理解质子守恒: 所以c(OH-)=c(HC )+2c(H2CO3)+c(H3O+),即c(OH-)=c(HC )+2c(H2CO3)+
c(H+); NaHCO3溶液所以c(OH-)+c(C )=c(H2CO3)+c(H+)。另外,还可将盐溶液中的电荷守恒式和物料守恒式联立,通过代数运算推
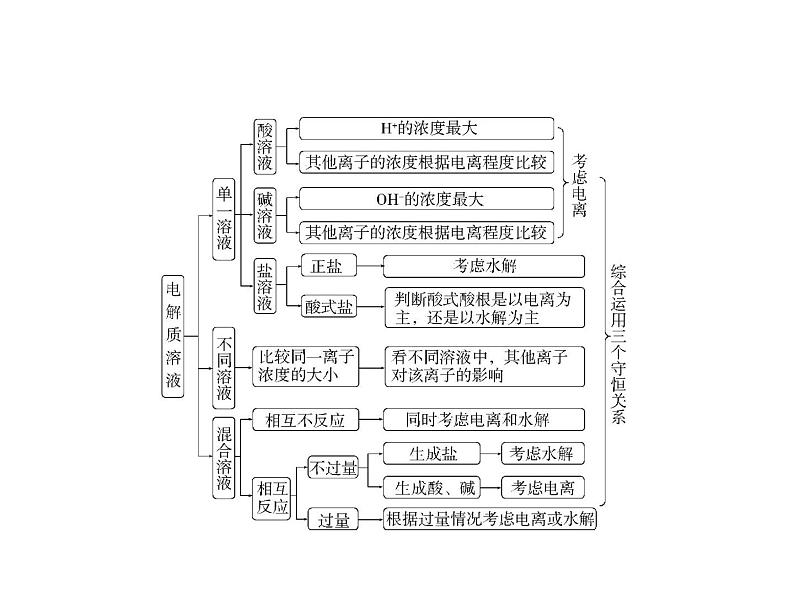
出质子守恒式。2.离子浓度大小比较的方法
点拨 ①弱电解质的电离是微弱的,②弱酸酸根离子或弱碱阳离子的水
解是微弱的。
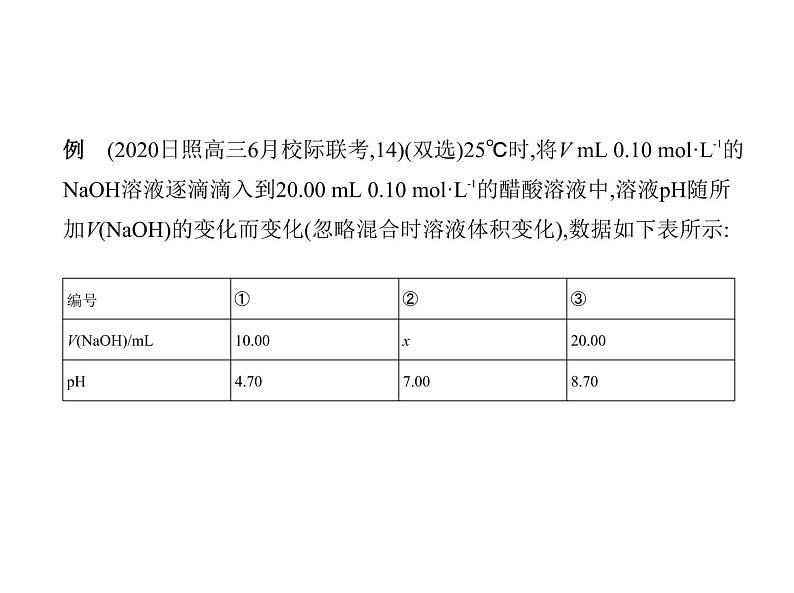
例 (2020日照高三6月校际联考,14)(双选)25℃时,将V mL 0.10 ml·L-1的
NaOH溶液逐滴滴入到20.00 mL 0.10 ml·L-1的醋酸溶液中,溶液pH随所
加V(NaOH)的变化而变化(忽略混合时溶液体积变化),数据如下表所示:
下列说法正确的是 ( )A.①中存在c(CH3COO-)>c(Na+)=0.05 ml·L-1B.②中存在c(CH3COOH)c(CH3COOH),但c(Na+)= ≈0.03 ml·L-1,A错误;②溶液pH=7,c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=c(CH3
COO-)+c(OH-),则c(Na+)=c(CH3COO-),此时c(Na+)>c(CH3COOH),且c(Na+)=
= ml·L-1,B正确;③中溶液存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH),
两者联立得c(H+)+c(CH3COO-)=c(OH-),所以③中c(Na+)+c(H+)-c(OH-)+c
(CH3COOH)=c(Na+)= =0.05 ml·L-1,C正确;①中溶液pH=
4.7,则Ka= ≈c(H+)=10-4.7,即醋酸电离平衡常数的数量级是10-5,D错误;故选BC。
题目价值 通过该题让学生对恰好完全反应与反应至溶液呈中性,以及
混合溶液中溶质的电离与水解程度大小比较等有了更深刻的理解,考查
了变化观念与平衡思想的学科核心素养。
溶液中有关离子平衡的图像水溶液中的离子平衡是高考中的热点,涉及电离平衡、水解平衡、沉淀
溶解平衡等考点,考题多以能力立意,常以图像形式命题,综合度与难度相
对比较大,思维能力要求也较高,一般会侧重考查图像分析、信息处理、
理解问题的能力,体现了变化观念与平衡思想的学科核心素养。
一、解题技巧1.识图像①分析坐标轴数据的含义。要明确坐标轴的意义(有时是双纵坐标),进而
理解整个图像的含义。②把握曲线变化的趋势。曲线变化的趋势代表了某一类物质的某一参
数在坐标系中的变化情况,通过分析曲线的变化趋势判断参数的变化原
因,分析某成分改变的影响因素。③关注特殊点。起点,定量或定性判断酸、碱的相对强弱;反应一半、中
性、恰好反应,这些点主要是确定在不同阶段各反应物与生成物的量的
关系,进而分析溶液中各粒子浓度关系;交点,某条件下的两个值是相等
的,交点的分析往往是解决问题的关键点。
2.想原理根据题中、图中信息,并与相关数据结合起来,有效地做到数形结合,这里
往往会用到电离平衡常数、KW、水解平衡常数等来进行数据分析,并运
用溶液中的电荷守恒、物料守恒和质子守恒分析出溶液中各离子的浓
度关系。3.巧整合在识图像、想原理的基础上,将图像与原理结合起来思考,找准切入点。
二、熟练掌握几种高考中热点图像的解题策略1.对数图像(1)先确定图像的类型是对数图像还是负对数图像。(2)再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数。(3)抓住图像中的特殊点,如pH=7、lgx=0、交点等。(4)理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所
表示的意义。(5)将图像中数据或曲线的变化与所学知识对接,作出正误判断。
例1 (2020聊城一模,14)
25 ℃时,在20 mL 0.1 ml·L-1一元弱酸HA溶液中滴加0.1 ml·L-1NaOH溶
液,溶液中lg 与pH关系如图所示。下列说法正确的是 ( )A.25 ℃时,HA的电离常数为1.0×10-5.3B.A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
C.B点对应的NaOH溶液体积为10 mLD.对C点溶液加热(不考虑挥发),则 一定减小
解析 由图可知,pH=5.3时,lg =0,即c(A-)=c(HA),HA的电离常数Ka= =c(H+)=10-5.3,A正确;A点对应溶液显酸性,即c(H+)>c(OH-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),所以c(A-)>c(Na+),盐电离产生
的离子浓度大于弱电解质电离产生的离子浓度,所以溶液中离子浓度关
系为c(A-)>c(Na+)>c(H+)>c(OH-),B错误;加入10 mL NaOH溶液时,得到等
浓度的HA和NaA混合溶液,由于Ka=10-5.3> = =Kh,所以混合溶液以电离为主,c(A-)>c(HA),即lg >0,故B点对应的加入NaOH溶液的体积小于10 mL,C错误;A-的水解常数Kh随温度升高而增大,所以 =
随温度升高而减小,D正确;故选AD。
2.弱电解质“分布系数” 图像(1)总体读图,通过观察弄清坐标的含义及单位,弄清各微粒浓度变化。(2)识图,分析特殊点的图像含义,如曲线的起点、终点、交点、极值点、
转折点等,分析曲线的变化趋势如斜率的大小及升降等。(3)分析,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在
统摄信息的基础上进行逻辑推理或运用数据计算分析。
例2 (2020滨州二模,15)
柠檬酸(用H3R表示)是一种高效除垢剂。常温时,用一定浓度的柠檬酸溶
液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物质的量百分数随pH的变化
如图所示。下列说法正确的是 ( )A.由a点判断H3R的第一步电离常数 (H3R)的数量级为10-3
B.若b点溶液中金属阳离子只有Na+,则有c(Na+)=c(R3-)+c(HR2-)+c(H2R-)+c
(H3R)C.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)D.反应2H2R- H3R+HR2-在该温度下的平衡常数K=10x-y
解析 由题图可知,在a点时,c(H2R-)=c(H3R),第一步电离常数 (H3R)= =c(H+)=10-x,3c(H+),故c(R3-)=c(HR2-)>c(H+)>c(OH-),C正确。H3R
H2R-+H+的电离平衡常数 (H3R)= =c(H+)=10-x,H2R- HR2-+H+的电离平衡常数 (H3R)= =c(H+)=10-y,反应2H2
R- H3R+HR2-在该温度下的平衡常数K= = =10x-y,D正确。故选CD。
3.沉淀溶解平衡曲线图像(1)明确图像中纵、横坐标的含义。纵、横坐标通常是难溶物溶解后电
离出的离子浓度,或离子浓度的对数等。(2)理解图像中线上点、线外点的含义。曲线上任意一点都达到了沉淀
溶解平衡状态,此时Qc=Ksp。(3)根据Ksp的特点,结合选项分析判断。
点拨 溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同
一曲线上的点,溶度积常数相同。
例3 (2020邹城一中五模,12)
某温度时硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所
示。已知p(M)=-lgc(M),p(S )=-lgc(S )。下列说法正确的是 ( )A.向BaSO4悬浊液中加入浓度较大的Pb(NO3)2溶液可能转化成PbSO4
B.X、Y两点对应的SrSO4均是饱和溶液,不能继续溶解SrSO4C.蒸发Z点的BaSO4溶液可得到C点状态的BaSO4溶液D.溶度积:Ksp(SrSO4)
相关课件
这是一份山东专用高考化学一轮复习专题十四盐类水解和沉淀溶解平衡_基础篇课件,共21页。PPT课件主要包含了考点清单,知能拓展等内容,欢迎下载使用。
这是一份高考化学总复习专题十二盐类的水解和沉淀溶解平衡完美课件PPT,共60页。PPT课件主要包含了考点42,考点43,考点44,考点45,试做真题,高手必备,萃取高招,对点精练,盐类水解的应用,答案B等内容,欢迎下载使用。
这是一份2022版高考化学选考山东专用一轮总复习课件:专题十五有机物的分类、组成和结构 —应用篇,共11页。









