






鲁教版 (五四制)九年级全册第四单元 金属2 金属的化学性质课文内容ppt课件
展开铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,铝具有很好的抗腐蚀性能。
铝的化学性质很活泼(活泼性仅次于镁),为什么通常铝制品却很耐腐蚀?日常生活中,常见到铁生锈,而见不到铝生锈呢?
说明金即使在高温时,也不与氧气反应。
在高温的条件,紫红色的铜与氧气反应,生成黑色的氧化铜。
金属与氧气的反应:1.常温能反应: 镁、铝 2.高温下能反应:铁、铜 3.高温下也不能反应:金
金属活动性: 镁、铝 >铁、铜>金
通过金属与氧气反应的条件,可以判断金属的活动性。
提出问题: 金属与酸反应现象是否也像金属与氧气反应一样存在差别呢?
1.分别取镁、锌、铁、铜于试管中,加入稀盐酸,对比观察反应现象。 2.取镁、锌、铁、铜于试管中,加入稀硫酸反应,对比观察反应现象。
根据实验现象,请你推测这四种金属的活动性?
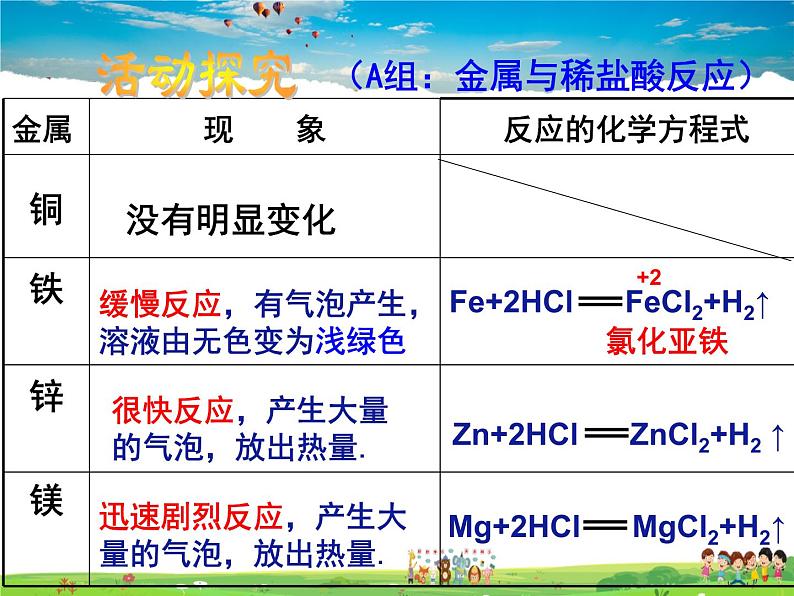
(A组:金属与稀盐酸反应)
缓慢反应,有气泡产生,溶液由无色变为浅绿色
很快反应,产生大量的气泡,放出热量.
迅速剧烈反应,产生大量的气泡,放出热量.
(B组:金属与硫酸反应)
很快反应,产生大量的气泡,放出热量
迅速剧烈反应,产生大量的气泡,放出热量
谁强谁弱你看清楚了吗?
1.能与盐酸,稀硫酸反应的金属是 2.不能与盐酸,稀硫酸反应的金属是 3.镁、锌、铁、铜四种金属的活动性顺序 是 > > > 。
Mg Zn Fe
Mg Zn Fe Cu
金属与酸的反应:1.能反应: 镁、锌、铁 不能反应:铜2.反应的剧烈程度:镁>锌>铁
结论:1.根据是否反应:镁、锌、铁均比铜活泼。2.根据反应的激烈程度:镁>锌>铁
Mg + 2HCl MgCl2 + H2↑Zn + 2HCl ZnCl2 + H2↑Fe + 2HCl FeCl2 + H2↑
思考:从反应物和生成物的物质类别的角度分析,这些反应有什么特点?这一类反应与化合反应,分解反应有何区别。
这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。 (基本反应类型)
以上两个反应属于置换反应吗?为什么?
验证质量守恒定律时:把铁钉放入硫酸铜溶液中
现象:铁钉的表面覆盖一层红色物质, 溶液由蓝色变成浅绿色。
信息资料:根据上面的反应能发生,可以判定铁的活动性比铜的活泼性强。
还有其它证明金属的活动性强弱的方法吗?
一、金属与氧气的反应:1、常温能反应: 以镁、铝为代表。2、高温下能反应:以铁、铜为代表。3、高温下也不能反应:以金为代表。
结论:镁、铝较活泼,铁、铜次之,金最不活泼
二、金属与酸的反应:1.能反应: 以镁、锌、铁为代表。 不能反应:以铜为代表。2.反应的剧烈程度:镁>锌>铁
1.用一根砂纸打磨过的铝丝和铁丝分别浸入硫酸铜溶液中 2.用一根洁净的铜丝浸入硝酸银溶液中 3.用一根洁净的铜丝浸入硫酸铝溶液中
Cu +2AgNO3 = Cu(NO3)2 + 2Ag
铜丝表面有一层银白色物质
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
铝丝表面有一层红色物质
归纳Al、Cu、Ag三种金属活动性:Al>Cu>Ag
Al、Cu、Ag的活泼性比较
经过人们长期的实验,归纳总结得出了常见金属在溶液中的活动性顺序:
Mg Al Zn Fe Sn Pb
Cu Hg Ag Pt Au
常见金属在溶液中的活动性顺序:
K、Ca、Na、Mg、Al、Zn、Fe、Sn(锡)、Pb(铅)、( H )、Cu、Hg、Ag、Pt(铂)、Au(金)
巧记方法: 名叫贾盖的那个美女, 新贴个喜字迁往新居成亲, 带去了童工和银、铂、金。
金属活动顺序性的应用
1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2.在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3.在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。(前换后;强换弱)
初中鲁教版 (五四制)2 金属的化学性质评课课件ppt: 这是一份初中鲁教版 (五四制)2 金属的化学性质评课课件ppt,共34页。PPT课件主要包含了金器文物,银器文物,铁器文物,金属的化学性质,金属与氧气的反应,镁和铁燃烧的现象,你还记得吗,活动与探究一,我会总结,H2+ZnCl2等内容,欢迎下载使用。
初中化学鲁教版 (五四制)九年级全册2 金属的化学性质教课课件ppt: 这是一份初中化学鲁教版 (五四制)九年级全册2 金属的化学性质教课课件ppt
2021学年第四单元 金属2 金属的化学性质示范课ppt课件: 这是一份2021学年第四单元 金属2 金属的化学性质示范课ppt课件,共53页。PPT课件主要包含了真相只有一个,测密度,测硬度,元素守恒,金属+酸,盐+氢气,酸会腐蚀金属,制氢气,合理利用,趋利避害等内容,欢迎下载使用。













