







所属成套资源:【新教材】人教版高中化学选择性必修一课件+学案+练习【成套】
2021学年第三节 盐类的水解优质ppt课件
展开
这是一份2021学年第三节 盐类的水解优质ppt课件,文件包含332影响盐类水解的主要因素盐类水解的应用课件-新教材人教版2019高中化学选择性必修一pptx、332影响盐类水解的主要因素盐类水解的应用学案-新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共42页, 欢迎下载使用。
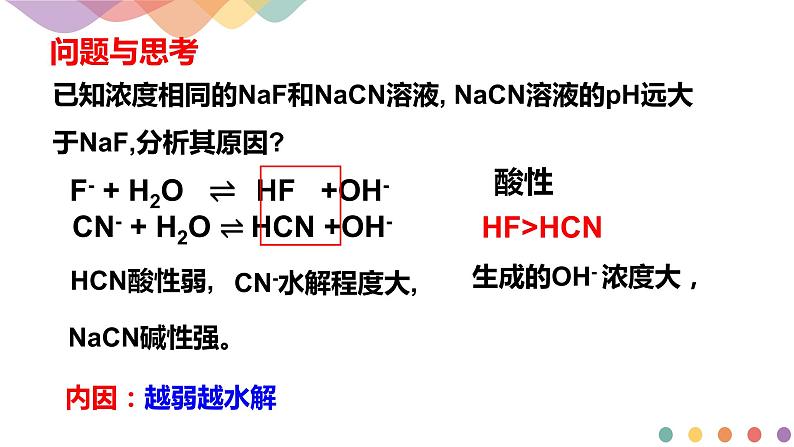
谁弱谁水解 谁强显谁性 越弱越水解 无弱不水解 都弱双水解
F- + H2O ⇌ HF +OH-
CN- + H2O ⇌ HCN +OH-
已知浓度相同的NaF和NaCN溶液, NaCN溶液的pH远大于NaF,分析其原因?
生成的OH- 浓度大,
盐水解生成的弱酸或弱碱越弱,水解程度就越大,溶液相应的碱性或酸性就越强
NH4Cl < AlCl3
②比较等浓度 NH4Cl溶液与AlCl3溶液的酸性:
①已知酸性:CH3COOH>H2CO3>HClO>HCO3-,比较等浓度CH3COONa,Na2CO3,NaHCO3,NaClO碱性
Na2CO3 > NaClO > NaHCO3> CH3COONa
1.内因(决定因素):反应物的性质(越弱越水解)
同物质的量浓度NaX、NaY、NaZ三种正盐溶液,测得溶液的pH分别是7、9、10,则相对应的酸:HX、HY、HZ的酸性比较。
2. 外因(外界条件): 盐类的水解程度受到盐的浓度、温度及溶液酸碱度的影响 --符合勒夏特列原理
水解是中和反应的逆反应,
是吸热反应(△H>0)。
升高温度,盐类水解平衡向正反应方向移动,有利于盐类的水解。--越热越水解
a. 加水(减小浓度):
b. 加溶质(增大浓度):
③外加酸、碱 对强碱弱酸盐,加酸促进水解,加碱抑制水解。 对强酸弱碱盐,加酸抑制水解,加碱促进水解。
即:酸可抑制阳离子水解,促进阴离子水解;碱可抑制阴离子水解,促进阳离子水解。
④盐水解情况相同的离子的水解相互抑制,水解情况相反的离子的水解相互促进(双水解)
在0.01ml/LFeCl3溶液中:
Fe3++3H2O⇌Fe(OH)3 + 3H+
比较下列溶液的pH大小(填“>”“c(HCO3-)>c(CO32-)>c(H+)>c(OH-)(B)c(Na+)+c(H+)=c(OH-)+c(CO32-) +c(HCO3-)(C)c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)(D)c(Na+)=c(HCO3-)+c(H2CO3)+c(OH-)(E)c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
在0.2ml/L的NH4Cl溶液中,下列关系式正确的是( )A.c(Cl-)> c( NH4+ ) >c( H+ ) >c( OH- )B.c( NH4+ ) > c(Cl- ) >c( H+ ) >c( OH- )C. c(Cl- ) =c( NH4+ ) >c(H+ ) =c( OH- ) D.c( NH4+ ) =c(Cl- ) >c( H+ ) >c( OH- )
将10mL0.1ml/L氨水和10mL0.1ml/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )A.C(Cl-)+C(OH-)=C(NH4+)+C(H+) B. C(Cl-)> C(NH4+)> C(H+) > C(OH-)C.C (H+) > C(OH-)>C (Cl-)>C(NH4+) D.C(Cl-)> C(H+) >C (NH4+)>C (OH-)
下列根据反应原理设计的应用,不正确的是( )A.CO32-+H2O⇌HCO3-+OH-热的纯碱溶液清洗油污B.Al3++3H2O ⇌ Al(OH)3+3H+明矾净水C.TiCl4+(x+2)H2O(过量) ⇌ TiO2·xH2O+4HCl用TiCl4制 备TiO2D.SnCl2+H2O ⇌ Sn(OH)Cl+HCl配制氯化亚锡溶液 时加入氢氧化钠
1、决定因素(内因):
2、外界条件(外因):
(1)浓度:(2)温度:(3)外加酸、碱: 加酸抑制强酸弱碱盐的水解、促进强碱弱酸盐的水解 ; 加碱抑制强碱弱酸盐的水解、促进强酸弱碱盐的水解。
-- 浓度、温度及溶液酸碱度
相关课件
这是一份化学选择性必修1第三节 盐类的水解背景图课件ppt,共19页。
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用精品课件ppt,共35页。PPT课件主要包含了盐类的水解,知识回顾,HCHBHA,盐类水解的特点,CH3COOH,水解平衡常数,盐类水解的应用等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1实验活动3 盐类水解的应用优秀课件ppt,文件包含332影响盐类水解的主要因素盐类水解的应用练习解析版docx、332影响盐类水解的主要因素盐类水解的应用练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。










