






苏教版 (2019)必修 第二册专题6 化学反应与能量变化本单元综合与测试完整版ppt课件
展开一、化学反应速率的计算与比较1.(2019·阜阳校级期末)在2 L密闭容器中,发生以下反应:2A(g)+B(g)2C(g)+D(g)。若最初加入的A和B都是4 ml,在前10 s A的平均反应速率为0.12 ml·L-1·s-1,则10 s时,容器中B的物质的量是A.1.6 ml B.2.8 mlC.2.4 ml D.1.2 ml
解析 根据化学反应速率之比等于对应物质的化学计量数之比,可得v(B)=0.5v(A)=0.5×0.12 ml·L-1·s-1=0.06 ml·L-1·s-1,则Δc(B)=0.06 ml·L-1·s-1×10 s=0.6 ml·L-1,Δn(B)=0.6 ml·L-1×2 L=1.2 ml,故10 s时容器中B的物质的量为4 ml-1.2 ml=2.8 ml。
2.(2019·成都航天中学高一期末)在2A(g)+B(g) 3C(g)+3D(g)反应中,下列表示该反应速率最快的是A.v(B)=0.3 ml·L-1·s-1B.v(A)=0.5 ml·L-1·min-1C.v(C)=0.8 ml·L-1·s-1D.v(D)=1 ml·L-1·min-1
解析 用不同物质表示的反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快。
显然选项A中比值最大,反应速率最快。
解析 5 min内W的平均化学反应速率v(W)= =0.02 ml·L-1·min-1,利用各物质的反应速率之比等于其化学计量数之比,以Z浓度变化表示的平均反应速率为0.01 ml·L-1·min-1,则v(Z)∶v(W)=0.01 ml·L-1·min-1∶0.02 ml·L-1·min-1=n∶2,所以n=1,选项A正确。
3.把0.6 ml X气体和0.6 ml Y气体混合于2 L的密闭容器中,使它们发生如下反应:3X(g)+Y(g) nZ(g)+2W(g)。5 min末生成0.2 ml W。若测知以Z的浓度变化表示平均反应速率为0.01 ml·L-1·min-1,则化学方程式中n的值为A.1 B.2 C.3 D.4
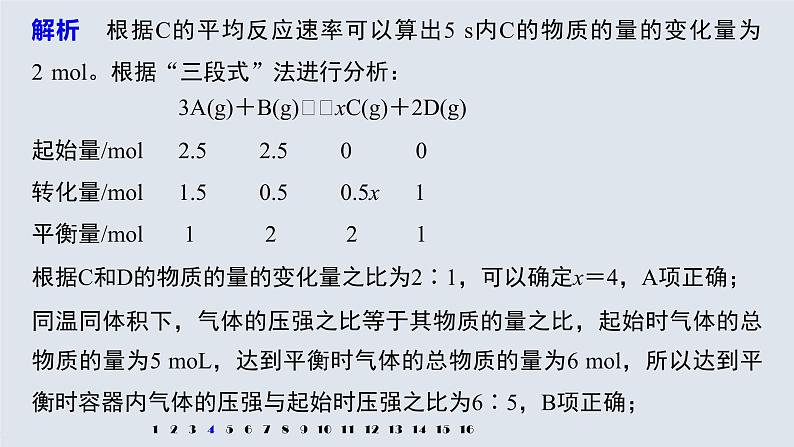
4.(2019·江西吉安期末)把2.5 ml A和 2.5 ml B混合放入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经 5 s反应达平衡,在此5 s内C的平均反应速率为0.2 ml·L-1·s-1,同时生成1 ml D,下列叙述中错误的是A.x=4B.达到平衡状态时容器内气体的压强与起始时压强之比为6∶5C.5 s内B的平均反应速率v(B)=0.05 ml·L-1·s-1D.达到平衡状态时A的转化率为50%
根据C和D的物质的量的变化量之比为2∶1,可以确定x=4,A项正确;同温同体积下,气体的压强之比等于其物质的量之比,起始时气体的总物质的量为5 mL,达到平衡时气体的总物质的量为6 ml,所以达到平衡时容器内气体的压强与起始时压强之比为6∶5,B项正确;
解析 根据C的平均反应速率可以算出5 s内C的物质的量的变化量为2 ml。根据“三段式”法进行分析:
起始量/ml 2.5 2.5 0 0转化量/ml 1.5 0.5 0.5x 1平衡量/ml 1 2 2 1
5 s内物质B消耗了0.5 ml,用B表示的化学反应速率为 =0.05 ml·L-1·s-1,C项正确;达到平衡时A的转化率为 ×100%=60%,D项错误。
解析 将食物贮藏在冰箱里,温度降低,反应速率减慢,B正确;在H2O2分解反应中MnO2起到催化剂作用,加入二氧化锰,反应速率加快,C错误;用锌粉替代锌粒,固体与酸接触面积增大,反应速率加快,D错误。
二、化学反应速率的影响因素及实验探究5.(2019·河北滦州一中高一下期中)下列措施能减慢化学反应速率的是A.用Zn和2 ml·L-1 H2SO4溶液反应制取H2时,放在热水浴中反应B.日常生活中,将食物贮藏在冰箱中C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末D.用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气
6.(2019·江苏海安中学高一月考)下列各组物质进行反应(表内物质均为反应物),反应刚开始时,放出H2的速率最快的是
解析 硝酸和锌反应不生成氢气,排除A选项。锌的活动性比铁强,所以在外界条件相同的情况下,锌与酸的反应速率比铁快,因此生成H2的速率:C>B。在相同的条件下,氢离子的浓度越大,化学反应速率越快,因此生成H2的速率:C>D,故选C。
7.反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是①增加铁的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持体积不变,充入水蒸气使体系压强增大A.①④ B.②③ C.③④ D.②④
解析 对于反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)来说,增大压强、增大浓度、升高温度以及增大固体的表面积,都可增大反应速率。①Fe为固体,增加铁的量,反应速率不变,故错误;②将容器的体积缩小一半,气体浓度增大,反应速率增大,故正确;③保持体积不变,充入N2使体系压强增大,各组分的浓度不变,反应速率不变,故错误;④保持体积不变,充入水蒸气使体系压强增大,反应物浓度增大,反应速率增大,故正确;故选D。
8.某探究小组利用丙酮的溴代反应(CH3COCH3+Br2―→CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
分析实验数据所得出的结论不正确的是A.增大c(CH3COCH3),v(Br2)增大B.实验②和③的v(Br2)相等C.增大c(HCl),v(Br2)增大D.增大c(Br2),v(Br2)增大
解析 影响化学反应速率的因素有浓度、温度、压强以及催化剂等因素,一般情况下在其他条件相同时,反应物的浓度越大,反应速率越快,本题中溴作为反应物,其浓度越大,物质的量越多,其颜色消失的时间会越长,另外可从表中数据判断出,实验①④中CH3COCH3、HCl的浓度是相同的,而④中Br2比①中的大,所以时间变长,速率变慢,故D错误;对比①②组数据,可以判断出增大c(CH3COCH3),v(Br2)增大,故A正确;比较实验②和③数据,Br2的浓度相等,溴颜色消失所需的时间也相等,溴的反应速率是相等的,故B正确;比较①③数据可以判断出,增大c(HCl),v(Br2)增大,故C正确。
9.(2019·北京西城区高一期末)将浓度均为0.01 ml·L-1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为H2O2+反应分两步进行,反应A为H2O2+2I-+2H+===I2+2H2O,反应B为……(1)反应B的离子方程式是________________________。对于总反应,I-的作用相当于_______。
(2)为证明反应A、B的存在,进行实验Ⅰ。a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。试剂X是_____________。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 ml·L-1)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。①实验Ⅲ中,x、y、z所对应的数值分别是________。
解析 为便于研究,在反应中要采用控制变量的方法,即只改变一个反应条件,其他条件都相同,根据表格数据可知,实验Ⅲ与实验Ⅱ相比硫酸溶液的体积减小,为保证其他条件都相同,而且混合后总体积相同,实验Ⅲ中,x=8,y=3,z=2。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______________________________________________。
其他条件不变,增大氢离子浓度可以加快反应速率
解析 对比实验Ⅱ、实验Ⅲ,可得出的实验结论是在其他条件不变时,溶液中氢离子浓度越大,反应速率越快。
系,解释实验Ⅳ未产生颜色变化的原因:______________________________________________________________。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。(溶液浓度均为0.01 ml·L-1)
实验过程中,溶液始终无明显颜色变化。试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关
v(A)
三、化学平衡状态的建立及判定10.(2019·南京校级月考)在373 K时,密闭容器中充入一定物质的量的NO2和SO2,发生如下反应:NO2+SO2 NO+SO3,达到平衡时,下列叙述正确的是A.SO2、NO2、NO、SO3的物质的量一定相等B.NO2和SO2的物质的量一定相等C.平衡体系中总物质的量一定等于反应开始时总物质的量D.NO和SO3的物质的量一定不相等
解析 平衡状态时SO2、NO2、NO、SO3的物质的量不变,但不一定相等,故A错误;平衡时NO2和SO2的物质的量不变,不一定相等,与起始投料量有关,故B错误;方程式两边气体的化学计量数相等,所以体系中的总物质的量一定等于反应开始时总物质的量,故C正确;因为反应从反应物投料建立,所以只要反应发生就有NO和SO3的物质的量相等,所以平衡时也相等,故D错误。
11.(2019·江苏宿迁中学高一期末)一定温度下,将2 ml SO2和1 ml O2充入2 L密闭容器中,在催化剂存在下进行下列反应:2SO2+O2 2SO3,下列说法中正确的是A.达到反应限度时,生成2 ml SO3B.达到反应限度时,SO2的消耗速率必定等于O2的生成速率C.达到反应限度时,SO2、O2、SO3的分子数之比一定为2∶1∶2D.SO2和SO3的物质的量之和一定为2 ml
解析 该反应为可逆反应,2 ml SO2和1 ml O2反应达到反应限度时,生成的SO3的物质的量小于2 ml,A错误;达到反应限度时,SO2的消耗速率必定等于O2的生成速率的2倍,B错误;平衡时各物质分子数的关系与起始量、转化率有关,则不能确定达到反应限度时SO2、O2、SO3的分子数之比,C错误;起始加入2 ml SO2,化学反应中S原子守恒,则最终SO2和SO3的物质的量之和一定为2 ml,D正确。
12.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变 ④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变 ⑥容器内A、C、D三种气体的浓度之比为2∶1∶1 ⑦某时刻v(A)=2v(C)且不等于零 ⑧单位时间内生成n ml D,同时生成2n ml AA.4个 B.5个 C.6个 D.7个
解析 ①该容器为绝热容器,容器内温度不变说明正、逆反应速率相等,反应达到平衡状态;②由于B呈固态,根据质量守恒定律,建立平衡过程中气体的总质量增大,恒容容器中混合气体的密度增大,达到平衡时混合气体总质量不变,混合气体的密度不变,混合气体的密度不变能说明反应达到平衡状态;③该反应前后气体分子数不变,建立平衡过程中混合气体分子总物质的量始终不变,由于是绝热容器,建立平衡过程中容器温度变化,混合气体压强发生变化,达到平衡时温度不变,混合气体压强不变,混合气体的压强不变能说明反应达到平衡状态;
④由于B呈固态,根据质量守恒定律,建立平衡过程中气体的总质量增大,混合气体分子总物质的量始终不变,混合气体的平均相对分子质量增大,达到平衡时混合气体总质量不变,混合气体的平均相对分子质量不变,混合气体的平均相对分子质量不变能说明反应达到平衡状态;⑤C(g)的物质的量浓度不变是化学平衡的特征标志,说明反应达到平衡状态;⑥达到平衡时A、C、D的浓度保持不变,但不一定等于2∶1∶1,A、C、D三种气体的浓度之比为2∶1∶1时反应不一定达到平衡状态;
⑦某时刻v(A)=2v(C)且不等于零,没有指明是正反应速率,还是逆反应速率,不能说明反应达到平衡状态;⑧单位时间内生成n ml D一定消耗2n ml A,同时生成2n ml A,A的浓度不变能说明反应达到平衡状态;则能说明反应达到平衡状态的有①②③④⑤⑧,共6个,答案选C。
四、化学反应速率与化学平衡图像13.(2019·盐城期末)在2.0 L恒温恒容密闭容器中充入1.0 ml HCl和0.3 ml O2,加入催化剂发生反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是A.t2时,v正=v逆B.加入催化剂反应速率不变C.t1时,容器内气体的总压强比t2时的大D.t3时,容器中c(Cl2)=c(H2O)=0.4 ml·L-1
解析 t2时,反应物的量还在减少,反应还在向正方向进行,v(正)>v(逆),选项A错误;加入催化剂可改变化学反应速率,选项B错误;反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)是气体体积减小的反应,随着反应的进行,气体的总物质的量减小,恒容容器内压强减小,故t1时容器内气体的总压强比t2时的大,选项C正确;t3时,O2的物质的量为0.1 ml,减少了0.2 ml,故生成Cl2、H2O的物质的量均为0.4 ml,容器中c(Cl2)=c(H2O)=0.2 ml·L-1,选项D错误。
14.(2020·秦皇岛一中高一期中)一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照条件下的催化降解率的影响如图所示,其降解产物为无污染物质。下列判断错误的是A.温度越高,Cu2+、Mn2+、Fe3+的催化降 解率越大B.离子浓度相同时,Cu2+的催化效果最好C.Fe3+的浓度对乙酸降解率的影响不大D.乙酸的降解产物可能是CO2和H2O
解析 Cu2+、Mn2+、Fe3+均可作乙酸降解的催化剂,要使催化剂达到最佳催化效果,需在一定温度下进行,并不是温度越高越好,A项错误;根据图示可知,相同浓度下,a线(Cu2+)表示的降解率最大,B项正确;根据图示可知,Fe3+的浓度增加,乙酸的降解率变化不是很大,所以Fe3+的浓度对乙酸降解率的影响不大,C项正确;乙酸的降解产物为无污染物质,其产物可能为CO2、H2O,D项正确。
15.(2019·北京西城区高一期末)汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为2种无毒气体。T ℃时,将0.8 ml NO和0.8 ml CO充入容积为2 L的密闭容器中,模拟尾气转化,容器中NO的物质的量随时间的变化如图所示。(1)NO、CO转化为2种无毒气体的化学方程式是___________________________。
解析 NO、CO反应产生N2、CO2,根据图像可知,反应一段时间后,n(NO)不再变化,且不为0,则说明该反应为可逆反应,再根据原子守恒、得失电子守恒,可得反应方程式为2CO+2NO N2+2CO2。
(2)反应开始至10 min,v(NO)=_____ ml·L-1·min-1。
解析 催化剂可以加快反应速率,所以使用新型催化剂可以加快NO、CO的转化,a正确;根据图像可知,该反应进行到10 min后,NO的物质的量不再发生变化,说明反应达到化学平衡状态,b正确;平衡时,CO的物质的量是0.4 ml,由于容器的容积为2 L,所以CO的浓度是0.2 ml·L-1,c错误。
(3)下列说法正确的是___(填字母)。a.新型催化剂可以加快NO、CO的转化b.该反应进行到10 min时达到化学平衡状态c.平衡时CO的浓度是0.4 ml·L
16.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:[实验原理]2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O[实验内容及记录]
请回答下列问题:(1)根据上表中的实验数据,可以得到的结论是________________________________________________________________。
其他条件相同时,增大KMnO4溶液浓度(或反应物浓度),反应速率增大
解析 可由图表中的数据直接得出结论:其他条件相同时,增大KMnO4溶液浓度(或反应物浓度),反应速率增大。
(2)利用实验1中数据计算,v(KMnO4)=_______________________。
1.5×10-2 ml·L-1·min-1
(3)该化学小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是__________________________________________________________。
生成物中的MnSO4为该反应的催化剂(或Mn2+
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是______________________________________________________________________。
与实验1比较,溶液褪色所需时间更短[或所用时间t小于4.0 min及其他合理答案]
解析 由图可以看出Mn2+在一定时间后生成速率增大,故可以想到生成物中的MnSO4可能为该反应的催化剂,从而提出假设;在反应时KMnO4是用H2SO4酸化的,如果用MnCl2来证明Mn2+的催化作用,就又引进了Cl-,这时就不知道是Mn2+的催化作用还是Cl-的催化作用。而用MnSO4就能避免这个问题。有了催化剂,在其他条件相同时,褪色时间就会缩短。
高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃课文课件ppt: 这是一份高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃课文课件ppt,共47页。PPT课件主要包含了加成反应,苯乙炔,5-二甲基庚烷等内容,欢迎下载使用。
苏教版 (2019)必修 第二册专题9 金属与人类文明本单元综合与测试优质课件ppt: 这是一份苏教版 (2019)必修 第二册专题9 金属与人类文明本单元综合与测试优质课件ppt,共51页。PPT课件主要包含了节约金属资源,x=336t,氧化剂,或假设b成立,HCl,FeOH2,最后变为红褐色,ADECB,玻璃棒,溶液变成血红色等内容,欢迎下载使用。
苏教版 (2019)必修 第二册专题8 有机化合物的获得与应用本单元综合与测试一等奖ppt课件: 这是一份苏教版 (2019)必修 第二册专题8 有机化合物的获得与应用本单元综合与测试一等奖ppt课件,共53页。PPT课件主要包含了乙和丙,+CH3CH2OH,+H2O,+CH3OH,C6H12O6,新制的氢氧化铜悬浊液,银氨溶液或,溶液变蓝,高级脂肪酸,提高反应的产率等内容,欢迎下载使用。













