
高中化学人教版 (新课标)选修4 化学反应原理第三节 盐类的水解第一课时教案
展开第三节 盐类的水解(第1课时)
教学目标
1.能初步根据盐的组成判断盐溶液的酸碱性。
2. 理解盐类水解的实质及盐类水解对溶液酸、碱性的
3. 掌握盐类水解的规律。
4.培养学生归纳思维能力和逻辑推理能力。
5培养学生分析问题的能力和实验技能,使学生会透过现象看本质。
教学重点 盐类水解的本质,水解的规律的理解。
教学难点 学生逻辑思维能力的进一步培养和训练
教学方法 实验探究、引导、讨论、归纳法
教具 仪器: 酚酞、pH试纸、比色卡、玻璃棒、表面皿
药品:CH3COONa、Na2CO3、NH4Cl、(NH4)2SO4、NaCl、Na2SO4、NaHCO3(均为溶液)。
教学方法 实验探究、小组合作、讨论、归纳的方法。
教学过程
[设问] 酸溶液显酸性,碱溶液显碱性,盐溶液是否都显中性呢?提起盐,大家都能想到生活中的食盐,还有苏打和小苏打,其中苏打Na2CO3明明是盐,为何又称为“碱”呢?
[演示实验] 检验碳酸钠溶液的酸碱性(向碳酸钠溶液中加酚酞)。
[引入] 碳酸钠溶液为什么显碱性呢?这节课我们就来研究这个问题。
[屏幕展示] 第三节 盐类的水解
[设问] 碳酸钠溶液显碱性,其它盐的水溶液是否也显碱性呢?
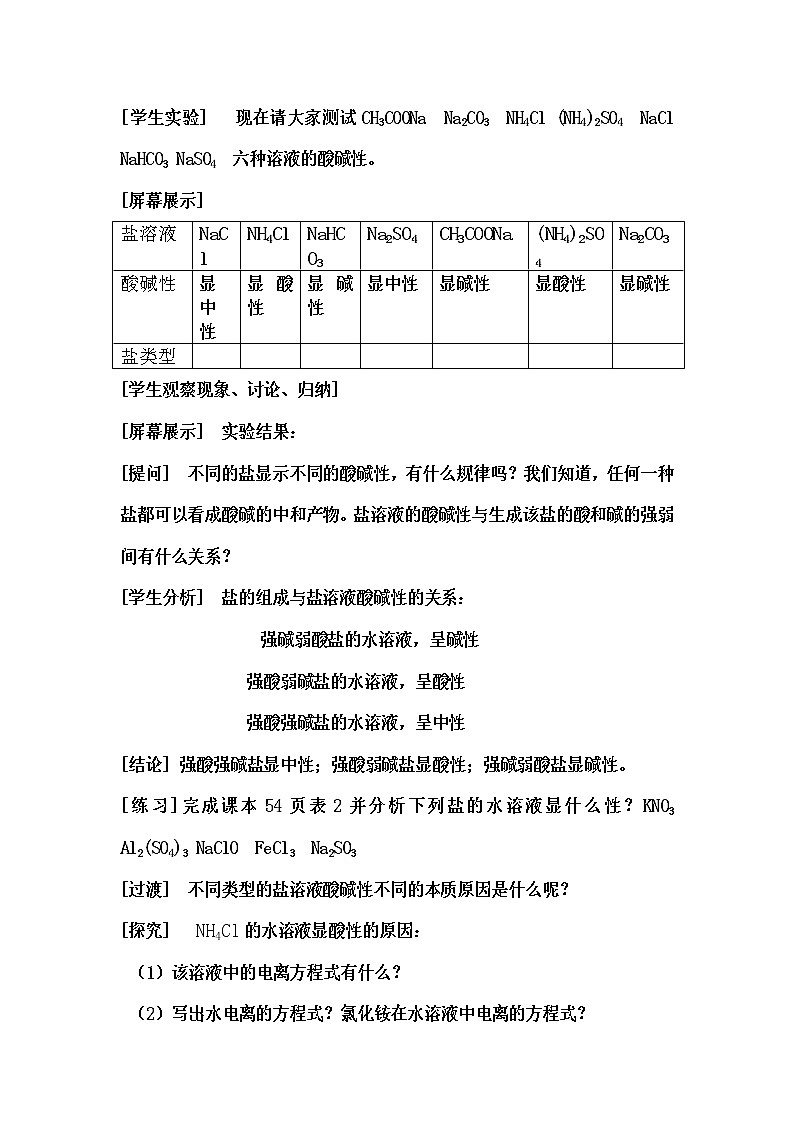
[学生实验] 现在请大家测试CH3COONa Na2CO3 NH4Cl (NH4)2SO4 NaCl NaHCO3 NaSO4 六种溶液的酸碱性。
[屏幕展示]
盐溶液 | NaCl | NH4Cl | NaHCO3 | Na2SO4 | CH3COONa | (NH4)2SO4 | Na2CO3 |
酸碱性 | 显中性 | 显酸性 | 显碱性 | 显中性 | 显碱性 | 显酸性 | 显碱性 |
盐类型 |
|
|
|
|
|
|
|
[学生观察现象、讨论、归纳]
[屏幕展示] 实验结果:
[提问] 不同的盐显示不同的酸碱性,有什么规律吗?我们知道,任何一种盐都可以看成酸碱的中和产物。盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系?
[学生分析] 盐的组成与盐溶液酸碱性的关系:
强碱弱酸盐的水溶液,呈碱性
强酸弱碱盐的水溶液,呈酸性
强酸强碱盐的水溶液,呈中性
[结论] 强酸强碱盐显中性;强酸弱碱盐显酸性;强碱弱酸盐显碱性。
[练习]完成课本54页表2并分析下列盐的水溶液显什么性?KNO3 Al2(SO4)3 NaClO FeCl3 Na2SO3
[过渡] 不同类型的盐溶液酸碱性不同的本质原因是什么呢?
[探究] NH4Cl的水溶液显酸性的原因:
(1)该溶液中的电离方程式有什么?
(2)写出水电离的方程式?氯化铵在水溶液中电离的方程式?
(3)氯化铵的水溶液中存在着几种离子?
(4)氯化铵对应的碱是弱碱,其电离方程式如何写?对我们有什么启示呢?
[屏幕展示]结合学生的讨论,利用电脑动画模拟NH4Cl的水解过程,生动形象地说明NH4Cl的水解原理。
[讲解] NH4Cl溶于水时,NH4Cl电离出的NH4+和水电离出的H+结合生成弱电解质NH3.H2O,消耗了溶液中的OH-,c(OH-)减小,使水的电离平衡向正向移动,c(H+)增大,达到新平衡时,c(OH-)<c(H+),从而使溶液显酸性。
[总结] 氯化铵水溶液显酸性的本质原因: NH4Cl电离的弱碱阳离子与水电离的OH-结合生成弱电解质,促进了水的电离
[练习] 试从氯化铵水溶液显酸性的原因分析:为什么Al2(SO4)3的水溶液显酸性的原因?(同学分析)
[屏幕展示] Al2(SO4)3在溶液中的变化:
[练习] 我们知道了盐溶液显酸性的原因,那么强碱弱酸盐显碱性的原因优势什么呢?请同学们分析CH3COONa溶液显碱性的本质原因。
[屏幕展示]根据学生的回答,利用电脑动画模拟CH3COONa的水解过程,
并得出其水解的本质。
[小结]它们水解的本质都是:溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的过程,这一过程称为盐类的水解。
[引出“盐类水解的定义”]
一 盐类的水解
1盐类的水解定义:在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。
2盐类水解的实质: 盐在溶液中电离出的离子与水中电离出的H+ 或OH-结合生成弱电解质, 从而破坏了水的电离平衡,使溶液显示出不同程度的酸、碱性或中性。
3盐类水解的结果:水的电离平衡向正向移动。
[讨论] NaCl溶液能否水解?
[总结] 各类盐水解的比较
盐类 | 实例 | 能否水解 | 引起水解的离子 | 对水的电离平衡的影响 | 溶液的酸碱性 |
强碱弱酸盐 | CH3COONa Na2CO3 | 能 | 弱酸阴离子 | 促进水的电离 | 碱性 |
强酸弱碱盐 | NH4Cl Al2(SO4)3 | 能 | 弱碱阳离子 | 促进水的电离 | 酸性 |
强酸强碱盐 | NaCl Na2SO4 | 不能 | 无 | 无 | 中性 |
[共同总结盐类水解规律] 有弱才水解;无弱不水解;
谁弱谁水解;谁强显谁性;同强显中性 。
[学生练习]
1.下列离子在水溶液中不会发生水解的是( )
A、 NH4+ B、 SO42_ C、 Al3+ D、 F_
2. 下列溶液PH小于7的是( )
A、氯化钾 B、 硫酸铜 C、硝酸钡 D、 碳酸钾
3. 0.1mol/L的CH3COONa溶液中CH3COO—浓度是否为 0.1mol/L?
4. NaClO溶液中含有哪些粒子?
[学生小结]
[作业布置] 课本习题 1、2 、补充题:分析Na2CO3溶液中的粒子。
[板书设计] 第三节 盐类的水解
一、 盐类水解
1、定义: 在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。
2、实质: 生成弱电解质。
3、盐类水解的结果: 水的电离平衡向正向移动。
4、规律:
有弱才水解;无弱不水解;
谁弱谁水解;谁强显谁性;
同强显中性。
高中化学人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡第二节 水的电离和溶液的酸碱性教学设计及反思: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡第二节 水的电离和溶液的酸碱性教学设计及反思,共5页。
化学第三节 盐类的水解教学设计: 这是一份化学第三节 盐类的水解教学设计,共5页。
人教版 (新课标)选修4 化学反应原理第三节 盐类的水解教案设计: 这是一份人教版 (新课标)选修4 化学反应原理第三节 盐类的水解教案设计,共4页。













