

还剩13页未读,
继续阅读
2019届二轮复习 化学反应与能量 作业(全国通用) (9) 练习
展开
化学反应与能量
考点一 正确理解反应热 准确判断吸热与放热
[题组训练·考能]
题组一 反应热、燃烧热和中和热
1.分别向1 L 0.5 mol·L-1的Ba(OH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是
( )。
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
解析 混合时浓硫酸在被稀释的过程中放热;浓、稀硫酸在与Ba(OH)2反应的同时会形成BaSO4沉淀,Ba2+、SO之间形成化学键的过程中也会放出热量。因放热反应的ΔH为负值,故ΔH1<ΔH2<ΔH3。
答案 B
2.下列说法正确的是 ( )。
A.1 g H2和4 g O2反应放出71.45 kJ热量,则氢气的燃烧热为142.9 kJ·mol-1
B.在稀溶液中,H+(aq)+OH-(aq)===H2O(1) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量大于57.3 kJ
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
解析 1 g H2和4 g O2反应时,氧气量不足,所以放出的热量小于氢气完全反应时放出的热量,即氢气的燃烧热大于142.9 kJ·mol-1,A错;因为浓硫酸溶于水时放热,所以B正确;中和热是指在一定条件下强酸与强碱的稀溶液反应生成1 mol H2O所放出的热量,与酸和碱的元数无关,C项错;燃烧热是指1 mol纯物质完全燃烧时生成稳定的氧化物时所放出的热量,稳定氧化物一方面指氧化物稳定另一方面氧化物的状态稳定,生成的水应为液态,D错误。
答案 B
—————[易错警示]————————————
1.反应是否需要加热,只是引发反应的条件,与反应是放热还是吸热并无直接关系。许多放热反应也需要加热引发反应,也有部分吸热反应不需加热,在常温时就可以进行。
2.燃烧热是指101 kPa时1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,并不是1 mol可燃物燃烧时放出的热量就是燃烧热。
3.中和热不是指1 mol酸与1 mol碱中和时的热效应,而是指“生成1 mol H2O(l)”的热效应,强酸和强碱在稀溶液中发生中和反应生成1 mol H2O,ΔH=-57.3 kJ·mol-1。弱酸与强碱,强酸与弱碱或弱酸与弱碱反应时,因电离吸热,放出的热量减小,中和热减小。若用浓硫酸(或NaOH固体),因溶解放热放出的热量增多,中和热增大。
题组一 化学反应中的能量变化
3.下列说法中正确的是 ( )。
A.凡有能量变化的过程都是化学变化
B.吸热反应只有在加热的条件下才能进行
C.放热反应可能需要在加热的条件下才能进行
D.化学反应中的能量变化都只以热能的形式表现出来
解析 有些物理变化过程也有能量的变化,A错;NH4HCO3分解是吸热反应,但不加热时也能进行,B错;化学反应中的能量变化的表现形式除热能外还有光能、电能等,D错。
答案 C
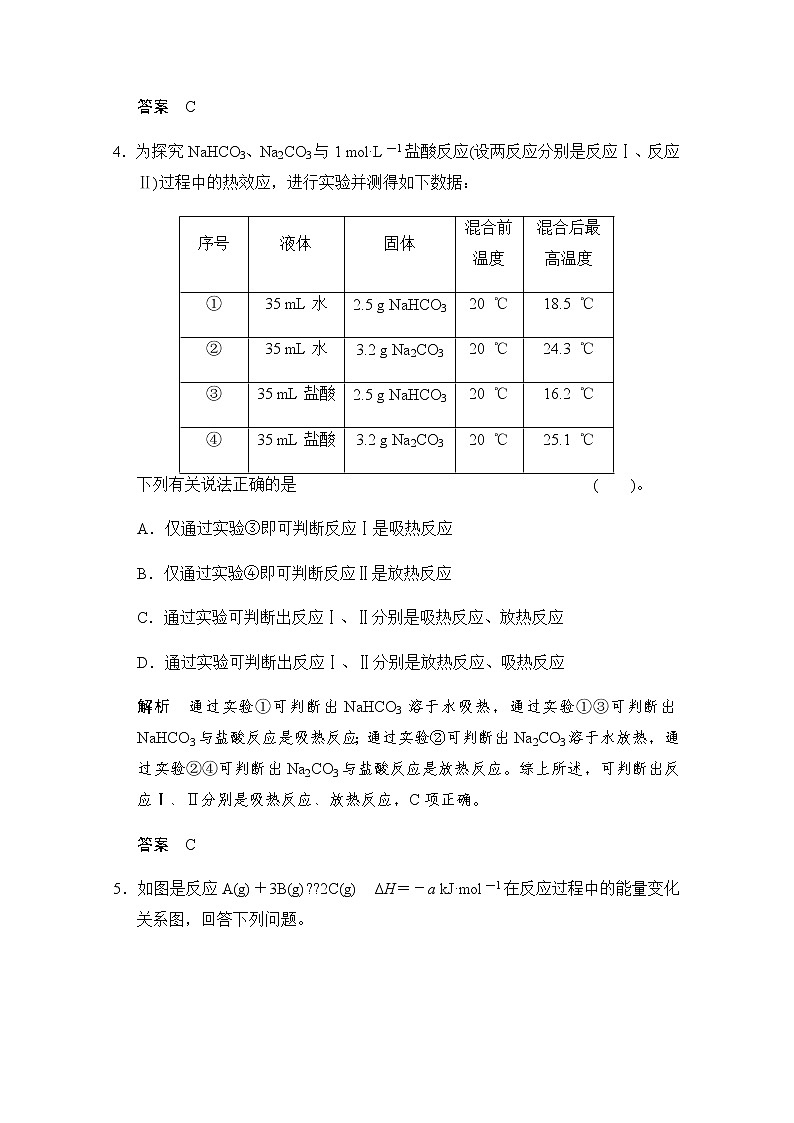
4.为探究NaHCO3、Na2CO3与1 mol·L-1盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
序号
液体
固体
混合前温度
混合后最高温度
①
35 mL水
2.5 g NaHCO3
20 ℃
18.5 ℃
②
35 mL水
3.2 g Na2CO3
20 ℃
24.3 ℃
③
35 mL盐酸
2.5 g NaHCO3
20 ℃
16.2 ℃
④
35 mL盐酸
3.2 g Na2CO3
20 ℃
25.1 ℃
下列有关说法正确的是 ( )。
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
解析 通过实验①可判断出NaHCO3溶于水吸热,通过实验①③可判断出NaHCO3与盐酸反应是吸热反应;通过实验②可判断出Na2CO3溶于水放热,通过实验②④可判断出Na2CO3与盐酸反应是放热反应。综上所述,可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应,C项正确。
答案 C
5.如图是反应A(g)+3B(g)??2C(g) ΔH=-a kJ·mol-1在反应过程中的能量变化关系图,回答下列问题。
(1)正反应是________(填“放”或“吸”)热反应,Ec表示的含义是________;Ec′表示的含义是________;a=________。
(2)由示意图知,反应物的总能量________(填“>”、“<”或“=”)生成物的总能量,此反应中反应物的总键能________(填“>”、“<”或“=”)生成物的总键能。
(3)将1 mol A、3 mol B混合置于密闭容器中,能量变化的范围是________,当达到平衡时能量的实际变化为0.7 a kJ时,B的转化率为________。
解析 因生成物的总能量低于反应物的总能量,故A(g)+3B(g)??2C(g)为放热反应,反应物的总键能小于生成物的总键能;a=E1-E2=Ec′-Ec,该反应为可逆反应,故当有1 mol A、3 mol B恰好完全反应生成2 mol C时放出a kJ的热量;当实际上有0.7 a kJ的热量放出时,表明反应物的转化率为70%。
答案 (1)放 正反应的活化能 逆反应的活化能
E1-E2(或Ec′-Ec)
(2)> <
(3)大于0,小于a kJ 70%
—————[易错警示]————————————
1.旧化学键的断裂和新化学键的形成是同时进行的,缺少任一个过程都不是化学变化。
2.计算物质中共价键的个数时要结合物质的结构,如1 mol晶体硅中含2 mol Si—Si键。1 mol SiO2中含4 mol Si—O键。
www.ks5u.com
考点二
热化学方程式的书写与正误判断
[题组训练·考能]
题组一 热化学方程式的正误判断型
1.下列热化学方程式书写正确的是 ( )。
A.2SO2+O22SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
解析 选项A中的热化学方程式未注明物质的状态;选项C中ΔH的单位错误;选项D是放热反应,ΔH应小于0。
答案 B
2.化学反应N2+3H22NH3的能量变化如图所示,该反应的热化学方程式是 ( )。
A.N2(g)+3H2(g)??2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)??2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)??NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g)??NH3(g) ΔH=(a+b)kJ·mol-1
解析 通过图分析可知,由mol N2(g)+mol H2(g)到生成到1 mol NH3(l)的三阶段为:①吸收能量a kJ;②放出能量b kJ;③放出能量c kJ,故可得热化学方程式:
N2(g)+H2(g)??NH3(l)
ΔH=(a-b-c)kJ·mol-1,扩大化学计量数后得到A。
答案 A
3.燃烧热是指通常状况下1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量。下列说法正确的是 ( )。
A.通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
B.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
D.已知:①C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 ②C(s,金刚石)+O2(g)===CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,金刚石)===C(s,石墨) ΔH=-1.5 kJ·mol-1
解析 表示氢气燃烧热的热化学方程式中H2(g)的化学计量数应为1,A错;气体变为液体时要放出能量,所以1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ,B错;此反应为可逆反应,故投入0.5 mol的氮气和1.5 mol氢气,最终参加反应的氮气一定小于0.5 mol,因此1 mol N2完全反应放出的热量应大于38.6 kJ,则热化学方程式中ΔH应小于-38.6 kJ·mol-1,不是通常状况时ΔH应标明确所处状况,选项C不正确;D中由②-①可知正确。
答案 D
—————[方法技能]————————————
五个角度判断热化学方程式的正误
一审“+”“-”—放热反应ΔH一定为“-”,吸热反应ΔH一定为“+”
↓
二审单位—单位一定为“kJ·mol-1”,易错写成“kJ”或漏写
↓
三审状态—物质的状态必须正确,特别是溶液中的反应易写错
↓
四审数值—反应热的数值必须与方程式中的化学计量数相对应,即ΔH与化
学计量数成正比。当反应逆向进行时,其反应热与正反应的反应
热数值相等,符号相反
↓
五审是否符合概念—如燃烧热、中和热的热化学方程式
题组二 信息型热化学方程式的书写
4.(1)25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态水,放出22.68 kJ热量,则该反应的热化学方程式为____________。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5 kJ热量,则该反应的热化学方程式为______________________。
(3)肼(N2H4)是一种高效清洁的火箭燃料。
0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则肼燃烧的热化学方程式为___________________________________________。
解析 (3)先写出肼燃烧的化学方程式:N2H4+O2===N2+2H2O,据0.25 mol N2H4(g)完全燃烧生成N2和H2O(g),放出热量133.5 kJ,可知1 mol N2H4完全燃烧放出的热量为534 kJ。
答案 (1)CH3OH(l)+O2(g)===CO2(g)+2H2O(l)ΔH=-725.76 kJ·mol-1
(2)B2H6(g)+3O2(g)===B2O3(s)+3H2O(l)
ΔH=-2 165 kJ·mol-1
(3)N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1
5.(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。
请写出NO2和CO反应的热化学方程式:____________________________
_______________________________________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1。
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为___________________
_______________________________________________________________。
答案 (1)减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1 (2)CH3OH(g)+O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1
—————[方法技能]————————————
“五步”书写热化学方程式
一写方程式—写出配平的化学方程式
↓
二标状态—用s、l、g、aq标明物质的聚集状态
↓
三标条件—标明反应的温度和压强(101 kPa、25 ℃时可不标注)
↓
四标ΔH—在方程式后写出ΔH,并根据信息注明ΔH的“+”或“-”
↓
五标数值—根据化学计量数计算写出ΔH的值
www.ks5u.com
www.ks5u.com
考点三 盖斯定律及其重要应用
[题组训练·考能]
题组一 利用盖斯定律求反应焓变
1.已知:
2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为 ( )。
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
解析 根据盖斯定律,由(①-②)可得:Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH=(-701.0 kJ·mol-1+181.6 kJ·mol-1)=-259.7 kJ·mol-1。
答案 C
2.(1)已知:
甲醇脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g)ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OH(g)===C2H4(g)+2H2O(g)ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OH(g)===CH3OCH3(g)ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。
(2)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g)??1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
② CaSO4(s)+CO(g)??CaO(s)+CO2(g) +SO2(g)
ΔH2=+210.5 kJ·mol-1
③ CO(g)??1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)??CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)
解析 (1)将题中给出的三个热化学方程式依次编号为①,②,③,根据盖斯定律,由①-②-③得:C2H4(g)+H2O(g)===C2H5OH(g)
ΔH=-45.5 kJ·mol-1。
(2)根据盖斯定律,可知①×4+②+③×2得ΔH=4ΔH1+ΔH2+2ΔH3。
答案 (1)-45.5
(2)4ΔH1+ΔH2+2ΔH3
题组二 利用盖斯定律书写热化学方程式
3.(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g)
ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
______________________________________________________________
______________________________________________________________。
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g)+O2(g)===2NO(g)
ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为
______________________________________________________________
______________________________________________________________。
答案 (1)CH3OH(l)+O2(g)===CO(g)+2H2O(l)
ΔH=-442.8 kJ·mol-1
(2)2H2(g)+2NO(g)===N2(g)+2H2O(l)
ΔH=-752.1 kJ·mol-1
4.白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)===P4O10(s)
ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+O2(g)===P4O10(s)
ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为
_______________________________________________________________
_______________________________________________________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
解析 (1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4(s,白磷)===4P(s,红磷) ΔH=-2 983.2 kJ·mol-1-(-738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。(2)n(白磷)==0.5 mol,n(O2)==2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol-1×0.375 mol+1 638 kJ·mol-1×0.125 mol=1 323.45 kJ。
答案 (1)P4(s,白磷)===4P(s,红磷)
ΔH=-29.2 kJ·mol-1
(2)3∶1 1 323.45 kJ
—————[思维建模]————————————
利用盖斯定律书写热化学方程式的思维模型
题组三 利用盖斯定律比较反应热
5.已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4P(s,红)+5O2(g)===2P2O5(s) ΔH1
②4P(s,白)+5O2(g)===2P2O5(s) ΔH2
则ΔH1与ΔH2的关系正确的是 ( )。
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
解析 根据提供信息,由反应①减去反应②可得,4P(s,红)===4P(s,白);ΔH=ΔH1-ΔH2=+18.39 kJ·mol-1×4=+73.56 kJ·mol-1,故ΔH1>ΔH2,B正确。
答案 B
6.下列两组热化学方程式中,有关ΔH的比较正确的是 ( )。
①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2
②NaOH(aq)+H2SO4(浓)===Na2SO4(aq)+H2O(l) ΔH3
NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH4
A.ΔH1>ΔH2;ΔH3>ΔH4
B.ΔH1>ΔH2;ΔH3<ΔH4
C.ΔH1=ΔH2;ΔH3<ΔH4
D.ΔH1<ΔH2;ΔH3>ΔH4
解析 由于H2O(g)转化为H2O(l)要放出热量,所以等物质的量的CH4(g)燃烧生成液态水时放出热量的数值要比生成气态水时的大。等物质的量的NaOH与稀醋酸、浓H2SO4恰好反应生成等物质的量的水,若不考虑浓H2SO4溶解放热和弱电解质电离吸热,应放出相同的热量。但在实际反应中,浓H2SO4溶于水时放热,使反应放出的总热量增多;醋酸是弱酸,部分CH3COOH分子在电离过程中要吸热,使反应放热减小,在比较反应热时要注意ΔH为负值。
答案 B
—————[失分防范]————————————
比较反应热大小的四个注意要点
(1)反应物和生成物的状态
物质的气、液、固三态的变化与反应热的关系。
(2)ΔH的符号:比较反应热的大小时,不要只比较ΔH数值的大小,还要考虑其符号。
(3)参加反应物质的量:当反应物和生成物的状态相同时,参加反应物质的量越多,放热反应的ΔH越小,吸热反应的ΔH越大。
(4)反应的程度:参加反应物质的量和状态相同时,反应的程度越大,热量变化越大。
考点一 正确理解反应热 准确判断吸热与放热
[题组训练·考能]
题组一 反应热、燃烧热和中和热
1.分别向1 L 0.5 mol·L-1的Ba(OH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是
( )。
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
解析 混合时浓硫酸在被稀释的过程中放热;浓、稀硫酸在与Ba(OH)2反应的同时会形成BaSO4沉淀,Ba2+、SO之间形成化学键的过程中也会放出热量。因放热反应的ΔH为负值,故ΔH1<ΔH2<ΔH3。
答案 B
2.下列说法正确的是 ( )。
A.1 g H2和4 g O2反应放出71.45 kJ热量,则氢气的燃烧热为142.9 kJ·mol-1
B.在稀溶液中,H+(aq)+OH-(aq)===H2O(1) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量大于57.3 kJ
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
解析 1 g H2和4 g O2反应时,氧气量不足,所以放出的热量小于氢气完全反应时放出的热量,即氢气的燃烧热大于142.9 kJ·mol-1,A错;因为浓硫酸溶于水时放热,所以B正确;中和热是指在一定条件下强酸与强碱的稀溶液反应生成1 mol H2O所放出的热量,与酸和碱的元数无关,C项错;燃烧热是指1 mol纯物质完全燃烧时生成稳定的氧化物时所放出的热量,稳定氧化物一方面指氧化物稳定另一方面氧化物的状态稳定,生成的水应为液态,D错误。
答案 B
—————[易错警示]————————————
1.反应是否需要加热,只是引发反应的条件,与反应是放热还是吸热并无直接关系。许多放热反应也需要加热引发反应,也有部分吸热反应不需加热,在常温时就可以进行。
2.燃烧热是指101 kPa时1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,并不是1 mol可燃物燃烧时放出的热量就是燃烧热。
3.中和热不是指1 mol酸与1 mol碱中和时的热效应,而是指“生成1 mol H2O(l)”的热效应,强酸和强碱在稀溶液中发生中和反应生成1 mol H2O,ΔH=-57.3 kJ·mol-1。弱酸与强碱,强酸与弱碱或弱酸与弱碱反应时,因电离吸热,放出的热量减小,中和热减小。若用浓硫酸(或NaOH固体),因溶解放热放出的热量增多,中和热增大。
题组一 化学反应中的能量变化
3.下列说法中正确的是 ( )。
A.凡有能量变化的过程都是化学变化
B.吸热反应只有在加热的条件下才能进行
C.放热反应可能需要在加热的条件下才能进行
D.化学反应中的能量变化都只以热能的形式表现出来
解析 有些物理变化过程也有能量的变化,A错;NH4HCO3分解是吸热反应,但不加热时也能进行,B错;化学反应中的能量变化的表现形式除热能外还有光能、电能等,D错。
答案 C
4.为探究NaHCO3、Na2CO3与1 mol·L-1盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
序号
液体
固体
混合前温度
混合后最高温度
①
35 mL水
2.5 g NaHCO3
20 ℃
18.5 ℃
②
35 mL水
3.2 g Na2CO3
20 ℃
24.3 ℃
③
35 mL盐酸
2.5 g NaHCO3
20 ℃
16.2 ℃
④
35 mL盐酸
3.2 g Na2CO3
20 ℃
25.1 ℃
下列有关说法正确的是 ( )。
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
解析 通过实验①可判断出NaHCO3溶于水吸热,通过实验①③可判断出NaHCO3与盐酸反应是吸热反应;通过实验②可判断出Na2CO3溶于水放热,通过实验②④可判断出Na2CO3与盐酸反应是放热反应。综上所述,可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应,C项正确。
答案 C
5.如图是反应A(g)+3B(g)??2C(g) ΔH=-a kJ·mol-1在反应过程中的能量变化关系图,回答下列问题。
(1)正反应是________(填“放”或“吸”)热反应,Ec表示的含义是________;Ec′表示的含义是________;a=________。
(2)由示意图知,反应物的总能量________(填“>”、“<”或“=”)生成物的总能量,此反应中反应物的总键能________(填“>”、“<”或“=”)生成物的总键能。
(3)将1 mol A、3 mol B混合置于密闭容器中,能量变化的范围是________,当达到平衡时能量的实际变化为0.7 a kJ时,B的转化率为________。
解析 因生成物的总能量低于反应物的总能量,故A(g)+3B(g)??2C(g)为放热反应,反应物的总键能小于生成物的总键能;a=E1-E2=Ec′-Ec,该反应为可逆反应,故当有1 mol A、3 mol B恰好完全反应生成2 mol C时放出a kJ的热量;当实际上有0.7 a kJ的热量放出时,表明反应物的转化率为70%。
答案 (1)放 正反应的活化能 逆反应的活化能
E1-E2(或Ec′-Ec)
(2)> <
(3)大于0,小于a kJ 70%
—————[易错警示]————————————
1.旧化学键的断裂和新化学键的形成是同时进行的,缺少任一个过程都不是化学变化。
2.计算物质中共价键的个数时要结合物质的结构,如1 mol晶体硅中含2 mol Si—Si键。1 mol SiO2中含4 mol Si—O键。
www.ks5u.com
考点二
热化学方程式的书写与正误判断
[题组训练·考能]
题组一 热化学方程式的正误判断型
1.下列热化学方程式书写正确的是 ( )。
A.2SO2+O22SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
解析 选项A中的热化学方程式未注明物质的状态;选项C中ΔH的单位错误;选项D是放热反应,ΔH应小于0。
答案 B
2.化学反应N2+3H22NH3的能量变化如图所示,该反应的热化学方程式是 ( )。
A.N2(g)+3H2(g)??2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)??2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)??NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g)??NH3(g) ΔH=(a+b)kJ·mol-1
解析 通过图分析可知,由mol N2(g)+mol H2(g)到生成到1 mol NH3(l)的三阶段为:①吸收能量a kJ;②放出能量b kJ;③放出能量c kJ,故可得热化学方程式:
N2(g)+H2(g)??NH3(l)
ΔH=(a-b-c)kJ·mol-1,扩大化学计量数后得到A。
答案 A
3.燃烧热是指通常状况下1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量。下列说法正确的是 ( )。
A.通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
B.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
D.已知:①C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 ②C(s,金刚石)+O2(g)===CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,金刚石)===C(s,石墨) ΔH=-1.5 kJ·mol-1
解析 表示氢气燃烧热的热化学方程式中H2(g)的化学计量数应为1,A错;气体变为液体时要放出能量,所以1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ,B错;此反应为可逆反应,故投入0.5 mol的氮气和1.5 mol氢气,最终参加反应的氮气一定小于0.5 mol,因此1 mol N2完全反应放出的热量应大于38.6 kJ,则热化学方程式中ΔH应小于-38.6 kJ·mol-1,不是通常状况时ΔH应标明确所处状况,选项C不正确;D中由②-①可知正确。
答案 D
—————[方法技能]————————————
五个角度判断热化学方程式的正误
一审“+”“-”—放热反应ΔH一定为“-”,吸热反应ΔH一定为“+”
↓
二审单位—单位一定为“kJ·mol-1”,易错写成“kJ”或漏写
↓
三审状态—物质的状态必须正确,特别是溶液中的反应易写错
↓
四审数值—反应热的数值必须与方程式中的化学计量数相对应,即ΔH与化
学计量数成正比。当反应逆向进行时,其反应热与正反应的反应
热数值相等,符号相反
↓
五审是否符合概念—如燃烧热、中和热的热化学方程式
题组二 信息型热化学方程式的书写
4.(1)25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态水,放出22.68 kJ热量,则该反应的热化学方程式为____________。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5 kJ热量,则该反应的热化学方程式为______________________。
(3)肼(N2H4)是一种高效清洁的火箭燃料。
0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则肼燃烧的热化学方程式为___________________________________________。
解析 (3)先写出肼燃烧的化学方程式:N2H4+O2===N2+2H2O,据0.25 mol N2H4(g)完全燃烧生成N2和H2O(g),放出热量133.5 kJ,可知1 mol N2H4完全燃烧放出的热量为534 kJ。
答案 (1)CH3OH(l)+O2(g)===CO2(g)+2H2O(l)ΔH=-725.76 kJ·mol-1
(2)B2H6(g)+3O2(g)===B2O3(s)+3H2O(l)
ΔH=-2 165 kJ·mol-1
(3)N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1
5.(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。
请写出NO2和CO反应的热化学方程式:____________________________
_______________________________________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1。
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为___________________
_______________________________________________________________。
答案 (1)减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1 (2)CH3OH(g)+O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1
—————[方法技能]————————————
“五步”书写热化学方程式
一写方程式—写出配平的化学方程式
↓
二标状态—用s、l、g、aq标明物质的聚集状态
↓
三标条件—标明反应的温度和压强(101 kPa、25 ℃时可不标注)
↓
四标ΔH—在方程式后写出ΔH,并根据信息注明ΔH的“+”或“-”
↓
五标数值—根据化学计量数计算写出ΔH的值
www.ks5u.com
www.ks5u.com
考点三 盖斯定律及其重要应用
[题组训练·考能]
题组一 利用盖斯定律求反应焓变
1.已知:
2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为 ( )。
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
解析 根据盖斯定律,由(①-②)可得:Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH=(-701.0 kJ·mol-1+181.6 kJ·mol-1)=-259.7 kJ·mol-1。
答案 C
2.(1)已知:
甲醇脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g)ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OH(g)===C2H4(g)+2H2O(g)ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OH(g)===CH3OCH3(g)ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。
(2)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g)??1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
② CaSO4(s)+CO(g)??CaO(s)+CO2(g) +SO2(g)
ΔH2=+210.5 kJ·mol-1
③ CO(g)??1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)??CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)
解析 (1)将题中给出的三个热化学方程式依次编号为①,②,③,根据盖斯定律,由①-②-③得:C2H4(g)+H2O(g)===C2H5OH(g)
ΔH=-45.5 kJ·mol-1。
(2)根据盖斯定律,可知①×4+②+③×2得ΔH=4ΔH1+ΔH2+2ΔH3。
答案 (1)-45.5
(2)4ΔH1+ΔH2+2ΔH3
题组二 利用盖斯定律书写热化学方程式
3.(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g)
ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
______________________________________________________________
______________________________________________________________。
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g)+O2(g)===2NO(g)
ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为
______________________________________________________________
______________________________________________________________。
答案 (1)CH3OH(l)+O2(g)===CO(g)+2H2O(l)
ΔH=-442.8 kJ·mol-1
(2)2H2(g)+2NO(g)===N2(g)+2H2O(l)
ΔH=-752.1 kJ·mol-1
4.白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)===P4O10(s)
ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+O2(g)===P4O10(s)
ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为
_______________________________________________________________
_______________________________________________________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
解析 (1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4(s,白磷)===4P(s,红磷) ΔH=-2 983.2 kJ·mol-1-(-738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。(2)n(白磷)==0.5 mol,n(O2)==2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol-1×0.375 mol+1 638 kJ·mol-1×0.125 mol=1 323.45 kJ。
答案 (1)P4(s,白磷)===4P(s,红磷)
ΔH=-29.2 kJ·mol-1
(2)3∶1 1 323.45 kJ
—————[思维建模]————————————
利用盖斯定律书写热化学方程式的思维模型
题组三 利用盖斯定律比较反应热
5.已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4P(s,红)+5O2(g)===2P2O5(s) ΔH1
②4P(s,白)+5O2(g)===2P2O5(s) ΔH2
则ΔH1与ΔH2的关系正确的是 ( )。
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
解析 根据提供信息,由反应①减去反应②可得,4P(s,红)===4P(s,白);ΔH=ΔH1-ΔH2=+18.39 kJ·mol-1×4=+73.56 kJ·mol-1,故ΔH1>ΔH2,B正确。
答案 B
6.下列两组热化学方程式中,有关ΔH的比较正确的是 ( )。
①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2
②NaOH(aq)+H2SO4(浓)===Na2SO4(aq)+H2O(l) ΔH3
NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH4
A.ΔH1>ΔH2;ΔH3>ΔH4
B.ΔH1>ΔH2;ΔH3<ΔH4
C.ΔH1=ΔH2;ΔH3<ΔH4
D.ΔH1<ΔH2;ΔH3>ΔH4
解析 由于H2O(g)转化为H2O(l)要放出热量,所以等物质的量的CH4(g)燃烧生成液态水时放出热量的数值要比生成气态水时的大。等物质的量的NaOH与稀醋酸、浓H2SO4恰好反应生成等物质的量的水,若不考虑浓H2SO4溶解放热和弱电解质电离吸热,应放出相同的热量。但在实际反应中,浓H2SO4溶于水时放热,使反应放出的总热量增多;醋酸是弱酸,部分CH3COOH分子在电离过程中要吸热,使反应放热减小,在比较反应热时要注意ΔH为负值。
答案 B
—————[失分防范]————————————
比较反应热大小的四个注意要点
(1)反应物和生成物的状态
物质的气、液、固三态的变化与反应热的关系。
(2)ΔH的符号:比较反应热的大小时,不要只比较ΔH数值的大小,还要考虑其符号。
(3)参加反应物质的量:当反应物和生成物的状态相同时,参加反应物质的量越多,放热反应的ΔH越小,吸热反应的ΔH越大。
(4)反应的程度:参加反应物质的量和状态相同时,反应的程度越大,热量变化越大。
相关资料
更多








