

山西省长治学院附属太行中学校2024-2025学年高二上学期第一次月考 化学试题
展开可能用到的相对原子质量:H:1 C:12 O:16 N:14 Zn:65
Ⅰ卷(42分)
一、单选题:本题共14小题,每小题3分 共42分。
1.“高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是( )
A. AB. BC. CD. D
2.下列离子方程式的书写正确的是( )
A. 澄清石灰水与过量碳酸氢钠溶液反应:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
B. 向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-恰好完成沉淀;Ba2++2OH-+2H++SO42-=BaSO4↓+ 2H2O
C. 钠与CuSO4溶液反应的离子方程式:2Na+Cu2+=Cu↓+2Na+
D. 向石灰乳中加入盐酸:OH-+H+=H2O
3.研究反应2X(g)⇀↽Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y,Z的起始浓度均为0,反应物X的浓度(ml·L-1)随反应时间(min)的变化情况如图所示。每组实验只改变一个条件。下列说法不正确的是( )
A. 比较实验①②③④得出:实验②最晚到达平衡
B. 比较实验①②得出:其他条件相同时,增大反应物浓度化学反应速率加快
C. 比较实验②③得出:实验③有可能使用了催化剂,催化剂能加快正反应速率,但对逆反应速率无影响
D. 比较实验②④得出:其他条件相同时,升高温度化学反应速率加快
4.下列事实能用平衡移动原理解释的是( )
A. H2O2溶液中加入少量MnO2固体,促进H2O2分解
B. 密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C. 铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体
D. 锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
5.相同温度下,在三个容积相等的恒容密闭容器中分别进行反应:H2(g) + I2(g)⇀↽2HI(g)。达到化学平衡状态时,相关数据如下表。下列说法不正确的是( )
A. 该温度下,反应的平衡常数为0.25 B. 实验Ⅱ达平衡时,a=0.016
C. 实验Ⅲ开始时,反应向消耗H2的方向移动
D. 达到化学平衡后,压缩三个容器的体积,平衡均不发生移动
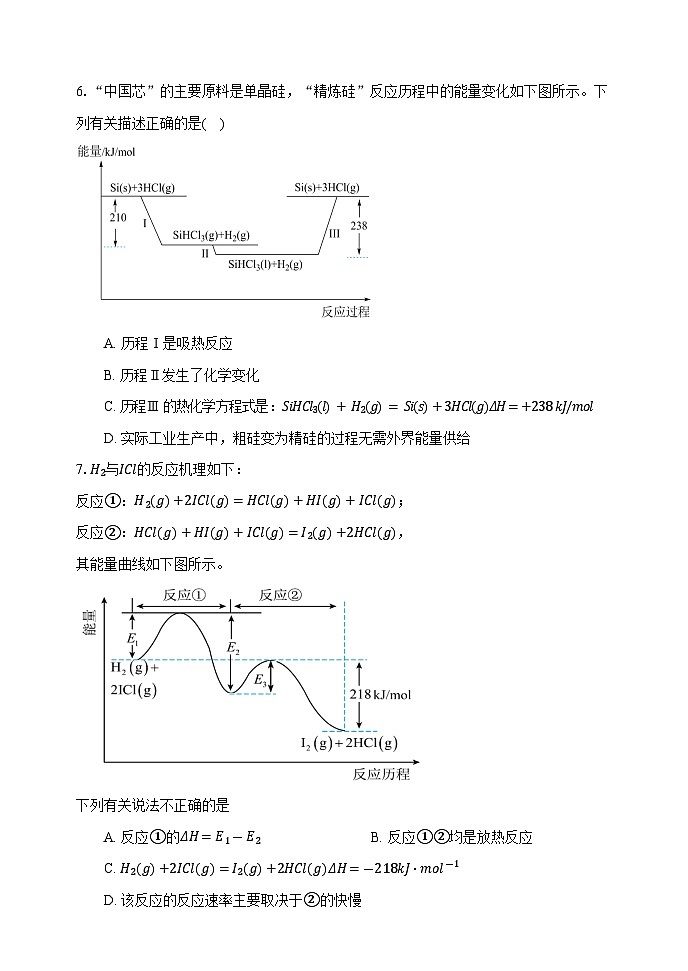
6.“中国芯”的主要原料是单晶硅,“精炼硅”反应历程中的能量变化如下图所示。下列有关描述正确的是( )
A. 历程Ⅰ是吸热反应
B. 历程Ⅱ发生了化学变化
C. 历程Ⅲ 的热化学方程式是:SiHCl3(l) + H2(g) = Si(s)+3HCl(g)ΔH=+238 kJ/ml
D. 实际工业生产中,粗硅变为精硅的过程无需外界能量供给
7.H2与ICl的反应机理如下:
反应①:H2g+2IClg=HClg+HIg+IClg;
反应②:HClg+HIg+IClg=I2g+2HClg,
其能量曲线如下图所示。
下列有关说法不正确的是
A. 反应①的ΔH=E1-E2 B. 反应①②均是放热反应
C. H2g+2IClg=I2g+2HClgΔH=-218kJ⋅ml-1
D. 该反应的反应速率主要取决于②的快慢
8.按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A. Ⅰ中试管内的反应,体现H+的氧化性
B. Ⅱ中品红溶液褪色,体现SO2的还原性
C. 在Ⅰ和Ⅲ的试管中,都出现了浑浊现象
D. 撤掉水浴,重做实验,Ⅳ中红色更快褪去
9.某化学小组欲探究反应“2Fe3++2I-⇀↽2Fe2++I2”为可逆反应,做了如下实验:
已知:I2+H2O⇀↽HI+HIO
现象为:实验ii中产生了黄色沉淀;实验iii中溶液变蓝;实验iv中溶液不变蓝,下列说法中不正确的是
A. 实验ii中产生黄色沉淀的离子方程式为Ag++I-=AgI↓
B. 实验iii加淀粉溶液变蓝,证明棕黄色溶液中有I2生成
C. 设计实验iv的目的是为了排除空气中氧气氧化I-的可能
D. 通过上述实验可以证明“2Fe3++2I-⇀↽2Fe2++I2”为可逆反应
10.已知有如下热化学方程式,下列判断错误的是( )
①Cs+O2g=CO2g ΔH1=akJ⋅ml-1 K1
②Cs+12O2g=COg ΔH2=bkJ⋅ml-1 K2
③2H2g+O2g=2H2Og ΔH3=ckJ⋅ml-1 K3
④COg+H2Og=CO2g+H2g ΔH4=dkJ⋅ml-1 K4
A. a
11.一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是( )
A. XEZ4是一种强酸
B. 原子半径:Y>W>E
C. 非金属性:W>Z>Y
D. ZW2中,Z的化合价为+2价
12.可逆反应A(g)+3B(g)⇌2C(g) ΔH<0。有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中充入1 ml A和3 ml B,在一定条件下达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中充入2 ml C,达到平衡时吸收热量为Q2kJ,已知Q1=3Q2。下列叙述正确的是 ( )
A. 平衡时,甲、乙中C的体积分数为甲>乙
B. 平衡时,甲中A的转化率为75%
C. 达到平衡后,再向乙中加入0.25 ml A、0.75 ml B和1.5 ml C,平衡向生成A的方向移动
D. 乙中反应的热化学方程式为2C(g)⇌A(g)+3B(g) ΔH=+Q2kJ/ml
13.实验室分别进行如下实验:①向蓝色的VOSO4溶液中滴加酸性KMnO4溶液,溶液由蓝色变为淡黄色(VO2+);②向(VO2)2SO4溶液中滴加浓盐酸,产生黄绿色气体,溶液变蓝。下列说法正确的是( )
A. ①中还原剂与氧化剂物质的量之比为1∶5
B. ②中每生成标准状况下11.2L气体,转移1ml电子
C. 由①②可知,酸性条件下氧化性:MnO 4->Cl2>VO2+
D. 向(VO2)2SO4溶液中滴加FeI2溶液发生反应Fe2++VO2++2H+=Fe3++VO2++H2O
14.二氧化碳加氢制甲醇涉及的反应可表示为:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH1=-49kJ⋅ml-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2=+41kJ⋅ml-1
一体积固定的密闭容器中,在5MPa下,按照n(CO2):n(H2)=1:3投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如题图所示.下列说法正确的是( )
A. H2的平衡转化率始终低于CO2
B. n曲线代表的物质为CH3OH温度越高,越有利于CH3OH的生成
C. 270~400℃时,平衡移动的程度:反应Ⅰ>反应Ⅱ
D. 加入选择性高的催化剂,可提高CH3OH的平衡转化率
Ⅱ卷(58分)
二、填空题:本大题共4小题,共58分。
15.(除标注外每空2分,共15分)每二甲醚(CH3OCH3)是一种洁净液体燃料,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压强:2.0∼10.0 MIPa.温度:230-280℃) 进行下列反应:
反应i:COg+2H2g⇀↽CH3OHg ΔH1=-99kJ⋅ml-1
反应ii:2CH3OH(g)⇀↽CH3OCH3g+H2OgΔH2=-23.5kJ⋅ml-1
反应iii:COg+H2Og⇀↽CO2g+H2gΔH3=-41.2kJ⋅ml-1
(1)在该条件下,若反应i的起始浓度分别为cCO=1.2ml⋅L-1,cH2=2.8ml⋅L-1,8min后达到化学平衡状态,CO的转化率为50%,则8min内CO的平均反应速率为_____
(2)在t℃时.反应ii的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时v正_____v逆(填“>”“<”或“=”)
(3)催化总反应为:3COg+3H2g⇀↽CH3OCH3g+CO2gΔH4
①ΔH4=_____kJ⋅ml-1
②CO的平衡转化率α(CO)与温度、压强的关系如图I所示.图中X代表_____(填“温度”或“压强”)1分,L1_____L2(填“>”“<”或“=)。
(4)在催化剂的作用下同时进行三个反应,发现随着起始投料比nH2nCO的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势。解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因______________________。3分
(5)二甲醚(CH3OCH3)空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图3所示。
①燃料电池中的正极是_____(填“c”或“d”)电极1分。
②c电极的电极反应为_____。
实验题(除标注外每空2分,共14分)
在一恒容容器中充入一定量的A和B发生反应2A(g) + B(g)⇌2C(g),测得不同温度下B物质的百分含量随时间变化如图,请分析T1____T2(填“>”、“<”或“=”,下同),都达平衡后,T1时v(C)逆____T2时v(C)逆。
Ⅱ.某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
(1)写出高锰酸钾与草酸反应的离子方程式:_____________________________。
(2)由实验I、II可得出的结论是_______________________________。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01 ml/L酸性 KMnO4溶液,0.1 ml/L草酸溶液,3 ml/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水补全实验III的操作:向试管中先加入1 mL 0.01 ml/L酸性KMnO4溶液,_______________,最后加入1 mL 0.1 ml/L草酸溶液。
(4)该小组拟采用如图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。
你认为他们的实验方案______(填“合理”或“不合理”),理由是_________________。
17.简答题 (除标注外每空2分,共16分)工业上利用锌焙砂(主要成分为ZnO,含有少量CuO、As2O3、NiO等)生产高纯ZnO的流程示意图如下。
(1)用足量NH42SO4溶液和氨水“浸出”锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是______________。
②通过“浸出”步骤,锌焙砂中的ZnO转化为ZnNH342+,该反应的离子方程式为____。
(2)“浸出”时As2O3转化为AsO33-。“除砷”步骤①中用NH42S2O8作氧化剂,步骤①反应的离子方程式为______________________________。3分
(3)“除重金属”时加入BaS溶液。滤渣II中含有的主要物质是__________和BaSO4。
(4)“蒸氨”时会出现白色固体ZnSO4⋅Zn(OH)2,“沉锌”步骤①中加入足量NH4HCO3溶液将该白色固体转化为ZnCO3的离子方程式为__________________________。
(5)“煅烧”步骤中,不同温度下,ZnCO3分解的失重曲线和产品ZnO的比表面积变化情况如图1、图2所示。
已知:i.固体失重质量分数=样品起始质量-剩余固体质量样品起始质量×100%。
ii.比表面积指单位质量固体所具有的总面积;比表面积越大,产品ZnO的活性越高。
①280∘C时煅烧ZnCO3,300min后固体失重质量分数为33.3%,则ZnCO3的分解率为__________%(保留到小数点后一位,3分)。
②根据图1和图2,获得高产率(ZnCO3分解率>95%)、高活性(ZnO比表面积>40m2⋅g-1)产品ZnO的最佳条件是__________(填字母序号)。
a.恒温280∘C,60∼120min
b.恒温300∘C,240∼300min
c.恒温350∘C,240∼300min
d.恒温550∘C,60∼120min
18.(除标注外每空2分,共13分)CO2的捕集、利用和封存技术是践行低碳发展战略的重要技术选择。CO2甲烷化是CO2利用的重要途径,反应如下。
反应I:CO2(g)+4H2(g)⇀↽CH4(g)+2H2O(g) ΔHI=-165kJ⋅ml-1
反应II:CO2(g)+H2(g)⇀↽CO(g)+H2O(g) ΔH2=+41kJ⋅ml-1
(1)反应:CO2(g)+CH4(g)⇀↽2CO(g)+2H2(g) ΔH=__________。
(2)恒温恒容条件下,向容器中充入一定量的CO2和H2发生反应I,下列能说明反应达到平衡状态的是__________(填序号)。
a.相同时间内,每断裂2mlC=O的同时形成4mlC-H
b.H2O(g)浓度不再改变
c.容器内气体密度不再改变
d.nH2:nCH4之比不再改变
(3)向体积为1L的容器中充入1mlCO2和4mlH2,发生反应I、II.CO2的平衡转化率和CH4的选择性(指生成CH4所消耗CO2的量与CO2总消耗量的比值)随温度变化的曲线如图所示:
①CH4选择性随温度的变化曲线是____(填“X”或“Y”);CO2的平衡转化率随温度发生这种变化的主要原因是__________________________________________。
②500∘C时,反应I的平衡常数K=__________(写出计算式即可,3分)。
(4)CO2资源化利用的另一个路径是与H2在催化剂的作用下合成甲醇,发生的主反应如下:
反应III:CO2(g)+3H2(g)⇀↽CH3OH(g)+H2O(g) ΔH2=-49kJ⋅ml-1
在相同反应时间下,测得3种不同催化剂作用下的CO2转化率随温度变化的曲线如图所示。
T4到T5段随温度升高,转化率降低且曲线一致的原因为__________________。
太行中学2024—2025学年第一学期第一次月考
高二化学试题答案
1.【答案】C
【解析】【分析】
本题考查硅酸盐材料,难度一般,理解常见的硅酸盐材料是解题关键。
【解答】A.九霄环佩木古琴主要构成是木材,动物筋制得,A错误;
B.裴李岗文化骨笛由动物骨骼构成,B错误;
C.商朝后期陶埙属于陶瓷,由硅酸盐制成,C正确;
D.曾侯乙青铜编钟主要由合金材料制成,D错误;
故选C。
2.【答案】A
【解析】解:A.碳酸氢钠过量,反应生成碳酸钙、碳酸钠和水,离子方程式:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故A正确;
B.向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-恰好完成沉淀,离子方程式:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故B错误;
C.钠与硫酸铜溶液反应,生成氢氧化铜沉淀,硫酸钠和氢气,离子方程式:Cu2++2Na+2H2O=Cu(OH)2↓+2Na++H2↑,故C错误;
D.向石灰乳中加入盐酸,离子方程式:Ca(OH)2+2H+=Ca2++2H2O,故D错误;
故选:A。
A.碳酸氢钠过量,反应生成碳酸钙、碳酸钠和水;
B.向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-恰好完成沉淀,则硫酸氢钠与氢氧化钡物质的量之比为1:1,反应生成硫酸钡、氢氧化钠和水;
C.不符合反应客观事实;
D.石灰乳中氢氧化钙应保留化学式.
本题考查离子方程式正误判断,为高频考点,明确离子方程式书写规则、离子性质是解本题关键,注意:书写离子方程式要遵循客观事实、原子守恒、电荷守恒及转移电子守恒,题目难度中等.
3.【答案】C
【解析】【详解】A.从图中可知,实验③的曲线最先达到水平的拐点,实验②的曲线最晚达到水平的拐点,故实验②最晚到达平衡,A正确;
B.从图中可知,实验①反应物X初始浓度大于实验②,实验①的曲线相较于实验②更陡,说明反应速率实验①大于实验②,可以说明其他条件相同时,增大反应物浓度化学反应速率加快,B正确;
C.实验②③温度和浓度均相同,速率实验③大于实验②,则实验③可能使用了催化剂,催化剂能同时增大正逆反应速率,C错误;
D.实验②和④除了温度之外其他条件都相同,实验④的曲线相较于实验②更陡,说明实验④反应速率更快,可以说明其他条件相同时,升高温度反应速率加快,D正确;
故答案选C。
4.【答案】B
【解析】A.MnO2会催化H2O2分解,与平衡移动无关,A错误;
B.NO2转化为N2O4 的反应是放热反应,升温平衡逆向移动, NO2浓度增大,混合气体颜色加深,B正确;
C.铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C错误;
D.加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D错误;
故选B。
5.【答案】C
【解析】【知识点】压强对化学平衡移动的影响、化学平衡常数的影响因素及应用、化学平衡题中基于图表数据的相关计算
【详解】A.由第I组数据可知,达到平衡时,c(H2)=c(I2)=0.008ml/L,c(HI)=0.004ml/L,该温度下,反应的平衡常数为0.004××0.008=0.25, A正确;
B.反应条件为恒温恒容,实验Ⅱ相对于实验I相当于加压,平衡不移动,则实验Ⅱ达平衡时,故a=0.016,B正确;
C.温度不变,平衡常数不变,实验Ⅲ开始时,浓度商Q=0.04××0.02=4>K,故反应向逆反应方向,即生成H2的方向移动, C错误;
D.该反应前后气体物质的量不变,压缩三个容器的体积加压,平衡不移动,D正确;
故选C。
6.【答案】C
【解析】【分析】
本题考查物理变化与化学变化、吸热反应和放热反应、热化学方程式书写及正误判断,难度不大。
【解答】
A.历程Ⅰ中反应物能量高于生成物能量,则历程Ⅰ是放热反应,,A错误;
B.历程Ⅱ中,SiHCl3(g)转变为SiHCl3(l),同一物质三态之间的变化,为物理变化, B错误;
C.历程Ⅲ 中,反应物总能量小于生成物总能量,为吸热反应,则热化学方程式为SiHCl3(l)+H2(g)=Si(s)+3HCl(g)ΔH=+238kJ/ml, C正确;
D.粗硅和纯硅的组成物质不同能量,粗硅变为精硅的过程中能量会损耗,D错误;
7.【答案】D
【解析】【详解】A.由图可知,反应的ΔH=正反应的活化能-逆反应的活化能,故反应①的ΔH=E1-E2,故 A正确;
B. 反应物的总能量大于生成物的总能量时,反应为放热反应,由图像可知,反应①②均是放热反应,故B正确;
C. 由盖斯定律可知,H2g+2IClg=I2g+2HClgΔH=ΔH1+ΔH2=-218kJ⋅ml-1,故 C正确;
D. 反应的反应速率主要取决于慢反应,活化能越大,反应的速率越慢,故该反应的反应速率主要取决于①的快慢,故D错误。
答案为:D。
8.【答案】C
【解析】Ⅰ中发生反应 S2O32-+2H+=S↓+SO2↑+H2O ,二氧化硫进入Ⅱ中使品红溶液褪色,二氧化硫进入Ⅲ中与硫化钠反应生成S沉淀,二氧化硫进入Ⅳ中与氢氧化钠反应使溶液碱性减弱,酚酞褪色。
A.Ⅰ中试管内发生反应 S2O32-+2H+=S↓+SO2↑+H2O ,氢元素化合价不变, H+ 不体现氧化性,故A错误;
B.Ⅱ中品红溶液褪色,体现SO2的漂白性,故B错误;
C.Ⅰ试管内发生反应 S2O32-+2H+=S↓+SO2↑+H2O ,Ⅲ试管内发生反应 2S2-+SO2+2H2O=3S↓+4OH-,Ⅰ和Ⅲ的试管中都出现了浑浊现象,故C正确;
D.撤掉水浴,重做实验,反应速率减慢,Ⅳ中红色褪去的速率减慢,故D错误;
故选C。
9.【答案】D
【解析】【详解】A.探究反应“2Fe3++2I-⇌2Fe2++I2”为可逆反应,则实验ⅰ所得溶液可能含有Fe3+、I-、Fe2+、I2,所以实验ii中加入AgNO3溶液产生黄色沉淀的离子方程式为:Ag++I-=AgI↓,A正确;
B.淀粉遇I2会变蓝,则实验iii加淀粉溶液变蓝,可以证明棕黄色溶液中有I2生成,B正确;
C.生成的I2可能是I-被空气中氧气氧化,也可能是I-被Fe3+氧化所致,则设计实验iv的目的是为了排除空气中氧气氧化I-的可能,C正确;
D.实验ⅰ中I-和Fe3+等物质的量混合,实验ⅲ、ⅳ说明生成的I2是I-被Fe3+氧化所致,实验ii说明棕黄色溶液中存在I-,但不能确定存在的I-是反应物不能完全转化、反应存在限度所致,还是完全转化生成的I2与水反应(I2+H2O⇌HI+HIO)生成的,则通过上述实验不能证明“2Fe3++2I-⇌2Fe2++I2”为可逆反应,D错误;
故选D。
10.【答案】C
【解析】A.①②均为放热反应,ΔH1<0,ΔH2<0,碳完全燃烧生成二氧化碳比碳不完全燃烧生成一氧化碳放出热量多,对应ΔH小,所以a
C.方程式①-②-12×③=④,则K4=K1÷K2÷K 312=K1K2⋅K 312,C错误;
D.由C选项分析K4=K1K2⋅K 312,整理得K3=K12K22⋅K42,D正确;
故答案选C。
11.【答案】B
【解析】【分析】
本题考查元素周期律及元素周期表的推断,为高频考点,把握元素的位置、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,试题难度不大。
【解答】
从题图所给结构式中各原子间成键的数目出发,
可推知Y、Z、W原子最外层电子数分别为4、6、7,再结合题干所给信息推断即可。
A项,X为H,则Y、Z、W都位于第二周期,且Y原子最外层有4个电子,则为C,Z原子最外层有6个电子,
则为O,W原子最外层有7个电子,则为F,因此E为Cl,所以XEZ4为HClO4,为强酸,正确;
B项,一般电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,
原子半径越小,因此原子半径:E(Cl)>Y(C)>W(F),错误;
C项,同周期主族元素从左往右非金属性逐渐增强,因此非金属性:W(F)>Z(O)>Y(C),正确;
D项,ZW2为OF2,其中F的非金属性更强,则F为-1价,O为+2价,正确。
方法技巧 熟练掌握元素周期表的结构,准确推断出各元素是解题的关键。而推断元素时利用了原子结构与原子成键数目间的关系,根据价键理论,非金属元素原子能获得几个电子达到2电子或8电子稳定结构,该原子就能形成几个共价键,根据成键数就可以判断元素的主族序数。
12.【答案】B
【解析】略
13.【答案】B
【解析】A.向VOSO4溶液中滴加酸性KMnO4溶液,溶液由蓝色变为淡黄色,说明酸性环境下高锰酸根将VO2+氧化为 VO2+ ,高锰酸根被还原成Mn2+,由电子守恒可知存在KMnO4 ∼ 5VOSO4 ∼ 5e-,则①中氧化剂与还原剂物质的量之比为1:5,A项错误;
B.向(VO2)2SO4溶液中滴加浓盐酸,产生黄绿色气体,溶液变蓝,说明浓盐酸能把 VO2+ 还原为VO2+,Cl-失去电子生成氯气,由电子、电荷及原子守恒可知离子方程式为:2VO2+ +4H++2Cl-= 2VO2++Cl2↑+2H2O,标准状况下11.2L气体为0.5ml,故转移1ml电子,B项正确;
C.氧化剂的氧化性大于氧化产物的氧化性,则由①可知,氧化性: MnO 4->VO2+ ,由②可知,氧化性:VO2+>Cl2,所以酸性条件下氧化性MnO 4->VO2+>Cl2,C项错误;
D. VO2+ 具有较强的氧化性,(VO2)2SO4溶液中滴加FeI2会发生氧化还原反应,则VO2+被还原为VO2+,Fe2+被氧化为Fe3+,I-被氧化为I2,D项错误;
故选B。
14.【答案】A
【解析】【分析】
本题考查了化学反应原理部分知识,涉及到盖斯定律的应用,化学平衡常数的计算,化学平衡的移动,均为高频考点,解题关键是掌握化学反应原理知识的应用,题目难度中等,侧重于学生的分析能力和应用能力的考查。
【解答】
A.起始n(CO2):n(H2)=1:3投料,只发生反应I时,CO2、H2转化率相同,发生反应II时,H2的平衡转化率小于CO2的转化率,当I、II都发生时,则H2的平衡转化率小于CO2的转化率,故A正确;
B.反应Ⅰ是放热反应,温度升高,平衡都会逆向移动,从而使CH3OH的产量变少,故n不代表甲醇,故B错误;
C.反应Ⅰ是放热反应,反应Ⅱ是吸热反应,270~400℃时,平衡移动的程度:反应Ⅰ<反应Ⅱ,故C错误;
D.催化剂只能改变反应速率不能改变CH3OH的平衡转化率,故D错误;
故选:A。
15.【答案】(1)0.075ml⋅L-1⋅min-1
(2)<
(3) -262.7 温度 >
(4)当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小
(5) d CH3OCH3-12e-+3H2O=2CO2+12H+
【解析】【详解】(1)根据题给数据,CO的反应量为1.2ml/L×50%=0.6ml/L,则8min内CO的平均反应速率为:v(H2)=0.6ml/L8min=0.075ml⋅L-1⋅min-1;
(2)该时刻反应的浓度熵为:Qc=c(CH3OCH3)⋅c(H2O)c2(CH3OH)=2.0×>400,反应逆向进行,所以,v正
②根据催化反应室的总反应放热,化学方程式3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ΔH=-262.7kJ·ml-1可知,正向反应气体减少,反应放热,所以CO的平衡转化率α(CO)随温度的升高而减小、随压强的增大而增大,图中曲线随X增大而减小,可判断X是温度,则L1、L2是压强,且L1>L2;
(4)结合图象,根据平衡移动原理分析:随着n(H2)n(CO)增大,反应①CO转化率增大,甲醇的产率增大,进而有利于反应②正向移动;另一方面,随着n(H2)n(CO)增大,反应③被抑制,c(H2O)增大,进而抑制了反应②;图中二甲醚产率随着n(H2)n(CO)增大先增大后减小的原因就是这两种因素共同作用的结果,题给图中投料比大于1.0之后二甲醚产率和甲醇产率变化的原因可解释为:当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小。
(5)①根据图中电子的移动方向可知,d是正极;
②根据图中电子的移动方向可知,c是负极,电解质环境为酸性,则其电极反应为:CH3OCH3-12e-+3H2O=2CO2+12H+。
16.【答案】I. <;<
II. (1) 5H2C2O4 + 2MnO4- +6H+ =2Mn2+ +10CO2↑+8H2O
(2) 其他条件相同时,溶液酸性越强,反应速率越快
(3) 再加入10滴3ml/L的硫酸,然后再加少量MnSO4固体(其他合理答案也可)
(4) 不合理; KMnO4浓度不同,溶液开始时颜色深浅不同,无法通过比较褪色时间长短判断反应速率的快慢。
【解析】【分析】
本题考查化学反应速率,为高频考点,把握速率的影响因素、控制变量法、速率图像分析为解答关键,侧重分析与实验能力的考查,注意 II.(4)为解答的难点,题目难度较难。
【解答】
I. 根据“先拐先平”原则,可知温度T2>T1,温度越高速率越快,所以T2时的速率大于T1时的速率;
Ⅱ.(1)高锰酸钾与草酸反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(2)实验Ⅰ、Ⅱ酸的浓度不同,实验II酸浓度大,反应快,故由实验Ⅰ、Ⅱ可得出的结论是:其他条件相同时,H+(或硫酸)浓度越大,反应速率越快;
(3)该反应中生成的Mn2+对反应有催化作用,故设计实验加入MnSO4固体与实验II对比,其他条件与实验II相同,故实验Ⅲ的操作:向试管中先加入1 mL 0.01 ml/L酸性 KMnO4溶液,再加入10滴3 ml/L硫酸,然后加入少量MnSO4固体,最后加入1 mL 0.1 ml/L草酸溶液,可以观察到:加入草酸溶液后,溶液紫色迅速变浅(或溶液颜色开始变浅的时间小于80 s),可证明;
(4)图中探究的是KMnO4溶液浓度对反应速率的影响,但KMnO4溶液浓度不同,溶液起始颜色深浅不同,无法通过比较褪色时间长短判断反应快慢,故该方案不合理。
17.【答案】(1)增大反应物的接触面积,增大反应速率,提高浸出率 ZnO+2NH3▪H2O+2NH4+=ZnNH342++3H2O
(2)2NH3⋅H2O+AsO33-+S2O82-=AsO43-+2SO42-+2NH4++H2O
(3)CuS
(4)ZnSO4⋅Zn(OH)2+ 2HCO3-=2ZnCO3+SO42-+2H2O
(5) 94.6 b
【解析】【分析】锌焙砂(主要成分为ZnO,含有少量CuO、As2O3、NiO等)中加入(NH4)2SO4溶液和氨水,得到的浸出液中含有ZnNH342+、AsO33-、CuNH342+等,再依次加入(NH4)2S2O8溶液、CaO、FeSO4,将AsO33-氧化为AsO43-,过滤得到FeAsO4、Fe(OH)2、Fe(OH)3;滤液中加入BaS溶液除去重金属,过滤得滤渣II,滤液中加入Zn粉深度除金属得到含Ni、Zn的滤渣III,滤液蒸氨后再向其中加入NH4HCO3溶液和通入CO2将[Zn(NH3)4]2+转化为ZnCO3沉淀,烘干后煅烧,得到ZnO,以此解答。
【详解】(1)①“浸出”前,锌焙砂预先粉碎的目的是:增大反应物的接触面积,增大反应速率,提高浸出率;
②通过“浸出”步骤,锌焙砂中的ZnO转化为ZnNH342+,该反应的离子方程式为:ZnO+2NH3⋅H2O+2NH4+=ZnNH342++3H2O。
(2)“浸出”时As2O3转化为AsO33-,由分析可知,AsO33-和(NH4)2S2O8发生氧化还原反应生成AsO43-和SO42-,根据得失电子守恒和电荷守恒配平离子方程式为:2NH3⋅H2O+AsO33-+S2O82-=AsO43-+2SO42-+2NH4++H2O。
(3)除砷后溶液中还存在硫酸根、Cu2+、Ni2+、Zn2+等,其中Ni2+在深度除金属离子中除去,则“除重金属”时,加入BaS溶液可以将Cu2+除去,滤渣Ⅱ中含有的主要物质是CuS和BaSO4。
(4)“沉锌”步骤①中加入足量NH4HCO3溶液将白色固体ZnSO4⋅Zn(OH)2转化为ZnCO3的离子方程式为:ZnSO4⋅Zn(OH)2+ 2HCO3-=2ZnCO3+SO42-+2H2O。
(5)①ZnCO3加热时发生分解ZnCO3Δ ZnO+CO2↑,设加热前ZnCO3的质量为ag,300min后固体失重质量分数为33.3%,则生成CO2的质量为0.333ag,ZnCO3分解的质量为0.333a44×125g,则ZnCO3的分解率为0.333a44×125gag×100%=94.6%;
②由图1可知,恒温300℃和恒温550℃时,失重质量分数相等,由①可知ZnCO3分解率>95%,由图2可知,恒温550℃时,ZnO比表面积<40m2⋅g-1,则应该选择恒温300℃,240∼300min,故选b。
18.【答案】(1)+247kJ/ml
(2)bd
(3) Y 反应Ⅰ为放热反应,反应Ⅱ为吸热反应,温度较低时,以反应Ⅰ为主,随温度升高,反应Ⅱ变为主反应
(4)a点反应达到平衡后,温度升高,反应向逆向移动,转化率降低;a点反应达到平衡后,催化剂不影响平衡移动
【解析】【详解】(1)由盖斯定律可知,-Ⅰ+2×Ⅱ可得反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g) ΔH=-(-165kJ⋅ml-1)+2×41kJ⋅ml-1=+247kJ/ml;
(2)a.相同时间内,每断裂2ml C=O的同时形成4ml C-H,均表达的正速率,不能说明正逆反应速率相等,不能说明反应达到平衡,故a不选;
b.水蒸气的浓度不再改变,说明组分的浓度保持不变,能说明反应达到平衡状态,故b选;
c.恒温恒容条件下,该反应过程中气体总质量和总体积都不变,气体的密度是定值,当气体密度不再变化时,不能说明反应达到平衡,故c不选;
d.氢气为反应物,甲烷为生成物,n(H2):n(CH4)之比不再改变,说明各物质的物质的量不变,组成固定,能说明反应达到平衡状态,故d选;
故答案为:bd;
(3)①反应Ⅰ的正反应是放热反应,升高温度,平衡逆向移动,甲烷的选择性降低,所以甲烷的选择性随温度的变化曲线是Y;反应Ⅰ的正反应是放热反应,升高温度,平衡逆向移动,二氧化碳的转化率降低,反应Ⅱ的正反应是吸热反应,升高温度,平衡正向移动,二氧化碳的转化率增大,温度低于530℃时,以反应Ⅰ为主,当温度高于530℃后,反应Ⅱ变为主反应,所以二氧化碳的转化率随温度升高先降低后增大;
②500℃时,二氧化碳的转化率为60%,则反应的二氧化碳为0.6ml,甲烷的选择性为85%,则生成甲烷的二氧化碳为0.6ml×85%=0.51ml,则反应Ⅰ生成的甲烷为0.51ml,水蒸气为1.02ml,消耗的氢气为2.04ml,消耗的二氧化碳为0.51ml,则反应Ⅱ消耗的二氧化碳为0.09ml,消耗的氢气为0.09ml,生成的水蒸气为0.09ml,则平衡时CO2为1ml-0.6ml=0.40ml,H2为4ml-2.04ml-0.09ml=1.87ml,CH4为0.51ml,H2O为1.02ml+0.09ml=1.11ml,反应Ⅰ的平衡常数K=;
(4)a点反应达到平衡后,温度升高,反应向逆向移动,转化率降低;a点反应达到平衡后,催化剂不影响平衡移动,所以曲线变为一致。
15.(除标注外每空2分,共15分)
(1)_______________
(2)_____(填“>”“<”或“=”)
(3) ①__________ ②__________1分; __________(填“>”“<”或“=)。
(4)___________________________________________________________。3分
(5)①_____(填“c”或“d”)1分。
②_________________________。
16.实验题(除标注外每空2分,共14分)
Ⅰ.____(填“>”、“<”或“=”,下同)____。
Ⅱ.(1)_______________________________________________。
(2)_________________________________________________。
(3)_____________________________________________________________________。
(4)______(填“合理”或“不合理”),理由是________________________________________________________________________。
17.简答题 (除标注外每空2分,共16分)
(1)①____________________________________________________________________。
②_______________________________________________________________________。
(2)_________________________________________________________。3分
(3)__________。
(4)_______________________________________________________________________。
(5)①__________%(保留到小数点后一位,3分)。
②__________(填字母序号)。
18.(除标注外每空2分,共13分)
(1)___________________。
(2)__________(填序号)。
(3)①____(填“X”或“Y”);___________________________________________________。
②___________________(写出计算式即可,3分)。
(4)________________________________________________________________________。
A.九霄环佩木古琴
B.裴李岗文化骨笛
C.商朝后期陶埙
D.曾侯乙青铜编钟
实验
起始时各物质的浓度/(ml·L-1)
平衡时物质的浓度/(ml·L-1)
c(H2)
c(I2)
c(HI)
c(H2)
Ⅰ
0.01
0.01
0
0.008
Ⅱ
0.02
0.02
0
a
Ⅲ
0.02
0.02
0.04
物质
CH3OH
CH3OCH3
H2O
c/ml⋅L-1
0.05
2.0
2.0
编号
实验操作
实验现象
I
向一支试管中先加入1 mL 0.01 ml/L酸性KMnO4溶液,再加入1滴3 ml/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 ml/L草酸溶液
前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色
II
向另一支试管中先加入1 mL 0.01 ml/L酸性KMnO4溶液,再加入10滴3 ml/L硫酸,最后加入1 mL 0.1 ml/L草酸溶液
80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色
山西省长治学院附属太行中学校2024-2025学年高二上学期第一次月考 化学试题: 这是一份山西省长治学院附属太行中学校2024-2025学年高二上学期第一次月考 化学试题,共25页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
山西省大同市阳高县第四中学校2024-2025学年高二上学期第一次月考化学试题: 这是一份山西省大同市阳高县第四中学校2024-2025学年高二上学期第一次月考化学试题,文件包含山西省大同市阳高县第四中学2024-2025学年高二上学期第一次月考化学试题docx、高二化学答案docx等2份试卷配套教学资源,其中试卷共3页, 欢迎下载使用。
天津北京师范大学静海附属学校2024-2025学年高二上学期第一次月考 化学试题: 这是一份天津北京师范大学静海附属学校2024-2025学年高二上学期第一次月考 化学试题,文件包含2024年10月9日高二化学2024-2025第一次评估docx、答案2024年10月9日高二化学2024-2025第一次评估docx等2份试卷配套教学资源,其中试卷共5页, 欢迎下载使用。












