



知识清单18 原电池 化学电源(含答案) 2025年高考化学一轮复习知识清单
展开这是一份知识清单18 原电池 化学电源(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单18原电池化学电源教师版2025年高考化学一轮复习知识清单docx、知识清单18原电池化学电源学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。
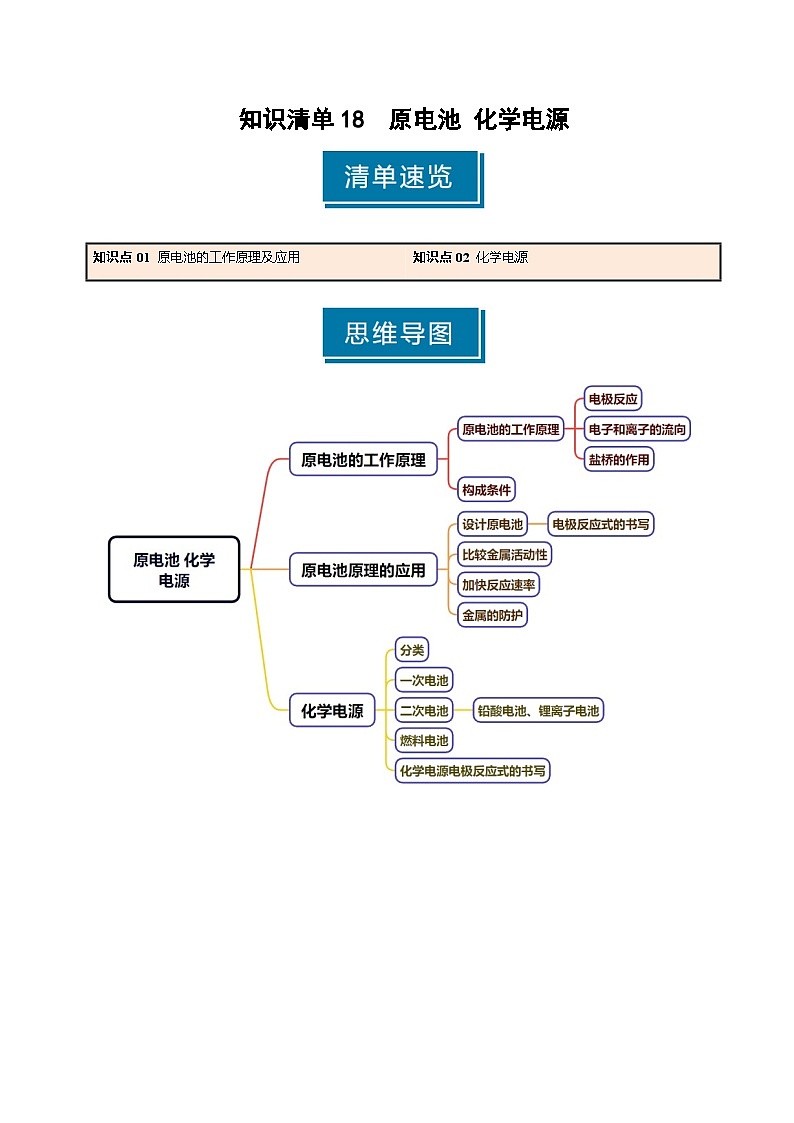
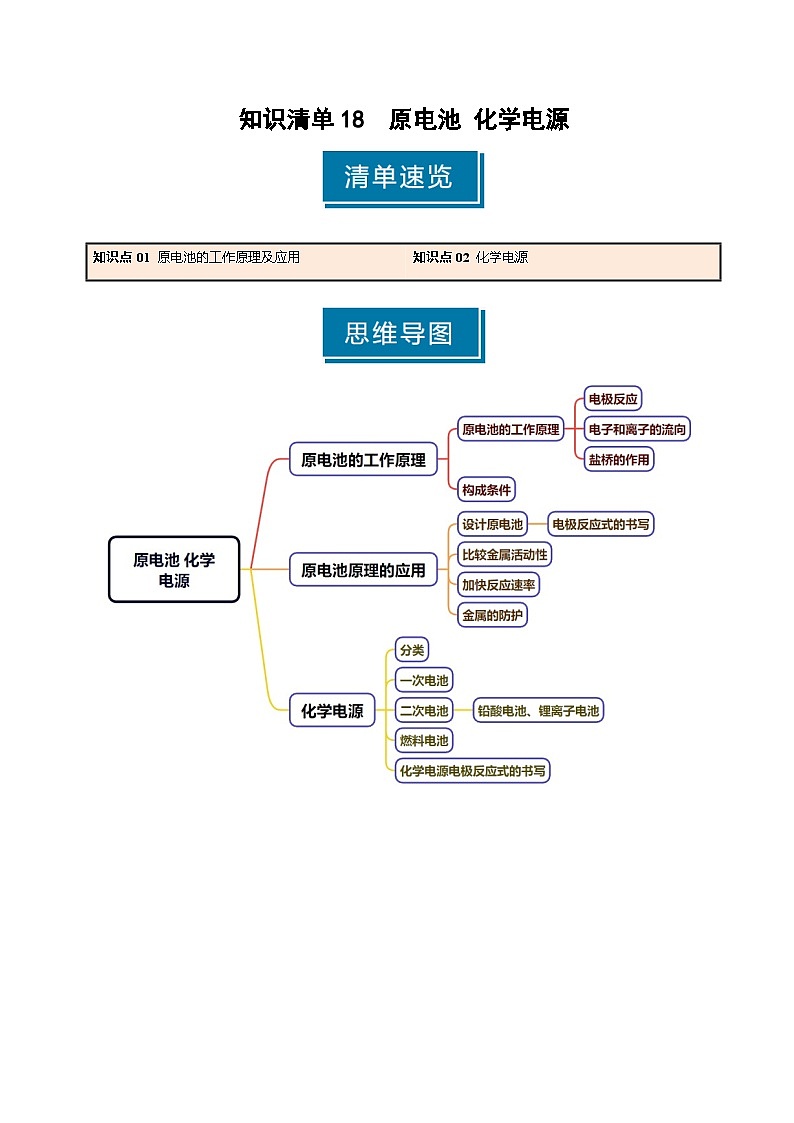
知识点01 原电池的工作原理及应用
1.原电池的概念和实质
(1)概念:将_______能转化为_______能的装置。
(2)实质:利用能______________的氧化还原反应把_______能转化为_______能。
2.原电池的工作原理
(1)电极反应:
负极:_______电子,发生_______反应
正极:_______电子,发生_______反应
(2)电子移动方向:从_______极流出沿导线流入_______极,电子_______通过电解质溶液。
(3)离子移动方向:
①阴离子向_______极移动,阳离子向_______极移动。
②如果有盐桥:盐桥中的阴离子移向_______区,阳离子移向_______区。
(4)盐桥的作用:
①离子通道,形成______________。
②避免_____________________直接反应,减少电流的衰减。
3.原电池的构成条件
①形成______________;
②两个_______不同的电极,相对较活泼的金属作_______极;
③电解质溶液或熔融电解质;
④_______的氧化还原反应(一般能对外界_______能量)。
【易错提醒】
(1)构成原电池的两电极材料不一定都是金属,正极材料可以为导电的非金属,例如石墨。两极材料可能参与反应,也可能不参与反应。
(2)两个活泼性不同的金属电极用导线连接,共同插入电解质溶液中不一定构成原电池,必须有一个能自发进行的氧化还原反应。
(3)在判断原电池正负极时,既要考虑金属活泼性的强弱,也要考虑电解质溶液性质。如Mg-Al-HCl溶液构成的原电池中,负极为Mg;但是Mg-Al-NaOH溶液构成的原电池中,负极为Al,正极为Mg。
4.原电池原理的应用
(1)设计制作化学电源
①用双线桥分析氧化还原反应的电子转移方向和数目;
②分别写出正、负极的电极反应式(半反应式);
③根据电极反应式确定半电池的电极材料和电解质溶液:
a.电极材料:一般______________作负极,______________(或_________导体)作正极;
b.电解质溶液:负极电解液一般是负极金属对应的_________的溶液;正极电解液一般是氧化剂对应的电解质溶液。
(2)比较金属的活动性强弱
一般来说,作负极的金属的活动性_______正极金属。
如:有两种金属a和b,用导线连接后插入稀硫酸中,观察到a极溶解,b极上有气泡产生。由此可判断出a是负极、b是正极,且金属活动性:a_______b。
(3)加快化学反应速率
氧化还原反应形成原电池时,反应速率加快。在锌与稀H2SO4反应时加入少量CuSO4溶液,CuSO4与锌发生置换反应生成Cu,从而形成______________原电池,加快产生H2的速率。
(4)用于金属的防护:将需要保护的金属制品作原电池的_______而受到保护。
(1)NaOH溶液与稀硫酸的反应是自发进行的放热反应,此反应可以设计成原电池( )
(2)Mg—Al形成的原电池,Mg一定作负极( )
(3)其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( )
(4)原电池工作时,电子从负极流出经导线流入正极,然后通过溶液流回负极( )
(5)在Cu|CuSO4|Zn原电池中,正电荷定向移动的方向就是电流的方向,所以Cu2+向负极移动( )
(6)构成原电池两极的电极材料一定是活泼性不同的金属( )
(7)原电池中负极失去电子的总数一定等于正极得到电子的总数( )
(8)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路( )
一、原电池的工作原理
1.(1)由组成原电池的电极材料判断。一般是活动性较强的金属为 极,活动性较弱的金属或能导电的非金属为 极。
(2)根据电流方向或电子流动方向判断。电流由 极流向 极;电子由 极流向 极。
(3)根据原电池中电解质溶液内离子的移动方向判断。在原电池的电解质溶液内,阳离子移向 极,阴离子移向 极。
(4)根据原电池两极发生的变化来判断。原电池的 极失电子发生氧化反应,其 极得电子发生还原反应。
(5)根据现象判断。一般情况下,溶解的一极为 极,增重或有气体逸出的一极为 极。
2.有下图所示的四个装置,回答相关问题:
(1)图①中,Mg作________极。
(2)图②中,Mg作__________极,写出负极反应式:________________,正极反应式:________________,总反应的离子方程式:_____________________________。
(3)图③中,Fe作_____极,写出负极反应式:______________,正极反应式:______________________,总反应的化学方程式:________________________________________________________。
(4)图④装置能否构成原电池?________(填“能”或“否”),若能构成原电池,正极为________,电极反应式为____________________________________________(若不能构成原电池,后两问不用回答)。
3.如图是某同学设计的原电池装置:
(1)电极Ⅰ上发生________(填反应类型),作________(填电极名称)。
(2)电极Ⅱ的电极反应式为__________________________________________________。
(3)该原电池的总反应式为_______________________________________________。
(4)盐桥中装有含氯化钾饱和溶液的琼胶,其作用是___________________________________。
二、原电池原理的应用
1.根据反应2FeCl3+Cu===2FeCl2+CuCl2设计原电池,画出装置图,指出电极材料和电解质溶液,写出电极反应式:
负极:_______________________,正极:______________________。
2.用A、B、C、D、E五块金属片,进行如下实验:
(1)A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极,活动性 ;
(2)C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C,活动性 ;
(3)A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡,活动性 ;
(4)B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应,活动性 ;
(5)用惰性电极电解含B离子和E离子的溶液,E先析出,活动性 。
综上所述,这五种金属的活动性从强到弱的顺序为 。
知识点02 化学电源
1.化学电源概述
(1)化学电源的分类
原电池是各种化学电源的雏形,常分为如下三类:
①一次电池:也叫做干电池,放电后_______充电的电池。
②二次电池:又称可充电电池或蓄电池,放电后_______充电而反复使用的电池。
③燃料电池:一种连续地将______________的化学能直接转化为电能的化学电源。
(2)判断电池优劣的主要标准
①比能量:______________或______________所能输出电能的多少。
②比功率:______________或______________所能输出功率的大小。
③电池可储存时间的长短。
(3)化学电池的回收利用
使用后的废弃电池中含有大量的_______、酸和碱等有害物质,随处丢弃会对生态环境和人体健康造成危害。废弃电池要进行回收利用。
(4)化学电源的发展方向
小型化、供电方便、工作寿命长、不需要维护的电池受到人们的青睐,如镍氢电池、锂离子电池等。
2.一次电池
(1)普通锌锰干电池
①构造(如图所示):
负极:______________ 正极:______________
电解质溶液:_____________________
②工作原理:
负极:___________________________________
正极:___________________________________
总反应:Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH)
(2)碱性锌锰干电池
①构造(如图所示):
负极反应物:_______ 正极反应物:_______
电解质溶液:____________
②工作原理:
负极:_________________________________________________
正极:_________________________________________________
总反应:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2
(3)纽扣式锌银电池
总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
电解质:___________;
负极反应物:_______;电极反应:____________________________;
正极反应物:_______;电极反应:____________________________。
3.二次电池
(1)铅酸蓄电池
铅酸蓄电池是一种常见的二次电池,其放电过程表示如下:
Pb+PbO2+2H2SO4===2PbSO4+2H2O
①放电反应原理
a.负极是_______,正极是_______,电解质溶液是______________。
b.电极反应:
负极:___________________________________;正极:___________________________________
c.放电过程中,负极质量的变化是_______,H2SO4溶液的浓度_______。
②充电反应原理
阴极(还原反应)反应式是__________________________________________;
阳极(氧化反应)反应式是__________________________________________ ;
充电时,铅蓄电池正极与直流电源_______相连,负极与直流电源_______相连。即“负极接_______,正极接_______”。
铅酸蓄电池的充电过程与其放电过程相反。
(2)锂离子电池
反应过程:放电时,Li+从石墨中脱嵌移向_______极,嵌入钴酸锂晶体中,充电时,Li+从钴酸锂晶体中脱嵌,由_______极回到_______极,嵌入_______中。这样在放电、充电时,锂离子往返于电池的正极、负极之间完成化学能与电能的相互转化。
3.燃料电池
(1)氢氧燃料电池是目前最成熟的燃料电池,常见的燃料除H2外,还有CO、水煤气(CO和H2)、烃类(如CH4)、醇类(如CH3OH)、醚类(如CH3OCH3)、氨(NH3)、肼(H2N—NH2)等。如无特别提示,燃料电池反应原理类似于燃料的燃烧。
(2)燃料电池的电解质常有四种类型,酸性溶液、碱性溶液、固体电解质(可传导O2-)、熔融碳酸盐,不同电解质会对总反应式、电极反应式有影响。
(3)氢氧燃料电池是目前最成熟的燃料电池,分为酸性和碱性两种。
4.化学电源电极反应式的书写
①明确两极的反应物。
②明确直接产物:根据负极氧化、正极还原,明确两极的直接产物。
③确定最终产物:根据介质环境和共存原则,找出参与的介质粒子,确定最终产物。
④配平:根据电荷守恒、原子守恒配平电极反应式。
【易错提醒】
(1)H+在碱性环境中不存在;
(2)O2-在水溶液中不存在,在酸性环境中结合H+,生成H2O,在中性或碱性环境结合H2O,生成OH-;
(3)若已知总反应式时,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得到较难写出的另一极的电极反应式。
(1)碱性锌锰干电池是一次电池,其中MnO2是催化剂,可使锌锰干电池的比能量高、可储存时间长( )
(2)可充电电池中的放电反应和充电反应互为可逆反应( )
(3)二次电池充电时,二次电池的阴极连接电源的负极,发生还原反应( )
(4)氢氧燃料电池在碱性电解质溶液中负极反应式为2H2-4e-===4H+( )
(5)燃料电池的电极不参与反应,有很强的催化活性,起导电作用( )
(6)铅酸蓄电池放电时,正极与负极质量均增加( )
(7)铅酸蓄电池放电时的负极和充电时的阳极均发生还原反应( )
(8)燃料电池工作时燃料在电池中燃烧,然后热能转化为电能( )
(9)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )
(10)手机、电脑中使用的锂电池属于一次电池( )
(11)若使反应Fe+2Fe3+===3Fe2+以原电池方式进行,可用锌铁作电极材料( )
1.以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法。
(1)酸性条件
总反应式: ;
正极反应式: ;
负极反应式: 。
(2)碱性条件
总反应式: ;
正极反应式: ;
负极反应式: 。
(3)固体电解质(高温下能传导O2-)
总反应式: ;
正极反应式: ;
负极反应式: 。
(4)熔融碳酸盐(如熔融K2CO3)环境下
总反应式: ;
正极反应式: ;
负极反应式: 。
2.锂锰电池的体积小,性能优良,是常用的一次电池。该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移进入MnO2晶格中,生成LiMnO2。回答下列问题:
(1)外电路的电流方向是由________(填“a”或“b”,下同)极流向________极。
(2)电池的正极反应式为_____________________________________。
3.利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为_____________________________________。
4.(1)近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为____________。
(2)氢气是一种理想的清洁能源,其制取与储存是氢能源利用领域的研究热点。有一种制氢方法为光电化学分解。其原理如图所示,钛酸锶光电极的电极反应为4OH--4e-eq \(=====,\s\up7(hν))O2↑+2H2O,则铂电极的电极反应为___________________。
5.(1)为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示。一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应式:___________________。
(2)熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCOeq \\al(-,3))为电解质,以丁烷为燃料,以空气中的氧气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为2C4H10+26COeq \\al(2-,3)-52e-===34CO2+10H2O。试回答下列问题:
①该燃料电池的总反应式为___________________________________________;
②正极电极反应式为_________________________________________________;
③为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是________,它来自________。
6.(1)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含SO2快速启动,其装置示意图如图:
①质子的流动方向为____________(填“从A到B”或“从B到A”)。
②负极的电极反应式为__________________________。
(2)NH3—O2燃料电池的结构如图所示:
①a极为电池的__________(填“正”或“负”)极。
②当生成1 ml N2时 ,电路中流过电子的物质的量为_______________。
知识点01 原电池的工作原理及应用
知识点02 化学电源
①不含盐桥
②含盐桥
电极
电极反应
负极
嵌锂石墨(LixCy):___________________________________
正极
钴酸锂(LiCO2):___________________________________
总反应
LixCy+Li1-xCO2===LiCO2+Cy
电池
酸性
碱性或中性
负极反应式
正极反应式
总反应式
备注
燃料电池的电极不参与反应,有很强的催化活性,起导电作用
相关学案
这是一份知识清单23 盐类的水解(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单23盐类的水解教师版2025年高考化学一轮复习知识清单docx、知识清单23盐类的水解学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共28页, 欢迎下载使用。
这是一份知识清单21 电离平衡(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单21电离平衡教师版2025年高考化学一轮复习知识清单docx、知识清单21电离平衡学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共17页, 欢迎下载使用。
这是一份知识清单17 化学反应的热效应(含答案) 2025年高考化学一轮复习知识清单,文件包含知识清单17化学反应的热效应教师版2025年高考化学一轮复习知识清单docx、知识清单17化学反应的热效应学生版2025年高考化学一轮复习知识清单docx等2份学案配套教学资源,其中学案共29页, 欢迎下载使用。












