



新疆石河子第一中学2024-2025学年高三上学期开学考试化学试题(原卷版+解析版)
展开
这是一份新疆石河子第一中学2024-2025学年高三上学期开学考试化学试题(原卷版+解析版),文件包含新疆石河子第一中学2024-2025学年高三上学期开学考试化学试题原卷版docx、新疆石河子第一中学2024-2025学年高三上学期开学考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。
一、单项选择题(22*2=44分)
1. 化学是材料科学的基础。下列说法错误的是
A. 制造5G芯片氮化铝晶圆属于无机非金属材料
B. 制造阻燃或防火线缆的氯丁橡胶由缩聚反应合成
C. 四羊方尊是商代晚期青铜礼器,为十大传世国宝之一、制作其材质的熔点比铜的低
D. 《云林石谱》记载,“西京洛河水中出碎石,颇多青白,间有五色斑斓,采其最佳者,入铅和诸药,可烧假玉或琉璃用之”,“假玉”和“琉璃”中都含有大量的硅酸盐
【答案】B
【解析】
【详解】A.制造5G芯片的氮化铝晶圆属于非金属材料,A正确;
B.制造阻燃或防火线缆的是天然橡胶,其单体是异戊二烯,通过加聚反应制得橡胶,B错误;
C.传世国宝四羊方尊的制作材质为青铜器,合金的熔点低于纯金属的熔点,C正确;
D.“假玉”和“琉璃”含大量硅酸盐,D正确;
故选B。
2. 分类思想是研究化学的常用方法。下列物质的分类正确的是
A. 纯净物:水玻璃、干冰、液氯B. 电解质:BaSO4、NaCl、NH3·H2O、盐酸
C. 胶体:烟、淀粉溶液、果冻D. 酸性氧化物:NO2、SO3、SiO2
【答案】C
【解析】
【详解】A.水玻璃是Na2SiO3的水溶液,属于混合物,A不符合题意;
B.盐酸属于混合物,不是化合物,因此不属于电解质,也不属于非电解质,B不符合题意;
C.烟、淀粉溶液、果冻都是胶体,物质分类正确,C符合题意;
D.NO2不属于酸性氧化物,D不符合题意;
故选C。
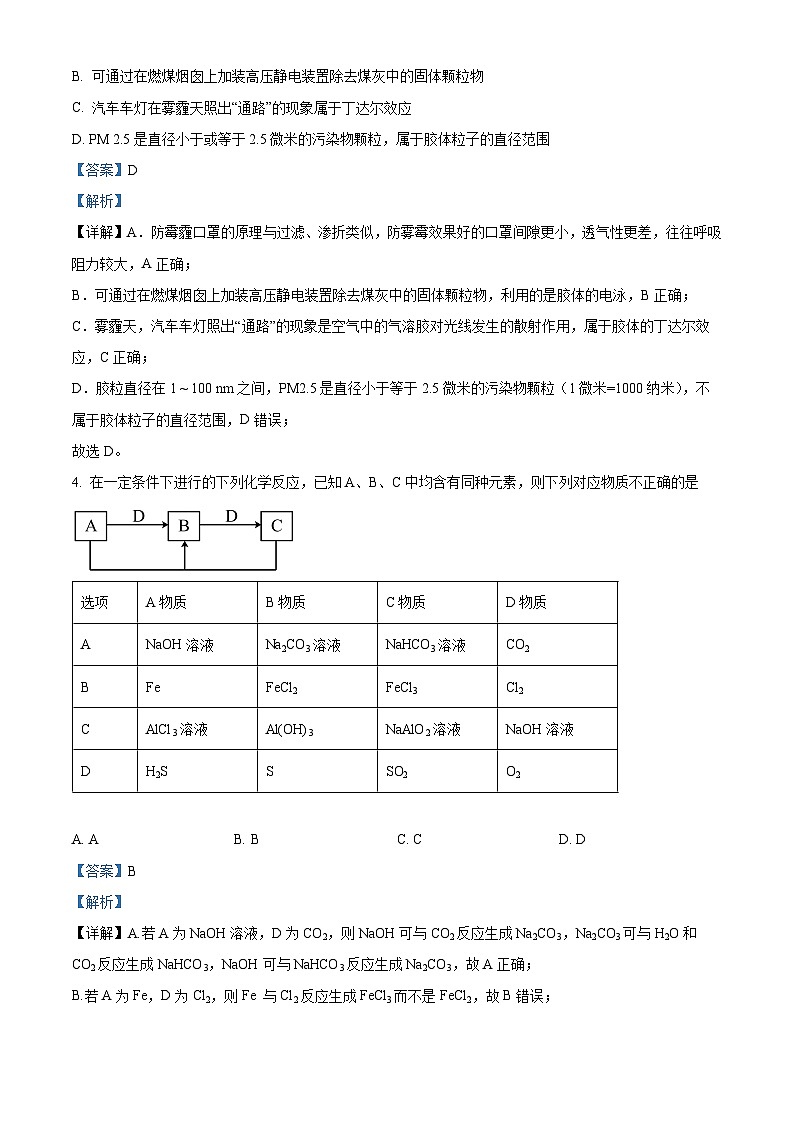
3. 空气湿度增大,水汽凝结就易形成雾,灰尘、硫酸、硝酸、有机碳氢化合物等颗粒物的浓度增大就易形成霾。下列说法不正确的是
A. 防雾霾口罩的原理与过滤类似,防雾霾效果好的口罩往往呼吸阻力较大
B. 可通过在燃煤烟囱上加装高压静电装置除去煤灰中的固体颗粒物
C. 汽车车灯在雾霾天照出“通路”的现象属于丁达尔效应
D. PM 2.5是直径小于或等于2.5微米的污染物颗粒,属于胶体粒子的直径范围
【答案】D
【解析】
【详解】A.防霉霾口罩的原理与过滤、渗折类似,防雾霉效果好的口罩间隙更小,透气性更差,往往呼吸阻力较大,A正确;
B.可通过在燃煤烟囱上加装高压静电装置除去煤灰中的固体颗粒物,利用的是胶体的电泳,B正确;
C.雾霾天,汽车车灯照出“通路”的现象是空气中的气溶胶对光线发生的散射作用,属于胶体的丁达尔效应,C正确;
D.胶粒直径在1 ~ 100 nm之间,PM2.5是直径小于等于2.5微米的污染物颗粒(1微米=1000纳米),不属于胶体粒子的直径范围,D错误;
故选D。
4. 在一定条件下进行的下列化学反应,已知A、B、C中均含有同种元素,则下列对应物质不正确的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.若A为NaOH溶液,D为CO2,则NaOH可与CO2反应生成Na2CO3,Na2CO3可与H2O和CO2反应生成NaHCO3,NaOH可与NaHCO3反应生成Na2CO3,故A正确;
B.若A为Fe,D为Cl2,则Fe 与Cl2反应生成FeCl3而不是FeCl2,故B错误;
C.若A为AlCl3溶液,D为NaOH溶液,则AlCl3可与NaOH反应生成Al(OH)3,Al(OH)3可与NaOH反应生成NaAlO2,AlCl3可与NaAlO2反应生成Al(OH)3,故C正确;
D.若A为H2S,D为O2,则H2S可与O2反应生成S,S可与O2生成SO2,H2S可与SO2生成S,故D正确;
故选:B。
5. 下列各组离子在给定溶液中能大量共存的是
A. 在氨水中:
B. 在氯化钠溶液中:
C. 在醋酸溶液中:
D. 在硝酸银溶液中:
【答案】C
【解析】
【详解】A.氨水显碱性,会与反应,不能大量共存,A项错误;
B.会发生氧化还原反应,不能大量共存,B项错误;
C.醋酸显酸性,在醋酸溶液中均不会发生反应,能大量共存,C项正确;
D.硝酸银中的银离子会与氯离子反应生成沉淀,不能大量共存,D项错误;
答案选C。
6. 能正确表示下列反应的离子方程式的是
A. 向NaClO溶液中通入少量CO2:2ClO-+CO2 +H2O=2HClO+CO
B. 向酸性KMnO4溶液中通入SO2:2MnO+5SO2+4H+=5SO+2Mn2++2H2O
C. 明矾溶液与过量氨水混合:Al3++4NH3+2H2O=AlO+4NH
D. 将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1:2混合:Ba2++2OH-+2H++SO =BaSO4↓ +2H2O
【答案】D
【解析】
【详解】A.向NaClO溶液中通入少量CO2: ,A错误;
B.向酸性KMnO4溶液中通入SO2:,B错误;
C.明矾溶液与过量氨水混合: ,C错误;
D.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1:2混合:Ba2++2OH-+2H++SO =BaSO4↓ +2H2O,D正确;
答案选D。
7. 下列离子方程式书写错误的是
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++2OH-+2=CaCO3↓+2H2O+
B. 酸性高锰酸钾溶液与稀草酸反应:5+2+16H+=2Mn2++10CO2↑+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-=Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:++2OH-NH3↑+2H2O+
【答案】B
【解析】
【详解】A.小苏打过量,计算时应以不足量的澄清石灰水为主。假设澄清石灰水溶质的物质的量为,含,消耗,反应的离子方程式为:,A正确;
B.草酸是弱电解质,其化学式不可拆,因此该反应的离子方程式为:,B错误;
C.是强电解质,在水溶液中完全电离出、,C正确;
D.反应以不足量的为主,假设其物质的量为,则、均消耗,D正确。
答案为:B。
8. 设为阿伏加德罗常数的值。下列说法正确的是
A. 1ml中含σ键数目11
B. 标准状况下,11.2L 分子个数为0.5
C. 0.1的溶液,含Cr元素微粒浓度之和为0.1
D. 1.4g Li与足量充分反应,反应中转移的电子数介于0.2和0.4之间
【答案】A
【解析】
【详解】A.NH3中含有3个N—H键,中含有3个N=O键,NH3与Ag+间有2个配位键,因此1ml中含σ键数目为11,A正确;
B.分子中存在平衡状态,标准状况下,11.2L分子个数少于,B错误;
C.溶液存在平衡状态,溶液中含Cr元素微粒浓度之和介于,C错误;
D.Li与O2反应生成Li2O,与足量O2充分反应,转移的电子数为,D错误;
故选A。
9. 设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 100 g质量分数为17%的H2O2溶液中极性键数目为NA
B. 标准状况下,11.2 L O2参与反应转移的电子数一定为2 NA
C. 标准状况下,11.2 L一氯甲烷中含有的氯原子数为0.5 NA
D. 常温下,1 L0.1 ml·L-1 Na2C2O4溶液中含C2O数目为0.1 NA
【答案】C
【解析】
【详解】A.选项有文字陷阱,溶液中极性键,那就包括溶剂水分子中所含极性键,故数目肯定不是NA,描述错误,不符题意;
B.O2反应生成Na2O2,氧元素由0价变为-1价,转移电子数目不是选项对应计算数据,描述错误,不符题意;
C.一氯甲烷常压下沸点-23.7℃,标况下为气态,所以Cl原子的物质的量是,描述正确,符合题意;
D.是弱电解质H2C2O4对应阴离子,在水溶液中会发生水解,故其离子数量无法简单计算,描述错误,不符题意;
综上,本题选C。
10. 是一种高效水处理剂,可用稀盐酸和为原料制备,反应原理如下:。下列判断正确的是
A. 是还原产物B. HCl发生氧化反应
C. n(氧化剂):n(还原剂)=5:4D. 生成10mlNaCl,转移8ml电子
【答案】D
【解析】
【详解】A.根据反应方程式,NaClO2→ClO2:Cl元素化合价由+3价变为+4价,化合价升高,因此ClO2为氧化产物,故A错误;
B.同种元素不同价态参与氧化还原反应,向中价价态靠拢,不能出现交叉,NaClO2既是氧化剂又是还原剂,HCl只表现酸性,故B错误;
C.根据元素守恒可知,氧化反应:4NaClO2→4ClO2,还原反应:NaClO2→Cl-,氧化剂、还原剂物质的量之比为1∶4,故C错误;
D.根据分析,生成5mlNaCl时转移电子物质的量为4ml,因此生成10mlNaCl时转移电子物质的量为8ml,故D正确;
答案为D。
11. 已知三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,③2KMnO4+16HCl(浓)= 2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是
A. Cl2B. KMnO4C. FeCl3D. HCl
【答案】C
【解析】
【分析】
【详解】根据同一氧化还原反应中,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物;则由题给方程式得出,氧化性由强至弱的顺序为: >Cl2>Fe3+>I2,还原性由强至弱的顺序为I->Fe2+>Cl->Mn2+;
A.氯气能将Fe2+、I-均氧化,故A不符合题意;
B.KMnO4能将Fe2+、I-和Cl-均氧化,故B不符合题意;
C.FeCl3能氧化除去I-而不氧化Fe2+和Cl-,故C符合题意;
D.HCl与三种离子均不反应,故D不符合题意;
故答案为C。
12. 工业上以铜阳极泥(主要成分是)为原料提取碲,涉及反应:
①,
②。
以下说法正确的是
A. 中元素的化合价是价
B. 反应①中氧化剂是,氧化产物是
C. 每制备理论上共转移
D. 氧化性强弱顺序为:
【答案】C
【解析】
【详解】A.Cu2Te中Cu为+1,A错误;
B.反应①中O2得电子为氧化剂,Cu2Te中Cu和Te均失去电子,则CuSO4也是氧化产物,B错误;
C.反应②中每生成1mlTe,转移4ml电子,反应①中每生成1mlTeO2,转移8ml电子,则每制备1mlTe,理论上共转移12ml电子,C正确;
D.氧化剂的氧化性强于氧化产物,根据两个反应无法比较O2和SO2的氧化性强弱,且无法证明SO2氧化性强于TeO2,只能证明O2氧化性强于TeO2,D错误;
故答案选C。
13. 把图2中的物质补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。
对该氧化还原反应的离子方程式,下列说法不正确的是
A. 是氧化剂,具有氧化性B. 氧化性:MnO>
C. 氧化剂和还原剂的微粒个数之比为5∶2D. 若有2个Mn2+参加反应,则转移10个电子
【答案】B
【解析】
【分析】已知锰离子是反应物,反应后生成高锰酸根离子,则锰离子失电子作还原剂,含有碘元素的离子在反应中作氧化剂,碘元素应该得电子化合价降低,所以是反应物,是生成物,根据元素守恒知,水是反应物,根据氧化还原反应中化合价升降数值相等以及原子守恒知识,可以得出该反应方程式为:2Mn2++5+3H2O=2MnO+5+6H+。
【详解】A.中的碘元素在反应中化合价降低,得电子,作氧化剂,具有氧化性,故A正确;
B.根据反应方程式可知,该反应的氧化剂是,氧化产物是MnO,根据氧化剂的氧化性大于氧化产物的氧化性,则氧化性强弱顺序是:>MnO,故B错误;
C.根据方程式可知:氧化剂碘酸根离子和还原剂锰离子的物质的量之比为5:2,故C正确;
D.根据反应方程式可知,有2个 Mn2+参加反应时,转移电子的物质的量是:2×(7-2)=10个,故D正确;
故答案选B。
14. 已知反应:①;
②(未配平)
下列有关说法正确的是
A. 方程式①中为
B. 还原性强弱:
C. ,
D. 反应不能发生
【答案】B
【解析】
【详解】A.根据原子守恒并结合离子方程式两边离子所带电荷总数相等可知,反应①为SO2+2Fe3++2H2O=SO +2Fe2++4H+,W为4H+,A错误;
B.还原剂的还原性强于还原产物,由反应①可知,还原性:SO2>Fe2+,B正确;
C.反应②中,Cr元素的化合价由+6降到+3,Fe元素化合价由+2升高到+3,根据得失电子守恒可得,Cr2O 和Cr3+对应的化学计量数分别为1、2,Fe2+和Fe3+对应的化学计量数均为6,则a=6,再结合离子方程两边离子所带电荷总数相等可得,b=14,C错误;
D.Cr2O具有强氧化性,SO2具有还原性,且由①、②可知氧化性:Cr2O> SO,则Cr2O能将SO2氧化为SO,即反应Cr2O+3SO2+2H+=2Cr3++3 SO+H2O能发生,D错误;
故选B。
15. 在一定条件下,PbO2与Cr3+反应,产物是Pb2+和CrO3,则与1 ml Cr3+反应所需PbO2的物质的量为
A. 3.0 mlB. 1.5 mlC. 1.0 mlD. 0.75 ml
【答案】B
【解析】
【分析】
【详解】由题意可知在PbO2与Cr3+反应,产物是Pb2+和CrO3中,PbO2为氧化剂,Cr3+为还原剂,则有关系式,则,解得n=1.5ml,综上所述B符合题意,故选B。
16. 向三个密闭容器中分别充入Ne、H2、O2三种气体,下列有关这三种气体的叙述中正确的是
A. 温度、压强相同时,三中气体的密度关系:
B. 质量、温度、压强均相同时,三种气体的体积关系:
C. 温度、密度相同时,三种气体的压强关系:
D. 温度、压强、体积均相同,三种气体的质量关系:
【答案】C
【解析】
【详解】A.由PV=nRT可推知,PM=ρRT,可知温度、压强相同时,气体密度和摩尔质量成正比,则密度:,A错误;
B.由A可知,温度、压强相同时,密度:,根据公式ρ=,质量相同,则体积:H2>Ne>O2,B错误;
C.根据PM=ρRT知,温度、密度相同时,气体的压强与摩尔质量成反比,则温度、密度相同时,压强:,C正确;
D.由PV=nRT可知,温度、压强、体积均相同,气体物质的量相同,根据公式m=nM,质量:H2VO2+
(5) ①. V2O5+5C+N22VN+5CO ②. 2NA
【解析】
【小问1详解】
n(KI)=0.3L×0.2ml·L-1=0.06ml,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02ml,共失去电子的物质的量为2×0.02ml+0.02ml×[5-(-1)]=0.16ml。
【小问2详解】
Na2S2O3和KMnO4溶液发生氧化还原反应生成Na2SO4、MnSO4和H2O,根据得失电子守恒和电荷守恒配平离子方程式为:8+5+14H+=8Mn2++10+7H2O;滴定至终点时消耗n(Na2S2O3)=0.012L×0.1ml/L=0.0012ml,则该样品中KMnO4的物质的量是 n(KMnO4)= 0.0012ml×=1.92×10-3 ml。
【小问3详解】
V2O5转化为VO2+被还原,作氧化剂,V2O5整体化合价降低2价,K2SO3为还原剂被氧化为硫酸根,整体化合价升高2价,根据得失电子守恒可知氧化剂和还原剂的物质的量之比1:1。
【小问4详解】
根据题意可知V2O5可以将盐酸氧化Cl2,该过程中Cl-为还原剂,VO2+为还原产物,所以还原性Cl->VO2+;氯气可以氧化Na2SO3,该过程中为还原剂,Cl-为还原产物,所以还原性>Cl-,综上所述还原性:>Cl->VO2+。
【小问5详解】
根据题意可知高温条件下V2O5可与C、N2反应生成VN,根据元素守恒,另外一种具有还原性的气体应是CO,化学方程式为V2O5+5C+N22VN+5CO,生成标况下22.4L CO的物质的量为1ml,该反应中C元素由0价上升到+2价,则反应转电子数为2NA。
27. 完成下列填空
(1)磷能形成多种具有独特性质的物质。
①磷能形成红磷、白磷、黑磷等多种单质,它们互为_______(填“同位素”或“同素异形体”)。
②磷的一种组成为Ba(H2PO2)2的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关Ba(H2PO2)2、H3PO2的分析中正确的是_______(填字母)。
A. Ba(H2PO2)2是酸式盐 B. Ba(H2PO2)2是正盐
C.均具有较强的还原性 D. H3PO2是三元弱酸
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、、Cl—、中的4种离子,且均为1ml,向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解),则溶液中存在的阳离子是_______、阴离子是_______
(3)碳能形成多种氧化物,如CO、CO2、C2O3、C3O2已知C3O2+2H2O=CH2(COOH)2,写出将0.1mlC3O2缓慢通入到100mL1.0ml·L-1NaOH溶液中反应的化学方程式为_______,该氧化物也可与热的CuO反应,则1mlC3O2最多还原_______ml CuO。
(4)自然界中Cr主要以价和价形式存在。Cr2O中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将Cr2O还原,其离子方程式为_______。
【答案】(1) ①. 同素异形体 ②. BC
(2) ①. Na+、Fe2+ ②. NO、SO
(3) ①. C3O2+NaOH+H2O =HOOCCH2COONa ②. 4
(4)3SO+ Cr2O+8H+=3SO+2Cr3++4H2O
【解析】
【小问1详解】
①红磷、白磷、黑磷是磷元素形成的不同种单质,互为同素异形体,故答案为:同素异形体;
②由Ba(H2PO2)2能与盐酸反应但不能与氢氧化钠溶液反应,说明Ba(H2PO2)2为正盐、H3PO2为一元酸,由化合价代数和为0可知,Ba(H2PO2)2、H3PO2中磷元素为+1价,由磷元素的常见化合价为+3价、+5价可知,Ba(H2PO2)2、H3PO2均具有强还原性,故选BC;
【小问2详解】
向溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变,说明溶液中一定含有亚铁离子、硝酸根离子和硫酸根离子,则溶液中不含有钡离子;四种离子的物质的量均为1ml,则由电荷守恒可知,溶液中含有钠离子,不含有铝离子,所以溶液中含有的阳离子为钠离子、亚铁离子,阴离子为硝酸根离子、硫酸根离子,故答案为:Na+、Fe2+;NO、SO;
【小问3详解】
由题意可知,等物质的量的三氧化二碳和氢氧化钠溶液反应生成HOOCCH2COONa,反应的化学方程式为C3O2+NaOH+H2O =HOOCCH2COONa;氧化铜具有氧化性,能与三氧化二碳发生氧化还原反应生成铜和二氧化碳,反应的化学方程式为C3O2+4CuO4Cu+3CO2,则1ml三氧化二碳最多还原4ml氧化铜,故答案为:C3O2+NaOH+H2O =HOOCCH2COONa;4;
【小问4详解】
由题意可知,酸性条件下溶液中重铬酸根离子与亚硫酸根离子反应生成铬离子、硫酸根离子和水,反应的离子方程式为3SO+ Cr2O+8H+=3SO+2Cr3++4H2O,故答案为:3SO+ Cr2O+8H+=3SO+2Cr3++4H2O。选项
A物质
B物质
C物质
D物质
A
NaOH溶液
Na2CO3溶液
NaHCO3溶液
CO2
B
Fe
FeCl2
FeCl3
Cl2
C
AlCl3溶液
Al(OH)3
NaAlO2溶液
NaOH溶液
D
H2S
S
SO2
O2
选项
实验
操作
A
观察钠与水反应的现象
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中
B
检验与溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
C
证明与是放热反应
用棉花包裹,放入充满的集气瓶中,棉花燃烧说明是放热反应
D
检验与溶液
用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色
“84”消毒液
净含量:1000 mL
密度:1.19 g·cm-3
有效成分:25%NaClO
使用方法:稀释100倍(体积比)后使用
注意事项:密封保存,易吸收空气中的CO2变质
相关试卷
这是一份新疆生产建设兵团第三师五十三团中学2024-2025学年高三上学期开学分班考试化学试题(原卷版+解析版),文件包含新疆生产建设兵团第三师五十三团中学2024-2025学年高三上学期开学分班考试化学试题原卷版docx、新疆生产建设兵团第三师五十三团中学2024-2025学年高三上学期开学分班考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
这是一份云南省昆明市第三中学2024-2025学年高三上学期开学考试化学试题(原卷版+解析版),文件包含云南省昆明市第三中学2024-2025学年高三上学期开学考试化学试题原卷版docx、云南省昆明市第三中学2024-2025学年高三上学期开学考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
这是一份重庆市南开中学校2024-2025学年高一上学期开学考试化学试题(原卷版+解析版),文件包含重庆市南开中学校2024-2025学年高一上学期开学考试化学试题原卷版docx、重庆市南开中学校2024-2025学年高一上学期开学考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。









