




所属成套资源:2024--2025年高考化学一轮复习全套知识课件(新教材,新一轮)
课件 高考化学一轮复习第五单元 化工生产中重要非金属元素 第十九讲 氮及其化合物
展开
这是一份课件 高考化学一轮复习第五单元 化工生产中重要非金属元素 第十九讲 氮及其化合物,共60页。PPT课件主要包含了夯实必备知识,人工固氮,共用电子对,N2O,NO2,N2O4,N2O3,N2O5,无色无味气体,排水法等内容,欢迎下载使用。
第19讲 氮及其化合物
考点一 氮气及氮的常见氧化物考点二 硝酸考点三 氨和铵盐经典真题·明考向作业手册
夯实必备知识 | 提升关键能力
考点一 氮气及氮的常见氧化物
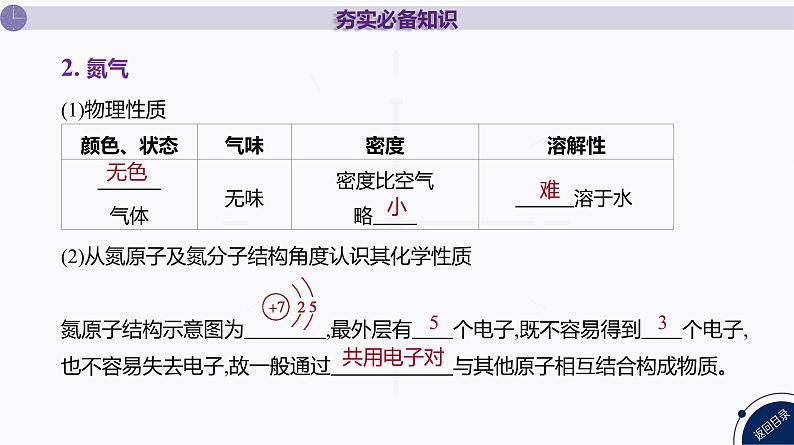
1. 氮元素及氮的固定
(1)物理性质(2)从氮原子及氮分子结构角度认识其化学性质氮原子结构示意图为 ,最外层有 个电子,既不容易得到 个电子,也不容易失去电子,故一般通过 与其他原子相互结合构成物质。
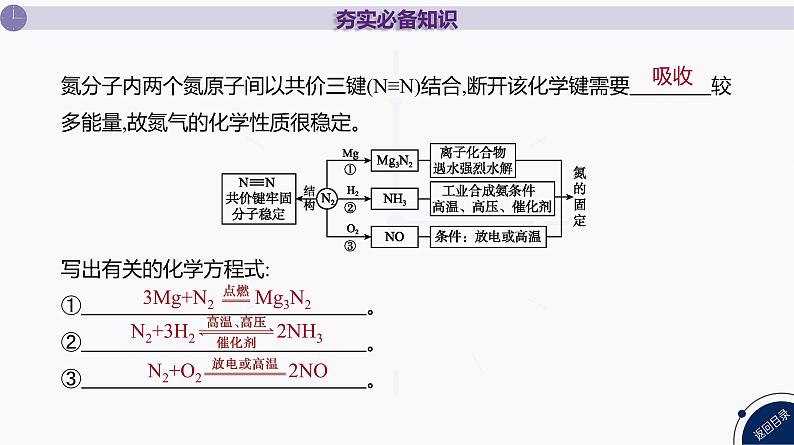
氮分子内两个氮原子间以共价三键(N≡N)结合,断开该化学键需要 较多能量,故氮气的化学性质很稳定。 写出有关的化学方程式:① 。 ② 。 ③ 。
(1)氮有多种价态的氧化物,如 、 、 、 、N2O3、N2O5等,其中属于酸性氧化物的是 、 。
3. 氮的氧化物及对环境的污染
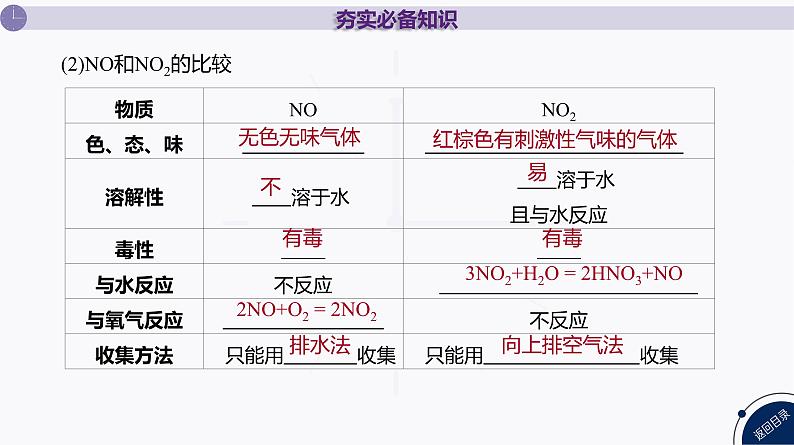
(2)NO和NO2的比较
红棕色有刺激性气味的气体
3NO2+H2O = 2HNO3+NO
2NO+O2 = 2NO2
[微点拨] ①NO2与N2O4存在下列平衡:2NO2 ⇌ N2O4,在阿伏伽德罗常数问题中,凡是涉及NO2的分子数目都要考虑该平衡的存在,故1 ml NO2中分子数小于NA。②验证某无色气体为NO的方法是向无色气体中通入O2(或空气),无色气体变为红棕色。
1.判断正误(正确的打“√”,错误的打“×”)(1)空气中N2和O2在放电条件下直接化合生成NO2( ) (2)实验室可用向上排空气法收集铜粉与稀硝酸反应产生的NO( )(3)可用NO2与水反应生成HNO3,故NO2是酸性氧化物( )
[解析] (2)NO能与空气中的O2反应生成NO2,收集NO应采用排水法。
[解析] (3)二氧化氮不是酸性氧化物,氮的氧化物中只有N2O3、N2O5为酸性氧化物。
(4)除去NO中的少量NO2气体,可通过盛有水的洗气瓶除去再干燥( )(5)密闭容器中2 ml NO与1 ml O2充分反应,产物的分子数为2NA( )
[解析] (4)二氧化氮溶于水发生反应3NO2+H2O = 2HNO3+NO,NO2可转化为NO,干燥即可得NO。
[解析] 本实验的目的是制取NaNO2。装置A中制取的气体为NO2、NO、CO2的混合气,与Na2O2反应前,需除去NO2、CO2和水蒸气;装置B的作用是除去NO2,同时提高NO的生成率;装置C的作用是除去水蒸气和CO2,防止参与后续操作中的反应;装置D用于制取NaNO2,装置E用于尾气处理。在常温下,活性炭与浓硝酸不反应,所以装置A需加热,A正确;
题组一 氮气及氮氧化物的性质
试回答:(1)仪器的连接顺序(按从左→右连接,填各接口的编号)为 。 (2)反应前应通入N2,目的是 。
1,5,4,10,11,6,7,2(10和11顺序可以颠倒)
排尽装置中空气,防止反应产生的NO被氧化
(3)装置F的作用是 。 (4)确认气体中含NO的现象是 。 (5)若通入O2过量则B中发生反应的化学方程式为 。
分离NO和NO2(或使NO2液化)
通入O2后装置D中有红棕色气体生成
4NO2+O2+4NaOH = 4NaNO3+2H2O
【归纳总结】 氮氧化物的特殊性质(1)氮的氧化物都有毒,其中NO2与N2O4存在下列平衡:2NO2 ⇌ N2O4,因此实验测得NO2的平均相对分子质量大于46。(2)NO只能用排水法收集,不能用排空气法收集;而NO2只能用向上排空气法收集,不能用排水法收集。(3)NO2既有氧化性又有还原性,以氧化性为主。NO2能使湿润的淀粉-KI试纸变蓝。
题组二 氮氧化物与O2、H2O反应的计算
3.将10 mL NO和NO2的混合气体通入装满水倒立在水槽中的量筒内,一段时间后,最后剩余4 mL气体,原混合气体中含NO体积为( )A.1 mL B.3 mL C.5 mL D.7 mL
【归纳提升】 氮氧化物(NOx)与 O2、H2O反应的有关计算(1)关系式法
(2)电子守恒法氮氧化物(NOx)转化为HNO3时失去电子,若为NOx与O2的混合气体,则反应中O2得到的电子数与NOx失去的电子数相等。
硝酸是 色、易挥发、有 气味的液体。
Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
[微点拨1] ①浓硝酸呈黄色的原因:硝酸分解生成的NO2溶解在硝酸里。消除方法:向变色浓硝酸中通氧气。②硝酸保存在棕色试剂瓶中,置于冷暗处,不能用橡胶塞。③常温下,铁、铝在浓硫酸或浓硝酸中发生钝化,故可用铝制或铁制容器盛放浓硫酸或浓硝酸。④硝酸的还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO。
1.判断正误(正确的打“√”,错误的打“×”)(1)实验室里用锌粒与稀HNO3反应制取H2( )(2)铜与浓硝酸反应生成NO2,而与稀硝酸反应生成更低价的氧化物NO,则氧化性:稀硝酸>浓硝酸( )(3)将铁屑放入稀HNO3中产生气体,发生置换反应 ( )
[解析] (2)物质的氧化性强弱与得电子多少无关,而与得电子难易程度有关。
(4)[2023·新课标全国卷] 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象,则稀硝酸的氧化性比浓硝酸强( )(5)常温下,铝遇浓硝酸或浓硫酸时会发生钝化( )(6)含有4 ml HNO3的浓硝酸与足量铜粉充分反应,理论上生成NO2的分子数为2NA( )
[解析] (4)常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象,是因为稀硝酸与铁片反应生成NO,铁片与浓硝酸发生钝化,导致现象不明显,所以不能通过该实验现象比较浓、稀硝酸的氧化性。
2.[2024·广东湛江联考] 将铜丝插入浓硝酸中进行如图所示的实验,下列说法正确的是( )A.装置a中出现红棕色气体,只体现HNO3的酸性B.一段时间后抽出铜丝,向装置b注入水,b中气体红棕色变浅C.注入水后装置b中铜片表面产生气泡,说明Cu与硝酸生成H2D.装置c用NaOH吸收尾气,说明NO和NO2均是酸性氧化物
[解析] 铜与浓硝酸反应生成红棕色气体二氧化氮和硝酸铜,体现了硝酸的强氧化性和酸性,A错误;一段时间后抽出铜丝,向装置b注入水,b中气体红棕色变浅,二氧化氮与水反应生成硝酸和一氧化氮,B正确;注入水后装置b中铜片表面产生气泡,Cu与稀硝酸反应生成NO气体,C错误;酸性氧化物是指和水反应只能生成对应价态的酸或和碱反应只生成一种盐和水的氧化物,NO和NO2均不是酸性氧化物,D错误。
1.[2024·辽宁实验中学模拟] 某学习小组采用下列装置对浓硝酸与木炭的反应进行探究。下列说法中不正确的是( )A.反应开始后,装置A中充满红棕色气体B.装置B的作用是安全瓶,防止倒吸C.装置C中溶液变蓝,一定是A中生成的NO2将KI氧化为I2D.将带火星的木条放入装置D收集到的无色气体中,可确认该气体是NO还是O2
[解析] 炽热的木条和浓硝酸反应生成二氧化碳和二氧化氮,二氧化氮为红棕色气体,则可观察到三颈烧瓶中气体的颜色为红棕色,A正确;装置B中进气管和出气管的长度相同,其作用是安全瓶,防止倒吸,B正确;装置C中溶液变蓝,但不能证明NO2将KI氧化为I2,原因是A中挥发出的HNO3(g)可能进入装置C,将KI氧化为I2而使溶液变蓝,C错误;将带火星的木条伸入集气瓶中,观察木条是否复燃,可以判断集气瓶中是NO还是O2,实验方法合适,D正确。
2.甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物。文献记载:ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其产物有+4价、+2价、-3价等氮的化合物。ⅱ.FeSO4+NO ⇌ Fe(NO)SO4(棕色) (ΔH
相关课件
这是一份课件 高考化学一轮复习第五单元 化工生产中重要非金属元素 第十七讲 硫及其化合物,共60页。PPT课件主要包含了考点一硫及其氧化物,夯实必备知识,硫化物,硫酸盐,1物理性质,二氧化硫,氧化性,还原性,漂白性,石油和煤等内容,欢迎下载使用。
这是一份课件 高考化学一轮复习第五单元 化工生产中重要非金属元素 第十五讲 氯及其化合物,共60页。PPT课件主要包含了使用建议,教学建议,夯实必备知识,氯气的物理性质,第三周期第ⅦA族,1氧化性,氯的重要化合物,HOCl,2漂白粉,CaClO2等内容,欢迎下载使用。
这是一份PPT课件 高考化学一轮复习第五单元化工生产中重要非金属元素 第十九讲 氮及其化合物,共60页。PPT课件主要包含了夯实必备知识,人工固氮,共用电子对,N2O,NO2,N2O4,N2O3,N2O5,无色无味气体,排水法等内容,欢迎下载使用。










