

贵州省2024届高三下学期二模化学试卷(含答案)
展开
这是一份贵州省2024届高三下学期二模化学试卷(含答案),共22页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.下列科技成就所涉及的化学知识说法错误的是( )
A.C919国产大飞机使用的环氧树脂是有机高分子材料
B.国产大型邮轮使用阻燃材质中的碱式碳酸镁矿物是无机材料
C.“神舟”飞船轨道舱太阳能电池装置能将太阳能转化为电能
D.“奋斗者”号极限深潜载人舱使用的高强度钛合金为纯净物
2.物质的性质决定应用。下列对应关系错误的是( )
A.二氧化硫有漂白性,可用于葡萄酒的抗氧化
B.活性炭有吸附性,可用于室内空气净化
C.生石灰有吸水性,可用于食品干燥
D.二氧化氯有氧化性,可用于自来水消毒
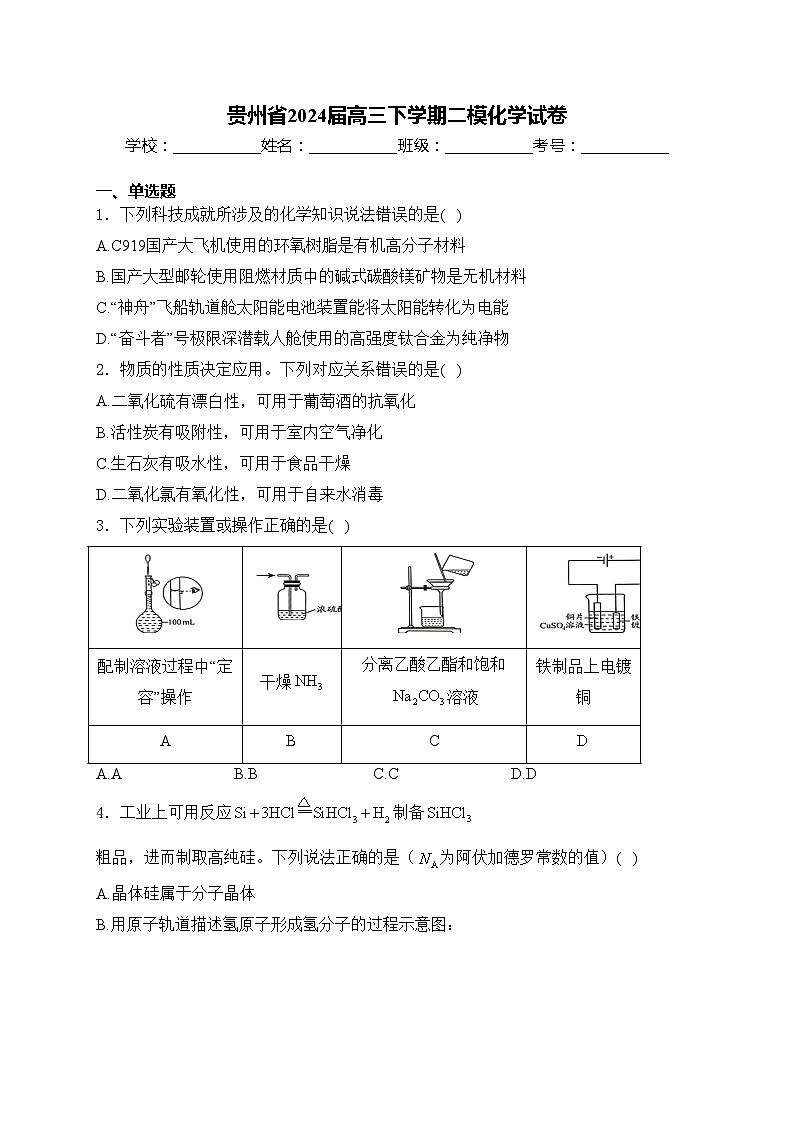
3.下列实验装置或操作正确的是( )
A.AB.BC.CD.D
4.工业上可用反应制备粗品,进而制取高纯硅。下列说法正确的是(为阿伏加德罗常数的值)( )
A.晶体硅属于分子晶体
B.用原子轨道描述氢原子形成氢分子的过程示意图:
C.中含有分子的数目为
D.每生成转移电子数目为
5.下列有关方程式错误的是( )
A.加入水中生成沉淀:
B.硫代硫酸钠与稀硫酸反应:
C.向碳酸钠溶液中滴加少量的稀盐酸:
D.将通入水中:
6.利用如图所示的装置(夹持及加热装置略)进行实验,将a中反应的产物通入b中,不能出现相关实验现象的是( )
A.AB.BC.CD.D
7.聚酯A可用于制造涂料。其制备反应如图所示:
下列说法错误的是( )
A.该反应为缩聚反应
B.上式中
C.乙二醇能发生取代、消去和氧化反应
D.顺丁烯二酸酐的分子式为
8.Q、W、X、Y、Z是原子序数依次增大的短周期元素,其最高正化合价与原子半径如图所示,硫磺易溶于,Q、W原子序数之和等于X原子序数。
下列说法正确的是( )
A.简单氢化物沸点:
B.最高价含氧酸的酸性:
C.Y位于元素周期表第二周期第ⅢA族
D.Q和Z形成的18电子的微粒只有1种
9.2023年诺贝尔化学奖授予了三位科学家,以表彰他们为“发现和合成量子点”作出的贡献。一种含有新型量子点(简写为)的复合光催化剂利用太阳能高效制氢的原理如图所示。
下列说法正确的是( )
A.电子由电极b沿导线流向电极a
B.电极a的电极反应式为:
C.标准状况下,当电路转移2ml电子时电极生成11.2L
D.电池的总反应方程式为:
10.是制备金属Mg的原料。某研究小组用侯氏制碱法获得的制备,同时实现NH3、CO2的循环利用的流程如图所示。
下列说法正确的是( )
A.a、b分别是
B.将溶液直接蒸发结晶可以得到固体
C.理论上反应①消耗的和反应②生成的相等
D.工业上由制Mg的化学方程式:(熔融)
11.新型钙钛矿材料可用于太阳能电池。一种钙钛矿晶体由、和有机阳离子()构成,其立方晶胞结构如图所示。下列说法错误的是( )
A.晶体的最简化学式为B.基态碘原子的价层电子排布式为
C.晶体中的配位数是8D.晶胞中和构成的是正八面体
12.席夫碱A和含席夫碱A的红光铂配合物的分子结构如图所示。
下列说法正确的是( )
A.元素的电负性大小为:
B.席夫碱A分子内可以形成氢键
C.红光铂配合物分子中的化合价为
D.红光铂配合物分子中键的类型为离子键
13.苯甲醇与溴化氢反应代表苯基)是分步进行的:
①
②
③
反应能量变化如图所示。
下列说法错误的是( )
A.酸性条件下有利于该反应发生
B.第①、③步反应速率比第②步快
C.过渡态2的能量最高,所以第②步反应速率最慢
D.第③步是放热反应
14.是一元弱碱,时其电离常数为,某混合溶液中与的关系如图所示(其中M代表)。
下列说法正确的是( )
A.S点时,
B.Q点时,
C.由10到14的变化过程中,逐渐减小
D.该体系中,
二、填空题
15.偏磷酸钡具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为,含有少量等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
已知时:①;
②将通入溶液中,当pH=3.8~4.5时生成,pH=8.0~8.2时生成。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________。
(2)“滤渣2”的主要成分有及,其中生成的离子方程式为___________;下,当沉淀完全时,至少为___________[当时认为沉淀完全]。
(3)“氨化”的目的之一是通入调节溶液的pH,当溶液pH为4.3时转化为___________(填化学式)。
(4)“脱镁”的目的是生成沉淀除去。若将流程中“氨化”与“脱镁”交换,沉淀不完全,原因是___________。
(5)“结晶”后得到晶体,“煅烧”时生成和等物质,其反应的化学方程式为___________;比较键角:_________(选填“>”“”“;;中中心原子P周围的价层电子对数为:3+=3,故为平面三角形,O-P-O键键角为120°,而中中心原子P周围的价层电子对数为:4+=3,故为正四面体形,O-P-O键键角为109°28′
解析:(1)由分析可知,“滤渣1”中含硫化合物的化学式为,故答案为:;
(2)由工艺流程图可知,“滤渣2”的主要成分有FeS、S及,其中生成FeS即与反应生成FeS和S,该反应的离子方程式为:,下,当沉淀完全时,至少为==,故答案为:;;
(3)由题干已知信息可知,将通入溶液中,当pH=3.8~4.5时生成,pH=8.0~8.2时生成,故“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时转化为,故答案为:;
(4)“脱镁”的目的是生成沉淀除去,由(3)小问分析可知,“氨化”的目的之一是通入调节溶液的pH至pH为4.3,说明氨化之前溶液的酸性太强,若将流程中“氨化”与“脱镁”交换,将因溶液酸性太强,浓度太大,直接与结合成HF,导致的浓度较小,沉淀不完全,故答案为:将因溶液酸性太强,浓度太大,直接与结合成HF,导致的浓度较小,沉淀不完全;
(5)“结晶”后得到晶体,“煅烧”时生成和等物质,其反应的化学方程式为:;中中心原子P周围的价层电子对数为:3+=3,故为平面三角形,O-P-O键键角为120°,而中中心原子P周围的价层电子对数为:4+=3,故为正四面体形,O-P-O键键角为109°28′,故答案为:;>;;中中心原子P周围的价层电子对数为:3+=3,故为平面三角形,O-P-O键键角为120°,而中中心原子P周围的价层电子对数为:4+=3,故为正四面体形,O-P-O键键角为109°28′。
16.答案:(1)a-b-c;>
(2)增大容器体积减小压强;适当升高温度
(3)
(4)增大
(5)b;相同的选择性下,b催化剂的转化率更高
(6)d;图乙中各步相应的活化能d比c更低,反应速率更快,催化效果更好
解析:(1)由题干信息已知:反应①,反应②,反应③,则反应①-②-③即可得到反应,根据盖斯定律可知,=(a-b-c)kJ/ml,已知该反应的>0,故其高温时为自发反应,则该反应的反应热>0,故答案为:a-b-c;>;
(2)由(1)小问分析可知,该反应正反应是一个气体体积增大的吸热反应,故提高该反应平衡转化率的方法有增大容器体积减小压强、适当升高温度,故答案为:增大容器体积减小压强;适当升高温度;
(3)一定温度下,在某恒容密闭容器内充入一定量的乙烷,若平衡时容器中总压为、乙烷的平衡转化率为,由三段式分析可知:,故平衡时容器压强为:,故有平衡时的平衡分压分别为:=,,,则用含、的代数式表示该反应的平衡常数==,故答案为:;
(4)已知在其他条件不变时,升高温度反应速率增大,故一定条件下,该反应的速率方程为:,其中k为反应速率常数,升高温度,该反应的速率常数增大,故答案为:增大;
(5)由题干甲图可知,相同的选择性下,b催化剂的转化率更高,故两种催化剂比较,催化性能较好的是b,故答案为:b;相同的选择性下,b催化剂的转化率更高;
(6)已知化学反应的活化能越高反应速率越慢,由题干图乙所示信息可知,图乙中各步相应的活化能d比c更低,反应速率更快,催化效果更好,故代表催化性能较好的催化剂的反应历程是d,故答案为:d;图乙中各步相应的活化能d比c更低,反应速率更快,催化效果更好。
17.答案:(1)1;6
(2)取代反应;甲胺
(3)羟基和羧基;
(4)
(5)
(6)保护醇羟基不被破坏
(7);
解析:(1)已知同时连有四个互不相同的原子或原子团的碳原子为手性碳原子,故化合物Ⅰ中有1个手性碳原子,即,分子中有6种不同环境的氢原子,故其核磁共振氢谱共有6组峰,故答案为:1;6;
(2)由题干流程图可知,Ⅱ→Ⅲ即++HBr,故反应的反应类型为取代反应,的名称为甲胺,故答案为:取代反应;甲胺;
(3)由题干流程图中,化合物Ⅴ的结构简式:,则其中所含官能团的名称为羟基和羧基,Ⅴ中碳原子的杂化轨道类型有羧基上的,其余为杂化,故答案为:羟基和羧基;;
(4)由分析可知,Ⅵ的结构简式为:,故ⅤⅥ反应的化学方程式为:,故答案为:;
(5)由分析可知,化合物Ⅷ的结构简式为,故答案为:;
(6)由题干流程图可知,结合上述路线,指出Ⅰ→Ⅱ反应在合成中的作用是保护醇羟基不被破坏,故答案为:保护醇羟基不被破坏;
(7)由题干流程图中Ⅰ→Ⅱ反应信息可知,该合成路线图中i的结构简式为:,由Ⅷ到Ⅸ和Ⅲ到Ⅳ的转化信息可知,ii的结构简式为:,故答案为:;。
18.答案:(1);平衡大气压
(2)防倒吸;使HCl充分溶于水;HCl比NaCl更易溶于水,向饱和NaCl中通入HCl,HCl溶入水后NaCl便析出
(3)用95%乙醇而不用蒸馏水淋洗的原因是降低NaCl晶体损失,且乙醇可快速干燥
(4)不能
(5)当滴入最后半滴标准溶液时,溶液由黄色变为砖红色且半分钟内不恢复原来颜色;
(6)自来水中有较多的杂质离子,会污染硝酸银溶液
解析:(1)装置A中发生反应的化学方程式为,连通管a的作用是平衡大气压。
(2)装置C中,倒置漏斗的作用是防倒吸、使HCl充分溶于水,析出NaCl晶体的原理是HCl比NaCl更易溶于水,向饱和NaCl中通入HCl,HCl溶入水后NaCl便析出。
(3)用乙醇而不用蒸馏水淋洗的原因是:用95%乙醇而不用蒸馏水淋洗的原因是降低NaCl晶体损失,且乙醇可快速干燥。
(4)称量1.561gNaCl产品不能用托盘天平,其精度不够。
(5)锥形瓶中滴加入指示剂,用标准溶液在避光下滴定至终点,生成砖红色的铬酸银沉淀,终点时的现象为当滴入最后半滴标准溶液时,溶液由黄色变为砖红色且半分钟内不恢复原来颜色;产品中NaCl的质量分数为。
配制溶液过程中“定容”操作
干燥
分离乙酸乙酯和饱和溶液
铁制品上电镀铜
A
C
选项
a中反应
b中试剂及现象
A
大理石与稀盐酸反应
苯酚钠溶液变浑浊
电石(CaC2)和饱和NaCl溶液反应
酸性溶液褪色
固体与70%的硫酸反应
紫色石蕊溶液先变红后褪色
D
与浓盐酸加热反应
溶液变成棕黄色
相关试卷
这是一份贵州省黔东南州2024届高三下学期二模化学试卷(含答案),共23页。试卷主要包含了单选题,推断题,实验题,填空题等内容,欢迎下载使用。
这是一份贵州省毕节市2024届高三下学期二模考试(毕节二模)化学,共10页。
这是一份全国高中学生化学竞赛(决赛)理论试题14版,共7页。