所属成套资源:人教版(2019)必修第二册高一化学精品同步练习(附参考答案)
- 人教版(2019)必修第二册高一化学练习第六章第一节化学反应与能量变化同步练习(附参考答案) 试卷 0 次下载
- 人教版(2019)必修第二册高一化学练习第六章第一节化学反应与能量变化小题训练(附参考答案) (附参考答案) 试卷 0 次下载
- 人教版(2019)必修第二册高一化学练习第六章第一节化学反应与能量变化课时训练二(附参考答案) 试卷 0 次下载
- 人教版(2019)必修第二册高一化学练习第六章第二节化学反应的速率与限度课时训练一1(附参考答案) (附参考答案) 试卷 0 次下载
- 人教版(2019)必修第二册高一化学练习第六章第二节化学反应的速率与限度课时训练一(附参考答案) 试卷 0 次下载
高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化一课一练
展开
这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化一课一练,共22页。试卷主要包含了单选题,多选题,填空题,实验题等内容,欢迎下载使用。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
A.“天宫一号”中使用的碳纤维,是一种新型有机高分子材料
B.为改善食品的色、香、味并防止变质,可加入大量食品添加剂
C.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
D.大量使用化肥和农药,以提高农作物产量
2.碳循环经济是科学家研究的重要课题,下面是某科学家团队提出的碳循环模式,有关说法不正确的是
A.该循环有利于缓解温室效应,减少对常规能源的依赖
B.该循环所涉及的化学反应不可能都是放热
C.有机物和无机物之间在一定条件下可以相互转化
D.CO2和H2合成甲醇,符合绿色化学中的最理想的“原子经济”
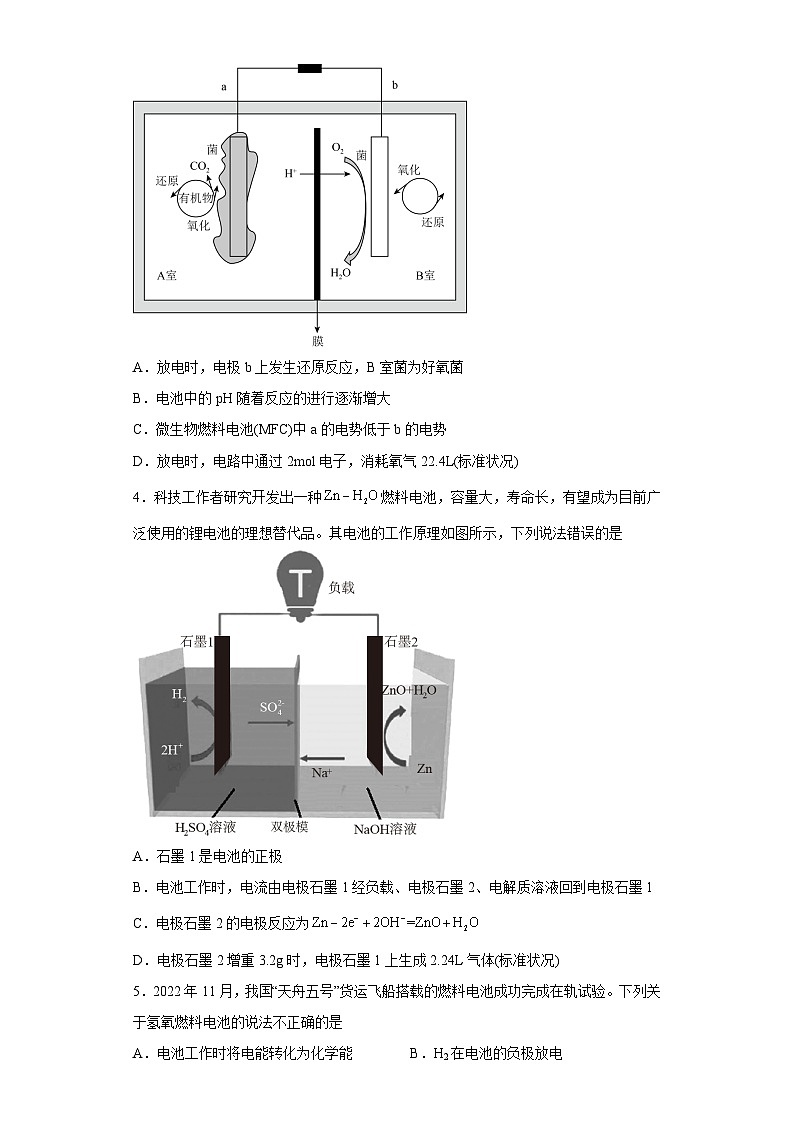
3.在环境和能源备受关注的今天,开发清洁、可再生新能源已成为世界各国政府的国家战略,微生物燃料电池(MFC)为可再生能源的开发和难降解废物的处理提供了一条新途径。微生物燃料电池(MFC)如图所示(假设有机物为乙酸盐)。下列说法错误的是
A.放电时,电极b上发生还原反应,B室菌为好氧菌
B.电池中的pH随着反应的进行逐渐增大
C.微生物燃料电池(MFC)中a的电势低于b的电势
D.放电时,电路中通过2ml电子,消耗氧气22.4L(标准状况)
4.科技工作者研究开发出一种燃料电池,容量大,寿命长,有望成为目前广泛使用的锂电池的理想替代品。其电池的工作原理如图所示,下列说法错误的是
A.石墨1是电池的正极
B.电池工作时,电流由电极石墨1经负载、电极石墨2、电解质溶液回到电极石墨1
C.电极石墨2的电极反应为
D.电极石墨2增重3.2g时,电极石墨1上生成2.24L气体(标准状况)
5.2022年11月,我国“天舟五号”货运飞船搭载的燃料电池成功完成在轨试验。下列关于氢氧燃料电池的说法不正确的是
A.电池工作时将电能转化为化学能B.H2在电池的负极放电
C.O2反应中得到电子D.氢气、氧气可通过电解水产生
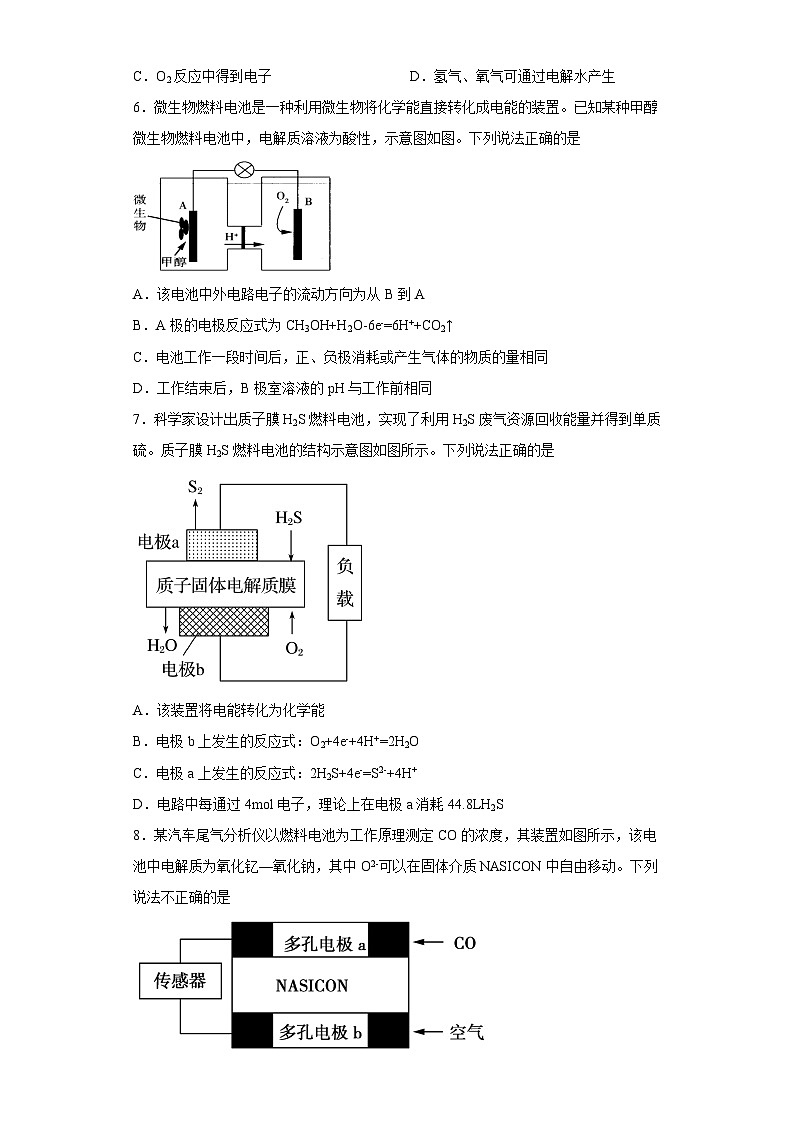
6.微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图。下列说法正确的是
A.该电池中外电路电子的流动方向为从B到A
B.A极的电极反应式为CH3OH+H2O-6e-=6H++CO2↑
C.电池工作一段时间后,正、负极消耗或产生气体的物质的量相同
D.工作结束后,B极室溶液的pH与工作前相同
7.科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法正确的是
A.该装置将电能转化为化学能
B.电极b上发生的反应式:O2+4e-+4H+=2H2O
C.电极a上发生的反应式:2H2S+4e-=S2-+4H+
D.电路中每通过4ml电子,理论上在电极a消耗44.8LH2S
8.某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法不正确的是
A.工作时电极b作正极,O2-由电极b流向电极a
B.负极的电极反应式为:
C.当传感器中通过2×10-3ml电子时,通过的尾气中含有2.24mLCO
D.传感器中通过的电流越大,尾气中CO的含量越高
9.科学家研制出一种高性能水系酸碱双液锌-溴二次电池,其总反应为:Zn+2OH-+BrZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是
A.放电时,锌电极的电势低于石墨电极B.放电时,K+向锌电极迁移
C.充电时,阴极室的pH减小D.充电时,石墨电极发生反应:Br-2e-=3Br -
10.铁镍蓄电池的工作原理为。下列有关该电池的说法不正确的是
A.电池放电时,正极为,负极为Fe
B.电池放电时,负极的电极反应为
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极被氧化为
11.混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液。关于镍氢电池,下列说法不正确的是
A.充电时,阴极附近pH降低
B.电动机工作时溶液中OH-向甲移动
C.放电时正极反应式为: NiOOH+H2O+e- = Ni(OH)2+OH-
D.充电时总反应式为:M+Ni(OH)2 = MH+NiOOH
12.铅蓄电池是一种典型的可充电电池,其放电时的电池总反应Pb+PbO2+2H2SO4=2PbSO4+2H2O,则下列说法不正确的是
A.电池工作时,负极反应:Pb-2e- =Pb2+
B.铅蓄电池是二次电池,放电时是化学能转化为电能
C.电池工作时,电子由Pb板通过导线流向PbO2板
D.电池工作时,溶液中H+移向PbO2板
13.结合学习生活经历,判断下列叙述不正确的是
A.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
B.将单液原电池设计成双液原电池是为了减少化学能转化为热能而造成损失
C.测定中和反应反应热的实验中,混合溶液的温度不再变化时,该温度为终止温度
D.铅蓄电池使用一段时间后,电解质溶液的酸性减弱,导电能力下降
14.据报道,美国正在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点,其电池反应为:2Zn+O2═2ZnO,其原料为锌、空气和碱性电解质溶液,则下列叙述正确的是( )
A.锌为正极,空气在负极反应
B.负极还原反应,正极氧化反应
C.负极的电极反应为:Zn+2OH﹣﹣2e﹣═ZnO+H2O
D.电池工作时溶液的pH 升高
二、多选题
15.甲烷可制成燃料电池,其装置如图所示。下列说法中正确的是
A.极是正极
B.极得到电子生成
C.电解质溶液可能为碱性溶液
D.若正极消耗的气体为(标准状况下),理论上电路中通过的电子的物质的量为0.4ml
三、填空题
16.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH- - 2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
总反应式为Ag2O+Zn=ZnO+2Ag
(1)Ag2O是______极,Zn发生______反应。
(2)电子由________极流向________极(填“Zn”或“Ag2O”),当电路通过0.1ml电子时,负极消耗物质的质量是___________g。
17.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-。
(1)正极材料为___________。
(2)写出另一电极的电极反应式__________。
(3)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?________(增大、减小、不变)。
(4)当电池工作时通过电路对外提供了1ml电子,计算消耗的负极的质量_______。
(5)利用下列反应:Fe+2Fe3+=3Fe2+设计一个原电池,请选择适当的材料和试剂。
①电解质溶液为_____________。
②负极反应式:____________________。
③溶液中Fe3+向__________极移动。
18.微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。
请回答下列问题。
(1)该电池属于_________电池(填“一次”或“二次”)。
(2)负极是_________,电极反应式是__________________________。
(3)使用时,正极区的pH_________(填“增大”、“减小”或“不变”)。
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____。(填字母)
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H
相关试卷
这是一份人教版 (2019)必修 第二册第一节 自然资源的开发利用当堂达标检测题,共19页。试卷主要包含了单选题,多选题,填空题,实验题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度课后测评,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度课后测评,共24页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。









