

所属成套资源:人教版高中化学选修二课件PPT(含课件、教案、学案、作业)
- 高二化学(人教版)选择性必修第2册 第一章 第二节 第二课时 元素周期律1-教学课件、教案、学案、作业 课件 2 次下载
- 高二化学(人教版)选择性必修第2册 第一章 第二节 第三课时 元素周期律2-教学课件、教案、学案、作业 课件 2 次下载
- 高二化学(人教版)选择性必修第2册 第二章 第一节 第一课时 共价键-教学课件、教案、学案、作业 课件 3 次下载
- 高二化学(人教版)选择性必修第2册 第二章 第一节 第二课时 键参数--键能 键长与键角-教学课件、教案、学案、作业 课件 2 次下载
- 高二化学(人教版)选择性必修第2册 第二章 第二节 第一课时 分子结构的测定-教学课件、教案、学案、作业 课件 2 次下载
人教版 (2019)选择性必修2第一节 原子结构学案
展开
这是一份人教版 (2019)选择性必修2第一节 原子结构学案,共9页。
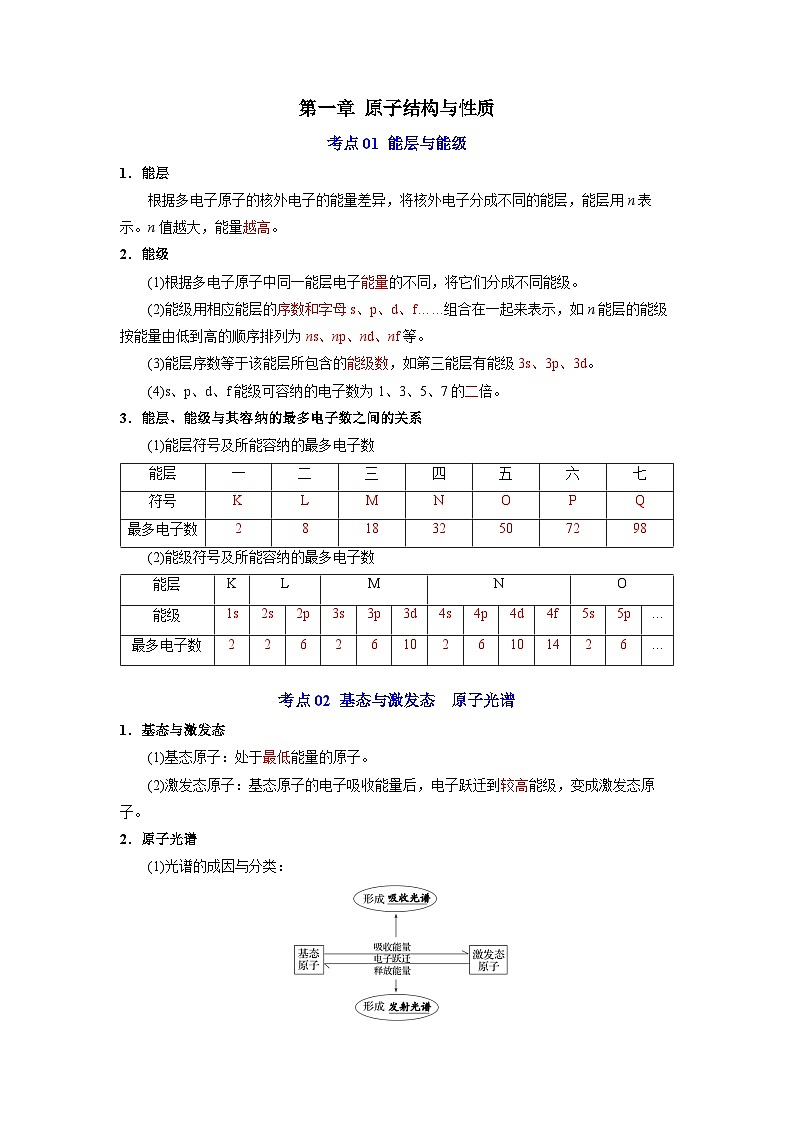
1.能层
根据多电子原子的核外电子的能量差异,将核外电子分成不同的能层,能层用n表示。n值越大,能量越高。
2.能级
(1)根据多电子原子中同一能层电子能量的不同,将它们分成不同能级。
(2)能级用相应能层的序数和字母s、p、d、f……组合在一起来表示,如n能层的能级按能量由低到高的顺序排列为ns、np、nd、nf等。
(3)能层序数等于该能层所包含的能级数,如第三能层有能级3s、3p、3d。
(4)s、p、d、f能级可容纳的电子数为1、3、5、7的二倍。
3.能层、能级与其容纳的最多电子数之间的关系
(1)能层符号及所能容纳的最多电子数
(2)能级符号及所能容纳的最多电子数
考点02 基态与激发态 原子光谱
1.基态与激发态
(1)基态原子:处于最低能量的原子。
(2)激发态原子:基态原子的电子吸收能量后,电子跃迁到较高能级,变成激发态原子。
2.原子光谱
(1)光谱的成因与分类:
(2)光谱分析:
在现代化学中,利用原子光谱上的特征谱线来鉴定元素的分析方法。
(3)光谱分析的应用:鉴定元素。
考点03 构造原理
1.构造原理
随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按如图所示的能级顺序填充的,填满一个能级再填一个能级。
其中,每一行对应一个能层,每个小圈表示一个能级
各圆圈间的连接线的方向表示随核电荷数递增而增加的电子填入能级的顺序。
2.能量与能层、能级的关系
(1)决定电子能量高低的因素:
①能层:能级符号相同时,能层序数越大,电子能量越高;
②能级:在同一能层的不同能级中,s、p、d、f能级的能量依次升高;
③在多电子原子中会发生能级交错现象。
(2)多电子原子中,相同能层上不同能级能量的高低为ns<np<nd<nf;不同能层上符号相同的能级能量的高低为1s<2s<3s<4s。1s<3d;3s<3d。
考点04 电子排布式
1.电子排布式表示方法
将能级上所容纳的电子数标在该能级符号的右上角,并按照能层从左到右的顺序排列的式子,称为电子排布式。
2.原子的电子排布式
(1)简单原子的电子排布式
按照构造原理将电子依次填充到能量逐渐升高的能级中。如:
6C:1s22s22p2;10Ne:1s22s22p6;
17Cl:1s22s22p63s23p5;19K:1s22s22p63s23p64s1。
(2)复杂原子的电子排布式
对于较复杂原子的电子排布式,应先按构造原理从低到高排列,然后将同能层的能级移到一起。
如26Fe,先排列为1s22s22p63s23p64s23d6,然后将同一能层的能级排到一起,即该原子的电子排布式为1s22s22p63s23p63d64s2。
(3)简化电子排布式
如K:1s22s22p63s23p64s1,其简化电子排布式可表示为[Ar]4s1,其中[Ar]代表Ar的核外电子排布式,即1s22s22p63s23p6。再如Fe的简化电子排布式为[Ar]3d64s2。
3.离子的电子排布式
(1)判断该原子变成离子时会得到或失去的电子数。
(2)原子失去电子时,总是从能量高的能级失去电子,即失去电子的顺序是由外向里。一般来说,主族元素只失去它们的最外层电子,而副族和第Ⅷ族元素可能还会进一步向里失去内层电子。
(3)原子得到电子而形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。如Cl-的电子排布式为1s22s22p63s23p6(得到的电子填充在最外面的3p能级上)。
考点05 电子云
1.电子运动的特点
现代量子力学指出,不可能像描述宏观物体运动那样确定核外电子在某个时刻处于原子核外空间何处,只能确定在原子核外各处出现的概率。用P表示电子在某处出现的概率,V表示该处的体积,则P/V称为概率密度,用ρ表示。
2.电子云
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。小黑点越密,表示概率密度越大。由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云。
3.原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。因此常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
4.不同能层对应的能级和原子轨道
考点06 核外电子排布规则与轨道表示式
1.核外电子排布规律
基态原子的核外电子排布规律应遵循:
(1)泡利原理:每个能级最多容纳2个自旋方向相反的电子。
(2)洪特规则:同能级电子优先单独占据一个轨道,且自旋平行。
(3)能量最低原理:遵循构造原理,优先占据能量较低的轨道,使原子总能量最低。
(4)特殊性
有少数元素基态原子的电子排布对于构造原理有1个电子的偏差,因为能量相同的原子轨道在全充满(如p6和d10)、半充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,原子较稳定。如
24Cr:1s22s22p63s23p63d44s2 (×) 24Cr:1s22s22p63s23p63d54s1 (√)
29Cu:1s22s22p63s23p63d94s2 (×) 29Cu:1s22s22p63s23p63d104s1 (×)
2.核外电子排布的表示方法
(1)电子排布式:
①电子排布式。如K原子的电子排布式:1s22s22p63s23p64s1。
②简化的电子排布式。如K原子简化的电子排布式:[Ar]4s1。
(2)轨道表示式(电子排布图):
每个方框代表一个原子轨道,每个箭头代表一个电子。如N的轨道表示式:
3.价电子排布式的表示方法
(1)价电子原子在参与化学反应时能够用于成键的电子,是原子核外跟元素化合价有关的电子。
(2)在主族元素中,价电子数就是最外层电子数。副族元素原子的价电子,除最外层电子外,还可包括次外层电子。例如:Mn的电子排布式为1s22s22p63s23p63d54s2,价电子排布式为3d54s2。
考点07 元素周期系
1.碱金属元素和稀有气体元素原子的价层电子排布
2.元素周期系的形成
(1)每一周期(第一周期除外)从碱金属元素开始到稀有气体元素结束,最外层电子排布从ns1递增到ns2np6,但元素周期系的周期不是单调的,每一周期里元素的数目不总是一样多。
(2)元素形成周期系的根本原因是元素的原子核外电子排布发生周期性的重复。
(3)根据构造原理得出的核外电子排布,可以解释元素周期系的基本结构。例如:第一周期从1s1开始,以1s2结束;其余周期总是从ns能级开始,以np能级结束,其间递增的核电荷数(或电子数)就等于每个周期里的元素数。
3.构造原理与元素周期表
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p……
周期 一 二 三 四 五 六 七
元素 2 8 8 18 18 32 32
4.价层电子排布和周期表的关系
(1)原子的电子层数=能级中最高能层序数=周期序数。
(2)主族元素原子的价层电子数=该元素在周期表中的主族序数。
(3)过渡元素(除镧系、锕系外,以第四周期为例)
5.价层电子排布与元素的最高正价数
(1)当主族元素失去全部价电子后,表现出该元素的最高化合价,最高正价=主族序数(O、F除外)。
(2)ⅢB~ⅦB族可失去ns和(n-1)d轨道上的全部电子,所以,最高正价数=族序数。
(3)Ⅷ族可失去最外层的s电子和次外层的部分(n-1)d电子,所以最高正价低于族序数(8),只有Ru和Os可表现八价。
(4)ⅠB族可失去ns1电子和部分(n-1)d电子,所以ⅠB的族数r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)。
(2)电子层结构相同的离子,核电荷数越大,半径越小。如r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
(3)带相同电荷的离子,电子层数越多,半径越大。如r(Li+)
相关学案
这是一份高三化学复习知识清单(通用版) 知识清单03 离子反应,共7页。学案主要包含了电解质和非电解质,电解质的电离,离子反应,离子方程式的正误判断,离子反应和离子共存等内容,欢迎下载使用。
这是一份高三化学复习知识清单(通用版) 知识清单01 物质的量,共8页。学案主要包含了基本公式及关系式,容量瓶的使用,配制一定浓度的溶液,阿佛加德罗常数的判断等内容,欢迎下载使用。
这是一份高三化学复习知识清单(通用版) 知识清单32 化学实验基础,共11页。学案主要包含了知识网络,知识归纳,方法技巧等内容,欢迎下载使用。











