

所属成套资源:新高考化学一轮复习精品学案 (含解析)
新高考化学一轮复习精品学案 第9章 第53讲 酸碱中和滴定及拓展应用(含解析)
展开
这是一份新高考化学一轮复习精品学案 第9章 第53讲 酸碱中和滴定及拓展应用(含解析),共17页。
2.掌握酸碱中和滴定的操作和数据处理误差分析的方法。3.掌握滴定法在定量测定中的应用。
考点一 酸碱中和滴定的原理与操作
1.原理
利用酸碱中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。以标准HCl溶液滴定待测的NaOH溶液,待测的NaOH溶液的物质的量浓度为c(NaOH)=eq \f(cHCl·VHCl,VNaOH)。
2.实验操作与仪器的选择
(1)主要仪器
(2)滴定前准备
滴定管:查漏→洗涤→润洗→装液→排气泡调液面→记录。
锥形瓶:洗涤→装待测液→加指示剂。
(3)滴定操作
(4)滴定终点
滴入最后半滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,停止滴定,并记录标准溶液的体积。
(5)数据处理
按上述操作重复2~3次,根据每次所用标准液的体积计算待测液的物质的量浓度,最后求出待测液的物质的量浓度的平均值。
3.关键
(1)准确测定参加反应的酸、碱溶液的体积。
(2)选取适当的指示剂,准确判断滴定终点。
熟记:常见酸碱指示剂的变色范围
4.滴定曲线
以0.100 0 ml·L-1 NaOH溶液滴定20.00 mL 0.100 0 ml·L-1盐酸为例
5.误差分析
分析依据:cB=eq \f(cA·VA,VB)(VB表示准确量取的待测液的体积、cA表示标准溶液的浓度)。
若VA偏大⇒cB偏大;若VA偏小⇒cB偏小。
1.将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积为25 mL( )
2.滴定终点就是酸碱恰好中和的点( )
3.滴定管和锥形瓶在滴定前都应该用待装溶液润洗( )
4.酸碱指示剂越多变色越明显,指示剂至少加入2~3 mL( )
答案 1.× 2.× 3.× 4.×
一、酸碱中和滴定的操作与指示剂的选择
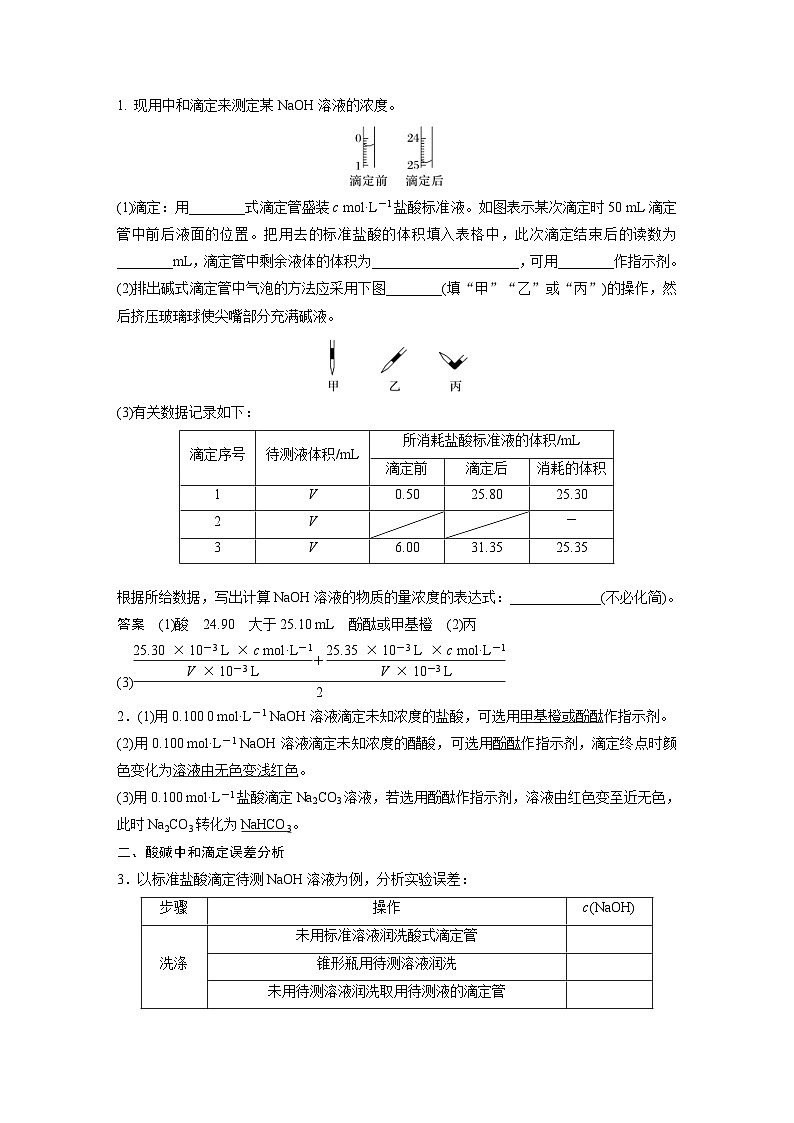
1. 现用中和滴定来测定某NaOH溶液的浓度。
(1)滴定:用________式滴定管盛装c ml·L-1盐酸标准液。如图表示某次滴定时50 mL滴定管中前后液面的位置。把用去的标准盐酸的体积填入表格中,此次滴定结束后的读数为________mL,滴定管中剩余液体的体积为_____________________,可用________作指示剂。
(2)排出碱式滴定管中气泡的方法应采用下图________(填“甲”“乙”或“丙”)的操作,然后挤压玻璃球使尖嘴部分充满碱液。
(3)有关数据记录如下:
根据所给数据,写出计算NaOH溶液的物质的量浓度的表达式:_____________(不必化简)。
答案 (1)酸 24.90 大于25.10 mL 酚酞或甲基橙 (2)丙
(3)eq \f(\f(25.30×10-3 L×c ml·L-1,V×10-3 L)+\f(25.35×10-3 L×c ml·L-1,V×10-3 L),2)
2.(1)用0.100 0 ml·L-1 NaOH溶液滴定未知浓度的盐酸,可选用甲基橙或酚酞作指示剂。
(2)用0.100 ml·L-1 NaOH溶液滴定未知浓度的醋酸,可选用酚酞作指示剂,滴定终点时颜色变化为溶液由无色变浅红色。
(3)用0.100 ml·L-1盐酸滴定Na2CO3溶液,若选用酚酞作指示剂,溶液由红色变至近无色,此时Na2CO3转化为NaHCO3。
二、酸碱中和滴定误差分析
3.以标准盐酸滴定待测NaOH溶液为例,分析实验误差:
答案 偏高 偏高 偏低 无影响 偏低 偏低 偏高 偏低 无影响 偏低 偏高
三、滴定曲线的分析
4.室温条件下,将0.1 ml·L-1的NaOH溶液逐滴滴入10 mL 0.1 ml·L-1HB溶液中,所得溶液pH随NaOH溶液体积的变化如图。下列说法正确的是( )
A.Ka(HB)的数量级为10-4
B.该中和滴定可采用酚酞作为指示剂
C.V1=10
D.b点时,NaOH与HB恰好完全反应
答案 B
解析 根据电离方程式,电离出的c(H+)=c(B-),即Ka(HB)=eq \f(cH+·cB-,cHB)=eq \f(10-2×10-2,0.1-0.01)≈1.1×10-3,Ka(HB)的数量级为10-3,A错误;V1时混合溶液恰好为中性,由于NaB为强碱弱酸盐,故此时酸有剩余,V1c(Cl-)>c(CH3COO-)>c(CH3COOH)
答案 B
解析 恰好中和时,生成氯化钠溶液和醋酸钠溶液,其中醋酸根离子会水解,溶液显碱性,A正确;加入20 mL NaOH溶液时,溶液为NaCl和CH3COOH的混合溶液,此时c(H+)
≈eq \r(Ka·cCH3COOH)=eq \r(1.8×10-5×0.05) ml·L-1=eq \r(0.9)×10-3 ml·L-1>1×10-4.3 ml·L-1,则滴加NaOH至pH=4.3,说明醋酸也参加了反应,B错误;滴定前盐酸和醋酸的浓度相同,故滴定过程中,氯离子浓度等于醋酸分子的浓度和醋酸根离子的浓度和,C正确;向20 mL浓度均为0.1 ml·L-1的盐酸和醋酸的混合溶液中逐滴加入0.1 ml·L-1的NaOH溶液,当NaOH溶液的体积为20 mL时,溶液为氯化钠和醋酸的混合溶液,显酸性,需要再滴加适量的氢氧化钠,故c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH),D正确。
4.[2022·江苏,16(4)]实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用准确浓度的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为Fe2++Ce4+===Fe3++Ce3+。请补充完整实验方案:①准确量取25.00 mL Ce3+溶液[c(Ce3+)约为0.2 ml·L-1],加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将0.020 00 ml·L-1(NH4)2Fe(SO4)2和待测Ce4+溶液装入如图所示的滴定管中:③___________________________
________________________________________________________________________。
答案 从左侧滴定管中放出一定体积的待测Ce4+溶液,加入指示剂苯代邻氨基苯甲酸,用0.020 00 ml·L-1(NH4)2Fe(SO4)2溶液来滴定,当滴入最后半滴标准液时,溶液由紫红色变为亮黄色,且半分钟内不变色,即达到滴定终点,重复上述操作2~3次,记录标准液的体积
5.[2022·辽宁,17(7)]测定氢醌法制取H2O2样品含量的方法如下:
取2.50 g产品,加蒸馏水定容至100 mL摇匀,取20.00 mL于锥形瓶中,用0.050 0 ml·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为__________。
答案 17%
解析 滴定反应的离子方程式为2MnOeq \\al(-,4)+5H2O2+6H+===2Mn2++5O2↑+8H2O,可得关系式:2KMnO4~5H2O2。三组数据中20.90 mL偏差较大,舍去,故消耗酸性高锰酸钾标准溶液的平均体积为20.00 mL,H2O2的质量分数w=eq \f(20×10-3L×0.050 0 ml·L-1×\f(5,2)×\f(100 mL,20.00 mL)×34 g·ml-1,2.50 g)×100%=17%。
课时精练
1.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净,必须干燥后才能加入一定体积未知浓度的NaOH溶液
C.滴定时没有排出滴定管中的气泡
D.读数时视线与滴定管内液体凹液面保持水平
答案 D
解析 A项,滴定管在装液之前必须要用标准液润洗,否则会稀释标准液,错误;B项,锥形瓶用蒸馏水洗净,不必干燥就能加入一定体积未知浓度的NaOH溶液,瓶中残留的蒸馏水对测定结果无影响,错误;C项,在滴定之前必须排出滴定管下端的气泡,然后记录读数,进行滴定,错误。
2.某同学想了解食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液(浓度有0.100 0 ml·L-1和0.010 0 ml·L-1两种)对其进行滴定。下列说法正确的是( )
A.该实验应选用甲基橙作指示剂
B.用0.100 0 ml·L-1标准NaOH溶液滴定时误差更小
C.准确量取一定体积的白醋放入洗浄的锥形瓶中后,可以再加少量蒸馏水后开始滴定
D.滴定时,眼睛一直注视着刻度线,以防止液面下降到滴定管最大刻度以下
答案 C
解析 该实验滴定终点生成醋酸钠,醋酸钠水解使溶液呈碱性,应选用酚酞作指示剂,故A错误;由于白醋中醋酸溶液浓度较小,用浓度较小的氢氧化钠溶液滴定误差较小,故B错误;准确量取一定体积的白醋放入洗净的锥形瓶中后,可以再加少量蒸馏水,不影响实验结果,故C正确;滴定时,眼睛要注视锥形瓶中溶液颜色的变化,故D错误。
3.NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4·2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是( )
A.图甲:转移NaOH溶液到250 mL容量瓶中
B.图乙:准确称得0.157 5 g H2C2O4·2H2O固体
C.用图丙所示操作排除碱式滴定管中的气泡
D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液
答案 C
解析 向容量瓶中转移溶液时需要用玻璃棒引流,故A错误;托盘天平的精确度为0.1 g,故B错误;NaOH溶液应装在碱式滴定管中,故D错误。
4.实验室现有3种酸碱指示剂,其pH变色范围如下:
甲基橙:3.1~4.4 石蕊:5.0~8.0
酚酞:8.2~10.0
用0.100 0 ml·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应时,下列叙述中正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
答案 D
解析 NaOH溶液和CH3COOH溶液恰好完全反应时生成CH3COONa,CH3COO-水解使溶液显碱性,而酚酞的变色范围为8.2~10.0,比较接近。
5.H2S2O3是一种弱酸,实验室欲用0.01 ml·L-1的Na2S2O3溶液滴定碘水,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法正确的是( )
A.该滴定反应可用甲基橙作指示剂
B.Na2S2O3是该反应的还原剂
C.该滴定反应可选用如图所示的装置
D.该反应中每消耗2 ml Na2S2O3,转移电子的物质的量为4 ml
答案 B
解析 溶液中有单质碘,应加入淀粉溶液作指示剂,碘与硫代硫酸钠发生氧化还原反应,当反应达到终点时,单质碘消失,蓝色褪去,故A错误;Na2S2O3中S元素化合价升高被氧化,作还原剂,故B正确;Na2S2O3溶液显碱性,应该用碱式滴定管,故C错误;反应中每消耗2 ml Na2S2O3,转移2 ml电子,故D错误。
6.室温下,向20.00 mL 0.100 0 ml·L-1盐酸中滴加0.100 0 ml·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg 5≈0.7。下列说法不正确的是( )
A.NaOH与盐酸恰好完全反应时,pH=7
B.选择变色范围在pH突变范围内的指示剂,可减小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.V(NaOH)=30.00 mL时,pH≈12.3
答案 C
解析 NaOH与盐酸恰好完全反应时溶液中溶质为NaCl,呈中性,室温下pH=7,故A正确;甲基橙的变色范围在pH突变范围外,误差更大,故C错误;V(NaOH)=30.00 mL时,溶液中的溶质为氯化钠和氢氧化钠,且c(NaOH)=
eq \f(30×10-3 L×0.100 0 ml·L-1-20×10-3 L×0.100 0 ml·L-1,20+30×10-3 L)=0.02 ml·L-1,即溶液中c(OH-)=0.02 ml·L-1,则c(H+)=5×10-13 ml·L-1,pH=-lg c(H+)≈12.3,故D正确。
7.(2022·上海模拟)测定鸡蛋壳中碳酸钙含量的方法如下:将一定质量鸡蛋壳粉碎后用已知浓度与体积的足量盐酸充分溶解(假设其他成分不反应),直到不再有气泡产生。再加入2滴酚酞溶液,用标准NaOH溶液滴定至终点,记录消耗NaOH溶液体积。若某次测定的碳酸钙含量偏高,可能的原因是( )
A.所用的盐酸浓度过高,有一定挥发
B.终点时溶液呈较深的红色
C.滴定管清洗后直接盛装标准NaOH溶液
D.滴定前未通过加热赶走溶解的CO2
答案 A
解析 若所用的盐酸浓度过高,有一定挥发,则过量盐酸消耗NaOH的体积减小,由此计算CaCO3消耗盐酸的体积偏大,CaCO3的含量偏高,A正确;终点时溶液呈较深的红色,则过量盐酸消耗NaOH溶液体积偏大,CaCO3消耗盐酸的体积偏小,由此计算CaCO3的含量偏低,B错误;滴定管清洗后直接盛装标准NaOH溶液,则过量盐酸消耗NaOH的体积偏大,由此计算CaCO3消耗盐酸的体积偏小,CaCO3的含量偏低,C错误;滴定前未通过加热赶走溶解的CO2,则消耗NaOH的体积偏大,由此计算CaCO3消耗盐酸的体积偏小,CaCO3的含量偏低,D错误。
8.常温下,用1.0 ml·L-1的NaOH溶液中和某浓度的H2SO4溶液,所得溶液的pH和所用NaOH溶液体积的关系如图所示,则原H2SO4溶液的物质的量浓度及完全反应后溶液的体积(忽略反应前后溶液体积的变化)分别是( )
A.1.0 ml·L-1,20 mL
B.0.5 ml·L-1,40 mL
C.0.5 ml·L-1,80 mL
D.1.0 ml·L-1,80 mL
答案 C
解析 滴定前H2SO4溶液的pH=0,则c(H2SO4)=0.5 ml·L-1,当pH=7时V(NaOH)=40 mL,通过计算可知原H2SO4溶液的体积为80 mL。
9.(2022·南京模拟)室温下,向a点(pH=a)的20.00 mL 1.000 ml·L-1氨水中滴入1.000 ml·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法错误的是( )
A.将此氨水稀释,溶液的导电能力减弱
B.b点溶液中离子浓度大小可能存在:c(NHeq \\al(+,4))>c(Cl-)>c(OH-)>c(H+)
C.c点时消耗盐酸体积小于20.00 mL
D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
答案 D
解析 将氨水稀释,氨水中NHeq \\al(+,4)、OH-的浓度均减小,因而导电能力减弱,A项正确;由图知,b点溶液显碱性,氨水有剩余,B项正确;c点溶液呈中性,因而V(盐酸)略小于20.00 mL,C项正确;d点对应的温度较高,其水的离子积常数较大,D项错误。
10.生产和实验中广泛采用甲醛法测定饱和食盐水样品中的NHeq \\al(+,4)含量。利用的反应原理为4NHeq \\al(+,4)+6HCHO===(CH2)6N4H+(一元酸)+3H++6H2O。实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。取甲醛a mL于锥形瓶中,加入1~2滴指示剂,用浓度为b ml·L-1的NaOH溶液滴定,滴定管的初始读数为V1 mL,当锥形瓶内溶液呈微红色时,滴定管的读数为V2 mL。
②向锥形瓶中加入饱和食盐水试样c mL,静置1分钟。
③用上述滴定管中剩余的NaOH溶液继续滴定锥形瓶内溶液,至溶液呈微红色时,滴定管的读数为V3 mL。下列说法不正确的是( )
A.步骤①中的指示剂可以选用酚酞溶液
B.步骤②中静置的目的是使NHeq \\al(+,4)和HCHO完全反应
C.步骤②若不静置会导致测定结果偏高
D.饱和食盐水中的c(NHeq \\al(+,4))=eq \f(bV3-V2,c) ml·L-1
答案 C
解析 步骤①中用NaOH溶液滴定甲酸,滴定终点时生成甲酸钠,溶液呈碱性,所以指示剂可选用酚酞溶液,故A正确;步骤②中静置1分钟的目的是使NHeq \\al(+,4)和HCHO完全反应,从而减小实验误差,故B正确;步骤②若不静置,NHeq \\al(+,4)没有完全反应,会导致消耗标准液体积偏小,测定结果偏低,故C错误;反应中产生的H+消耗NaOH溶液的体积为(V3-V2)mL,则饱和食盐水中的c(NHeq \\al(+,4))=eq \f(b ml·L-1×V3-V2×10-3L,c×10-3L)=eq \f(bV3-V2,c) ml·L-1,故D正确。
11.(2022·银川质检)25 ℃时,用0.100 0 ml·L-1的NaOH溶液滴定20.00 mL 0.100 0 ml·L-1的一元强酸甲和一元弱酸乙,滴定曲线如图所示。下列有关判断正确的是( )
A.曲线Ⅰ代表的滴定最好选用甲基橙作指示剂
B.曲线Ⅱ为NaOH溶液滴定一元弱酸乙
C.电离常数Ka(乙)=1.01×10-5
D.图像中的x>20.00
答案 C
解析 根据两种酸的浓度均为0.100 0 ml·L-1以及曲线Ⅰ、Ⅱ的起点对应的pH可知,曲线Ⅰ为NaOH滴定一元弱酸乙,曲线Ⅱ为NaOH滴定一元强酸甲,B项错误;分析曲线Ⅰ可知,滴定终点时溶液为碱性,故应选取酚酞作指示剂,A项错误;由a点可知,滴定前一元弱酸乙溶液中c(H+) =0.001 0 ml·L-1,故Ka(乙)=eq \f(0.001 02,0.100 0-0.001 0)≈1.01×10-5,C项正确;由曲线Ⅱ可知,强碱滴定强酸达到滴定终点时,pH=7,x=20.00,D项错误。
12.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中反应的化学方程式为__________________________________________。
(2)除去C中过量的H2O2,然后用0.090 0 ml·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________(填序号);简述排气泡的操作:____________________________。
(3)①若滴定终点时溶液的pH=8.8,则选择的指示剂为________;描述达到滴定终点的现象: ________________________________________________________________________。
②若滴定终点时溶液的pH=4.2,则选择的指示剂为__________;描述达到滴定终点的现象: ________________________________________________________________________。
(4)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)。
①=10 mL ②=40 mL ③40 mL
(5)滴定至终点时,消耗NaOH溶液25.00 mL,列式计算该葡萄酒中SO2含量: ________________________________________________________________________。
(6)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:___________
________________________________________________________________________。
答案 (1)SO2+H2O2===H2SO4
(2)③ 将胶管弯曲使玻璃尖嘴向上倾斜,用两指捏住胶管,轻轻挤压玻璃珠的中上部,使液体从尖嘴流出 (3)①酚酞 滴入最后半滴标准液,溶液由无色变为浅红色,且半分钟内不恢复原色
②甲基橙 当滴入最后半滴标准液,溶液由红色变为橙色,且半分钟内不恢复原色 (4)④
(5)n(NaOH)=0.090 0 ml·L-1×0.025 L=0.002 25 ml。根据反应关系SO2~H2SO4~2NaOH,m(SO2)=eq \f(0.002 25 ml×64 g·ml-1,2)=0.072 g,该葡萄酒中SO2的含量为eq \f(0.072 g,0.3 L)=0.24 g·L-1
(6)盐酸具有挥发性,反应过程中挥发出的盐酸滴定时消耗了NaOH标准液。改进措施:用非挥发性的强酸硫酸代替盐酸
13.水溶液中的离子反应与离子平衡在化学工业上有着重要的应用。回答下列问题:
(1)常温下,将V1 mL 0.3 ml·L-1稀盐酸与V2 mL 0.1 ml·L-1 NaOH溶液混合,所得溶液的pH为1,则V1∶V2=________(溶液体积变化忽略不计)。
(2)常温下,将V1 mL pH=3的酸HA溶液与V2 mL pH=11的NaOH溶液混合。下列说法正确的是________(填字母)。
A.若V1=V2,反应后溶液pH一定等于7
B.若反应后溶液呈中性,则混合液中c(H+)+c(OH-)=2×10-7 ml·L-1
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(3)常温下,用0.100 0 ml·L-1的NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液,滴定过程中,溶液的pH与消耗NaOH溶液的体积的关系如图所示:
①该滴定过程应该选择________(填“酚酞”或“甲基橙”)作指示剂。
②C点溶液中离子浓度由大到小的顺序为__________________________________。
③下列操作会使测定结果偏小的是________(填字母)。
a.未用标准溶液润洗滴定管
b.标准溶液滴在锥形瓶外一滴
c.滴定前平视,滴定后俯视读数
d.待测液溅出锥形瓶外一滴
答案 (1)1∶1 (2)BD
(3)①酚酞 ②c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ③cd
解析 (1)混合后氢离子的浓度为0.1 ml·L-1,则eq \f(V1 mL×0.3 ml·L-1-V2 mL×0.1 ml·L-1,V1+V2 mL)=0.1 ml·L-1,则V1∶V2=1∶1。
(2)当V1=V2,酸碱恰好完全反应,如果HA是弱酸,则生成的NaA溶液呈碱性,A错误;若反应后溶液呈中性,则常温下,氢离子浓度等于氢氧根离子浓度等于1×10-7 ml·L-1,则混合液中c(H+)+c(OH-)=2×10-7 ml·L-1,B正确;若HA为弱酸,HA部分电离,c(HA)>c(NaOH),反应后HA有剩余,则V1小于或等于V2也可使溶液呈酸性,C错误;由C分析可知:溶液要想呈碱性,则一定V1c(CH3COO-)>c(OH-)>c(H+)。
③根据c(CH3COOH)=eq \f(cNaOH·VNaOH,VCH3COOH)分析:a项,未用标准溶液润洗滴定管,造成标准溶液被稀释,消耗NaOH标准溶液的体积增大,造成醋酸浓度偏大;b项,标准溶液滴在锥形瓶外一滴,消耗NaOH标准溶液的体积增大,造成醋酸浓度偏大;c项,滴定前平视,滴定后俯视读数,消耗NaOH标准溶液的体积减小,造成醋酸浓度偏小;d项,待测液溅出锥形瓶外一滴,消耗NaOH标准溶液的体积减小,造成醋酸浓度偏小。指示剂
变色范围和pH
石蕊
甲基橙
酚酞
滴定序号
待测液体积/mL
所消耗盐酸标准液的体积/mL
滴定前
滴定后
消耗的体积
1
V
0.50
25.80
25.30
2
V
-
3
V
6.00
31.35
25.35
步骤
操作
c(NaOH)
洗涤
未用标准溶液润洗酸式滴定管
锥形瓶用待测溶液润洗
未用待测溶液润洗取用待测液的滴定管
锥形瓶洗净后瓶内还残留少量蒸馏水
取液
取碱液的滴定管尖嘴部分有气泡且取液结束前气泡消失
滴定
滴定完毕后立即读数,半分钟后颜色又变红
滴定前滴定管尖嘴部分有气泡,滴定后消失
滴定过程中振荡时有液滴溅出
滴定过程中,向锥形瓶内加少量蒸馏水
读数
滴定前仰视读数或滴定后俯视读数
滴定前俯视读数或滴定后仰视读数
相关学案
这是一份2024届高考化学一轮复习专题8第39讲滴定曲线和中和滴定的拓展应用能力学案,共21页。
这是一份鲁科版高考化学一轮复习第8章第42讲滴定曲线和中和滴定的拓展应用课时学案,共20页。
这是一份高考化学 考点46 酸碱中和滴定学案(含解析),共6页。学案主要包含了酸碱中和滴定,酸碱中和滴定中常见误差分析,酸碱中和滴定的拓展应用等内容,欢迎下载使用。









