



2024届高三化学高考备考一轮复习专题:元素周期表 元素周期律课件
展开导航•课标要求 1.认识元素性质与元素在周期表中位置的关系。2.结合有关数据和实验事实认识原子结构、元素性质呈周期性变化的规律,构建元素周期律。3.知道元素周期表的结构,了解同周期和同主族元素性质的递变规律。4.认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,知道原子核外电子排布呈现周期性变化是导致元素性质周期性变化的原因。5.知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期律(表)的应用价值。
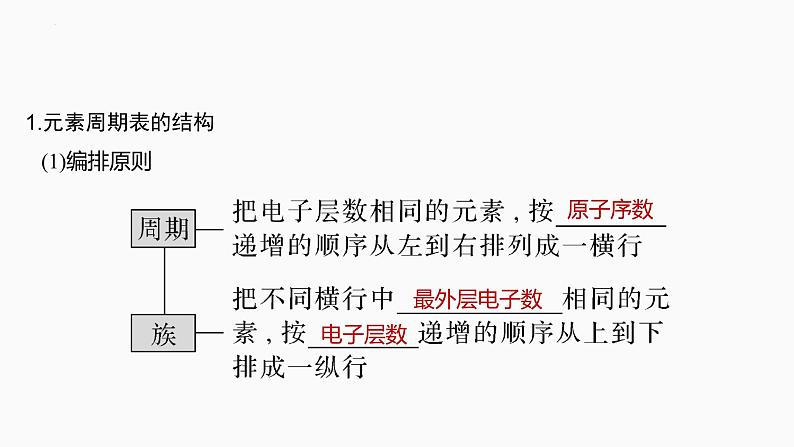
1.元素周期表的结构 (1)编排原则
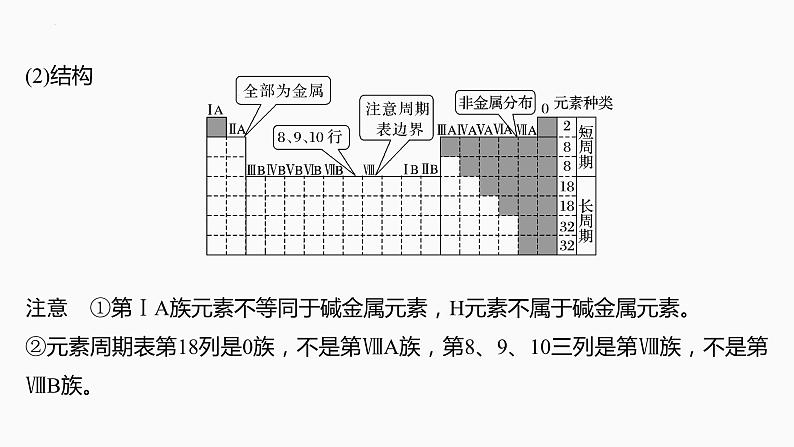
(2)结构注意 ①第ⅠA族元素不等同于碱金属元素,H元素不属于碱金属元素。②元素周期表第18列是0族,不是第ⅧA族,第8、9、10三列是第Ⅷ族,不是第ⅧB族。
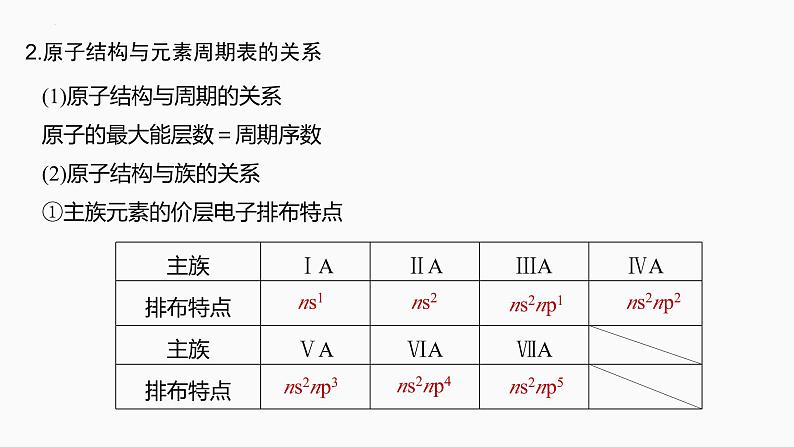
2.原子结构与元素周期表的关系
(1)原子结构与周期的关系原子的最大能层数=周期序数(2)原子结构与族的关系①主族元素的价层电子排布特点
②0族元素的价层电子排布:He为1s2;其他为ns2np6。③过渡元素(副族)的价层电子排布:(n-1)d1~10ns1~2。
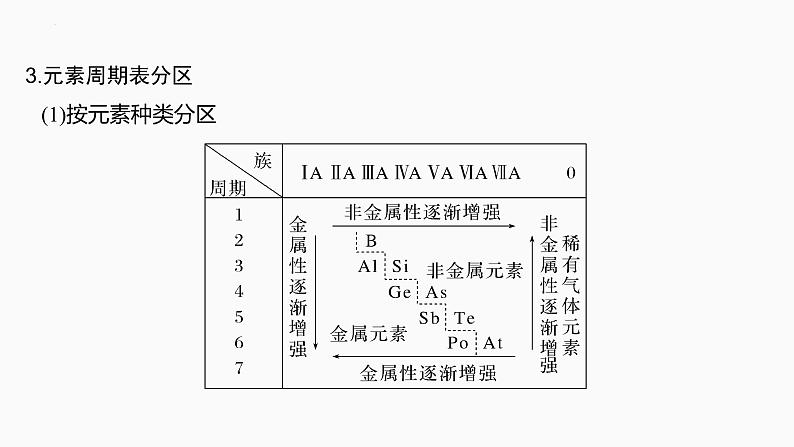
3.元素周期表分区 (1)按元素种类分区
a.分界线:沿着元素周期表中________________与____________________的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。b.各区位置:分界线左下方为____________,分界线右上方为______________。c.分界线附近元素的性质:既表现__________的性质,又表现____________的性质。
(2)按价层电子排布分区①元素周期表分区简图
②各区元素化学性质及价层电子的排布特点
4.元素周期表的三大应用
(1)科学预测:为新元素的发现及预测它们的原子结构和性质提供了线索。(2)寻找新材料
(3)用于工农业生产对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
【判一判】 正误判断(正确打“√”,错误打“×”)。
(1)包含元素种数最多的族是第ⅠA族。( )(2)原子的最外层有2个电子的元素一定是第ⅡA族元素。( )(3)价层电子排布式为5s25p1的元素位于第五周期第ⅠA族,是s区元素。( )(4)第ⅠA族元素都是碱金属元素,在化学反应中均易失去1个电子。( )(5)过渡元素都是金属元素,且均由副族元素组成。( )(6)两种短周期元素的原子序数相差8,则周期序数一定相差1。( )答案 (1)× (2)× (3)× (4)× (5)√ (6)√
1.长式周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有 气体元素为第18列。按这种规定,下列说法正确的是( ) A.第9列元素中没有非金属元素 B.只有第2列的元素原子最外层电子排布式为ns2 C.第四周期第9列元素是铁元素 D.第10、11列为ds区
2.部分元素在周期表中的分布如图所示(虚线为金属元素与非金属元素的分界线), 下列说法不正确的是( )
A.B只能得电子,不能失电子B.原子半径:Ge>SiC.As可作半导体材料D.P处于第六周期第ⅥA族
3.已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数 为a,则下列说法不正确的是( )
A.Y与Z的原子序数之和可能为2aB.Y的原子序数可能为a-17C.Z的原子序数可能为a+31D.X、Y、Z一定为短周期元素
原子核外电子排布
2.主族元素性质周期性变化的规律
(1)第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的__________,符号:I1,单位:________________。(2)规律①同周期:第一种元素的第一电离能______,最后一种元素的第一电离能______,总体呈现__________________的变化趋势。②同族元素:从上至下第一电离能__________。③同种原子:逐级电离能越来越____ (即I1____I2____I3…)。
(1)含义:元素的原子在化合物中______________能力的标度。元素的电负性越大,表示其原子在化合物中______________的能力越____。(2)标准:以最活泼的非金属元素氟的电负性为________作为相对标准,计算得出其他元素的电负性(稀有气体未计)。(3)变化规律金属元素的电负性一般______1.8,非金属元素的电负性一般______1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右。在元素周期表中,同周期从左至右,元素的电负性逐渐______,同主族从上至下,元素的电负性逐渐______。
(1)钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能。( )(2)C、N、O、F四种元素第一电离能从大到小的顺序是N>O>F>C。( )(3)元素的电负性越大,非金属性越强,第一电离能也越大。( )(4)元素的氧化物对应水化物的酸性越强,非金属性越强,碱性越强,金属性越强。( )
(5)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱。( )(6)元素的原子得电子越多,非金属性越强,失电子越多,金属性越强。( )(7)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小。( )答案 (1)× (2)× (3)× (4)× (5)× (6)× (7)×
题组一 元素周期律1.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的 电子层结构,由此可知( )
A.x的原子半径大于y的原子半径B.x的电负性小于y的电负性C.x的氧化性大于y的氧化性D.x的第一电离能小于y的第一电离能
2.X、Y是同周期的两种主族元素,它们的逐级电离能(I)数据如下表所示:
下列有关说法正确的是( )A.电负性:X>YB.与水反应剧烈程度:X
题组二 微粒半径及元素金属性或非金属性强弱的比较4.比较下列微粒半径的大小(用“>”或“<”填空):
(1)Na________Mg________Cl(2)Li________Na________K(3)Na+________Mg2+________Al3+(4)F-________Cl-________Br-(5)Cl-________O2-________Na+________Mg2+(6)Fe2+________Fe3+答案 (1)> > (2)< < (3)> >(4)< < (5)> > > (6)>
5.下列事实不能说明元素的金属性或非金属性相对强弱的是( )
6.下列实验不能达到实验目的的是( )
【课堂点拨】 1.微粒半径大小的判断方法
(1)一看电子层数:最外层电子数相同时,电子层数越多,半径越大。(2)二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小。(3)三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
2.元素金属性或非金属性强弱的判断方法
题组三 元素电离能和电负性的应用7.(1)C、N、O、S四种元素中,第一电离能最大的是________________。
(2)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是________(填元素名称)。几种镧系元素的电离能(单位: kJ·ml-1)答案 (1)N (2)镧
答案 (3)铜原子失去一个电子后,核外电子排布式为[Ar]3d10,而锌原子失去一个电子后的核外电子排布式变为[Ar]3d104s1,铜达到了较稳定状态,所以铜的第二电离能相对较大
8.已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给 出14种元素的电负性:
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是__________。(2)通过分析电负性值变化规律,确定镁元素电负性值的最小范围是________。答案 (1)随着原子序数的递增,元素的电负性呈周期性变化(2)0.9~1.5
(3)判断下列物质是离子化合物还是共价化合物:A.Li3N D.SiC属于离子化合物的是________;属于共价化合物的是________;请设计一个实验方案证明上述所得到的结论:________________________________________。(4)在P与Cl组成的化合物中,Cl元素显________(填“正”或“负”)价,理由是____________________________________________________________________。答案 (3)A BCD 测定各物质在熔融状态下能否导电,若导电则为离子化合物,反之则为共价化合物 (4)负 Cl的电负性大于P,Cl对键合电子的吸引能力强
(1)电离能的三大应用①判断元素金属性的强弱电离能越小,金属越容易失去电子,金属性越强;反之金属性越弱。②判断元素的化合价如果某元素的In+1In,则该元素的常见化合价为+n,如钠元素的I2I1,所以钠元素的化合价为+1。③判断核外电子的分层排布情况多电子原子中,元素的各级电离能逐渐增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
(2)电负性的三大应用
1.短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小,下列判断正确的是( ) A.XW3是非极性分子 B.简单氢化物沸点:X>Y C.Y与Z形成的化合物是离子化合物 D.X、Y、Z三种元素组成的化合物水溶液呈酸性
2.甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。 戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( )
A.原子半径:丁>戊>乙B.非金属性:戊>丁>丙C.甲的氢化物遇氯化氢一定有白烟产生D.丙的最高价氧化物对应的水化物一定能与强碱反应
1.依据元素在周期表中的位置推断元素
(1)元素周期表中短周期特殊结构的应用①元素周期表中第一周期只有两种元素H和He,H元素所在的第ⅠA族为元素周期表的左侧边界,第ⅠA族左侧无元素分布。②He为0族元素,0族元素为元素周期表的右侧边界,0族元素右侧没有元素分布。利用这个关系可以确定元素所在的周期和族。
(2)熟悉主族元素在周期表中的特殊位置
(3)依据元素在周期表中的位置,确定其化合物的化学式知道元素在周期表中的主族序数后,根据化合价规律就可以写出它的化合物的化学式,例如(用R代表元素):
2.依据元素原子结构推断元素 (1)最外层电子规律
(2)“阴三、阳四”规律某元素阴离子最外层电子数与次外层电子数相等,该元素位于第三周期;若为阳离子,则位于第四周期。例如,S2-、K+最外层电子数与次外层电子数相等,则S位于第三周期,K位于第四周期。(3)“阴上、阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。例如O2-、F-、Na+、Mg2+、Al3+电子层结构相同,则Na、Mg、Al位于O、F的下一周期。
3.依据元素及其化合物性质推断元素
1.X、Y为第三周期元素,Y最高正价与最低负价的代数和为6,二 者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是( ) A.原子半径:X>Y B.简单氢化物的还原性:X>Y C.同周期元素形成的单质中Y氧化性最强 D.同周期中第一电离能小于X的元素有4种
2.我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( ) A.原子半径大小顺序为W>X>Y>Z B.化合物XW中的化学键为离子键 C.Y单质的导电性能弱于Z单质的 D.Z的氧化物的水化物的酸性强于碳酸
3.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原 子的质子数是其M层电子数的三倍,下列说法不正确的是( )
2024届高三化学高考备考一轮复习专题化学键课件: 这是一份2024届高三化学高考备考一轮复习专题化学键课件,共60页。PPT课件主要包含了考点一化学键,非极性,带相反电荷离子,阳离子,静电作用,活泼金属,活泼非金属,共用电子对,2共价键的分类,不同种等内容,欢迎下载使用。
2024届高三化学高考备考一轮复习:元素周期表(律)与化学键课件: 这是一份2024届高三化学高考备考一轮复习:元素周期表(律)与化学键课件,共60页。PPT课件主要包含了核电荷数,核外电子数,质子数,ⅡA族,ns1~2,ns2np1~6,锕系除外,ⅡB族,元素周期律,电离能I等内容,欢迎下载使用。
2023届高三化学高考备考一轮复习元素周期律(表)和元素的性质课件: 这是一份2023届高三化学高考备考一轮复习元素周期律(表)和元素的性质课件,共60页。PPT课件主要包含了命题方向,模型建构,思路-方法-技巧,考题预测,教学策略,OSi,SiH4HCl,小结常考题型有等内容,欢迎下载使用。












