

所属成套资源:2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册)
- 第14讲 Fe、铁的氧化物-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
- 第15讲 Fe(OH)2、Fe(OH)3、铁盐-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
- 第17讲 原子结构与元素周期表-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
- 第18讲 元素周期律-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
- 第19讲 化学键-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
第16讲 金属材料-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册)
展开
这是一份第16讲 金属材料-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册),共20页。试卷主要包含了合金,常见金属材料等内容,欢迎下载使用。
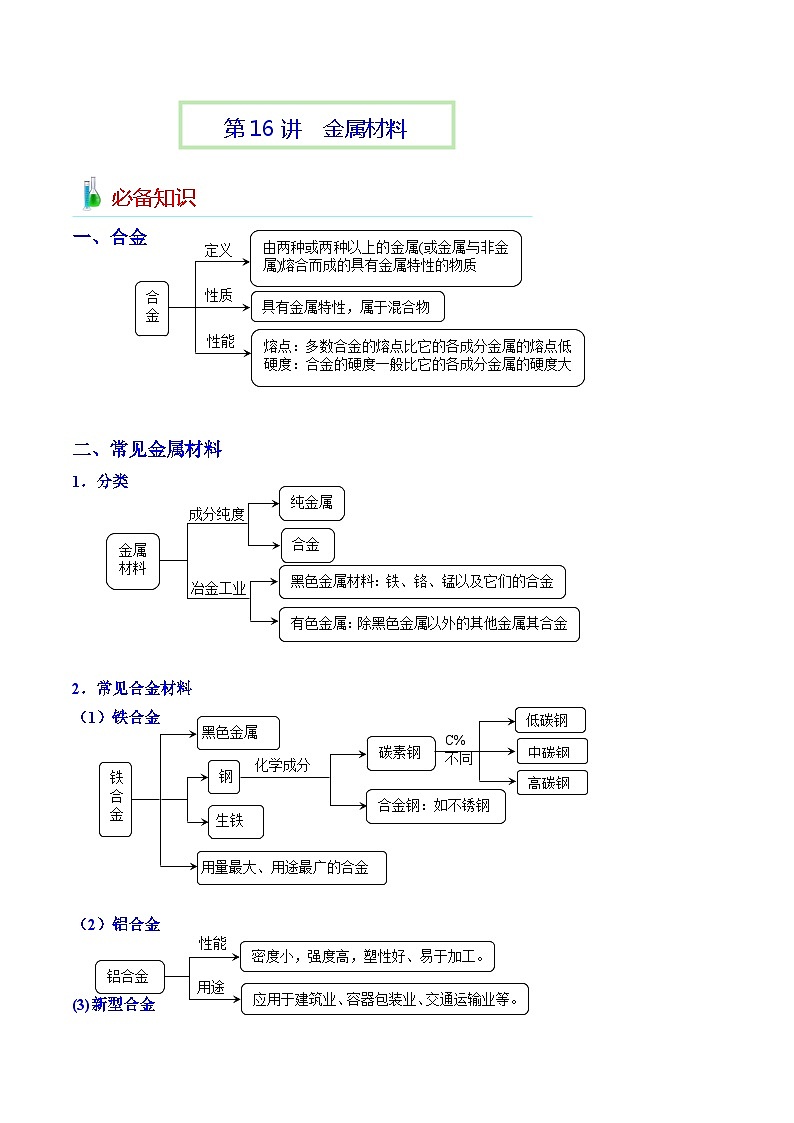
第16讲 金属材料
必备知识
合
金
性质
定义
性能
由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质
具有金属特性,属于混合物
熔点:多数合金的熔点比它的各成分金属的熔点低
硬度:合金的硬度一般比它的各成分金属的硬度大
一、合金
二、常见金属材料
金属
材料
成分纯度
冶金工业
合金
纯金属
有色金属:除黑色金属以外的其他金属其合金
黑色金属材料:铁、铬、锰以及它们的合金
1.分类
2.常见合金材料
铁
合
金
黑色金属
钢
用量最大、用途最广的合金
生铁
化学成分
碳素钢
合金钢:如不锈钢
C%
不同
高碳钢
中碳钢
低碳钢
(1)铁合金
(2)铝合金铝合金
性能
用途
密度小,强度高,塑性好、易于加工。
应用于建筑业、容器包装业、交通运输业等。
(3)新型合金
新型合金
形状记忆合金
耐热合金
钛合金
储氢合金
La-Ni合金
Ti-Fe合金
三、铝
1.铝的结构和存在
Al
第3周期ⅢA族
原子结构
示意图
地壳中含量最多的金属元素
自然界中以化合态的形式存在
失去3e-
具有强还原性
结 定
构 性
决 质
导电导热性
良好
延展性
良好
硬度
质地柔软
颜色状态
银白色固体
密度
2.7g·cm-3
Al的物理性质
地壳含量
居第3位
2.铝的物理性质
(3)铝的化学性质
Al
非金属
单质
Cl2
S
O2
Al+3O22Al2O3
2Al+3Cl22AlCl3
2Al+3SAl2S3
NaOH溶液
浓硫酸
浓硝酸
氧化性酸
2Al + 6H+ == 2Al3+ + 3H2↑
非氧化性酸
稀盐酸、稀硫酸
酸
电解熔融Al2O3制备Al:
Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O
常温:钝化;加热:生成SO2、NO2
稀硝酸
铝热反应:2Al+Fe2O3Al2O3+2Fe
铝热剂:铝与难熔金属氧化物形成的混合物
难熔金属氧化物
如:Fe2O3
2Al + 3Hg(NO3)2 = 2Al(NO3)3 + 3Hg
某些盐溶液
Hg(NO3)2溶液
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
工业制备金属铝
物理
性质
Al2O3
常用作耐火材料及冶炼金属铝的原料。
与NaOH反应:Al2O3+2NaOH=2NaAlO2+H2O
与HCl反应:Al2O3+6HCl=2AlCl3+3H2O
白色固体,难溶于水,有很高的熔点。
用途
两性
氧化物
2.铝的重要化合物
(1)氧化铝
物理性质
和用途
Al(OH)3
2Al(OH)3Al2O3+3H2O
与NaOH反应:Al(OH)3+NaOH=NaAlO2+2H2O
与HCl反应:Al(OH)3+3HCl=AlCl3+3H2O
白色胶状不溶于水的固体,有较强的吸附性,常用作净水剂。
不稳定性
两性
氢氧化物
(酸式)AlO+H2O+H+⇌Al(OH)3⇌ Al3++3OH-(碱式)
(2)氢氧化铝
易混易错点
一、与合金有关的易混易错点
1.构成合金的成分不一定是两种或两种以上的金属,也可以是金属与非金属,合金中一定含金属元素。合金一定是混合物。
2.常温下,多数合金是固态,但钾、钠合金呈液态。
3.合金的性质不是各成分金属的性质之和。合金具有许多良好的物理、化学和机械性能,在许多方面不同于各成分金属,不是简单加和;但在化学性质上,一般认为合金体现的是各成分金属的化学性质。
4.合金的两个特点:熔点较低,硬度较大。
①常温下,多数合金是固体,但钠钾合金是液体。
②合金的物理性质相比于成分金属有所改变,但合金中各成分金属的化学性质仍然不变。
5.并非所有的金属都能形成合金,两种金属形成合金,其前提是两种金属在同一温度范围内都能熔化,若一种金属的熔点大于另一种金属的沸点,则二者不能形成合金。
二、与铝及化合物有关的易混易错点
1.能与铝反应生成H2的溶液,可能是酸性溶液,也可能是碱性溶液。
2.等质量的铝与足量的酸或碱溶液反应,生成H2的量相同。
3.等物质的量的酸和碱与足量的铝反应,生成H2的量由酸和碱的物质的量决定。
4.铝热反应的三个注意事项
①铝热反应是在高温干态下进行的置换反应,铝只能与金属活动性顺序中排在铝之后的金属的氧化物反应。
②铝热反应会放出大量的热(这一特性常出现在推断题中)。Mg条、KClO3的作用是产生高温,引发铝热反应。
③铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
5.镁、铝的特殊化学性质
①铝是活泼金属,但抗腐蚀性能强,原因是常温下Al与O2反应生成一层致密的氧化物薄膜而防止内部金属进一步被氧化。铝能与酸(H+)反应,是属于活泼金属的通性;铝能与碱溶液反应,是铝表现出来的特殊性。
②铝与某些金属氧化物可发生铝热反应,铝热反应可用于焊接金属、冶炼高熔点的贵重金属,但Al与MgO不能发生铝热反应,原因是Mg的活泼性强于Al。
③镁在空气中燃烧除了与O2反应产生MgO外,还与N2反应产生Mg3N2,与CO2反应生成C和MgO。
④由于Mg能够在CO2中燃烧,所以镁着火时不能用干冰灭火器和泡沫灭火器灭火。
6.铝与酸、碱反应生成氢气的量的关系
①等物质的量的Al分别与足量的非氧化性酸(H+)和碱(OH-)反应,生成H2的物质的量之比为1︰1,消耗H+和OH-的物质的量之比为3︰1。
②足量的Al分别与含等物质的量的H+和OH-的溶液反应,生成H2的物质的量之比为1︰3。
③等质量的铝分别与等物质的量的强酸和强碱溶液反应,若两种反应产生H2的体积之比为Mg=Al
(4) 2Al+2OH-+2H2O=2+3H2↑ 1:1 11.2L
【分析】
(1)
钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑。
(2)
取0.1mol钠、铁、铝与足量的盐酸反应,分别发生反应:、和,则分别产生氢气0.05mol、0.1mol、0.15mol,在相同条件下产生氢气的物质的量之比等于其体积比是1:2:3。
(3)
分别取金属钠、铁、铝0.2mol,分别投入10mL1mol·L-1盐酸中,由方程式可知,HCl少量,但多余的钠与水反应生成氢氧化钠和氢气,故钠产生的氢气最多、铁和铝产生的氢气相等,则在标准状况下产生氢气的体积大小的顺序是Na>Mg=Al。
(4)
①把10.2g镁铝合金的粉末放入过量的烧碱中,镁不与氢氧化钠溶液反应、铝与氢氧化钠溶液反应:,则铝与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2+3H2↑。
②由于反应得到6.72LH2(标准状况下),即 0.3mol H2。由知:合金中含0.2mol Al、其质量为0.2mol ×27g/mol=5.4g,则10.2g合金中含镁为10.2g- 5.4g=4.8g、其物质的量为 ,则合金中镁与铝的物质的量之比为1:1。
③该合金溶于足量的盐酸溶液中,发生和,则0.2mol Mg和0.2mol Al共产生0.5mol H2、其体积(标准状况下)为22.4L/mol×0.5mol =11.2L。
14.铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计以下实验方案进行探究。填写下列空白。
〖实验方案〗
将w g铝镁合金与足量NaOH溶液反应,测定生成气体折算为标准状况的体积。
〖问题讨论〗
(1)同学们拟选用下列实验装置完成实验:
①你认为最简易的装置其连接顺序是:______A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后NaOH溶液也不能顺利滴入锥形瓶。请你帮助分析原因___________。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是___________。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:NaOH溶液滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
① 装置中导管a的作用是___________。
②实验前后滴定管中液面差为VmL,则w g该样品中镁的质量分数为___________(用含w、V的代数式表示)。
【答案】(1)①EDG ② 镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大 ③ ACD (2) ① 使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差 ②
【解析】
(1)①装置的组装顺序:合金与酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
②镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大,导致硫酸不能顺利滴入锥形瓶;
③反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积;故选ACD;
(2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,,则样品中Al的质量为,则Al的质量分数为m/w×100%=,则样品中镁的质量分数为。
15.物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
(1)写出下列物质的化学式:A_______,D_______,K_______。
(2)写出反应“C→F”的离子方程式:_______。
(3)写出反应“F→G”的化学方程式:_______。
(4)写出反应“I→J”的离子方程式:_______
(5)在溶液I中滴入NaOH溶液,可观察到的现象是_______。
【答案】(1)Al H2 Fe(OH)3 (2) (3) (4) 2Fe2++Cl2=2Fe3++2Cl- (5) 产生白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀。
【分析】
K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,所以H为Fe,D应为H2,E应为Cl2,B为HCl,则I为FeCl2,J为FeCl3,K为Fe(OH)3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3。据此解答。
【解析】
(1)根据以上分析可知A是Al,D是H2,K是Fe(OH)3;
(2) C为AlCl3,F为Al(OH)3,AlCl3与氨水反应生成Al(OH)3,反应“C→F”的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH;
(3) F为Al(OH)3,G为NaAlO2,向A中加入氢氧化钠溶液生成G,反应“F→G”的化学方程式:Al(OH)3+NaOH=NaAlO2+2H2O;
(4) I为FeCl2,J为FeCl3,氯气将二价铁离子氧化为三价铁离子,反应“I→J”的离子方程式:2Fe2++Cl2=2Fe3++2Cl-;
(5)FeCl2中滴入NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+4H2O=4Fe(OH)3。因此实验现象是先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀。
16.准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示。试回答下列问题:
(1)当加入NaOH溶液的体积超过35mL时所发生的反应的离子方程式_____。
(2)铝土矿中Al2O3的物质的量是多少?______
(3)若a=2.6,稀硫酸溶液的物质的量浓度为多少?______
【答案】
(1)
(2)0.05mol
(3)1.75mol/L
【分析】
(1)当加入NaOH溶液的体积超过35mL时,沉淀量减少,说明氢氧化铝和氢氧根离子反应生成偏铝酸根离子和水,所发生的反应的离子方程式为 。
(2)由反应消耗氢氧化钠的物质的量为0.1mol,可知铝元素的物质的量为0.1mol,铝土矿中Al2O3的物质的量是0.05mol;
(3)由图象可知,加入35ml氢氧化钠溶液时,溶液中的溶质为硫酸钠,根据钠元素守恒,可知硫酸钠的物质的量为0.175mol;根据硫守恒,稀硫酸溶液中硫酸的物质的量为0.175mol,硫酸的物质的量浓度为。
相关试卷
这是一份第19讲 化学键-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册),共31页。试卷主要包含了化学键,离子键离,共价键,共价键分类,电子式,离子化合物与共价化合物的比较,化学键类型与物质类别的判断,化学键对物质性质的影响等内容,欢迎下载使用。
这是一份第14讲 Fe、铁的氧化物-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册),共27页。试卷主要包含了8g·cm-3,5n=0,2gB.5等内容,欢迎下载使用。
这是一份第11讲 氯气的制备及氯离子检验-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册),共17页。试卷主要包含了实验室制取Cl2的实验原理,常见的气体制备的系列装置, Cl-的检验等内容,欢迎下载使用。