






鲁科版 (2019)选择性必修1第1节 化学反应的方向教学演示ppt课件
展开☞突破1 化学平衡移动与转化率
利用勒·夏特列原理解释平衡移动方向和转化率高低是高考的重点内容。典例1 (2022全国甲卷,28)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1 000 ℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g) ΔH1=172 kJ·ml-1,Kp1=1.0×10-2(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g) ΔH2=-51 kJ·ml-1, Kp2=1.2×1012 Pa①反应2C(s)+O2(g)═2CO(g)的ΔH为 kJ·ml-1,Kp= Pa。②碳氯化的反应趋势远大于直接氯化,其原因是 。 ③对于碳氯化反应:增大压强,平衡 (填“向左”“向右”或“不”)移动;温度升高,平衡转化率 (填“变大”“变小”或“不变”)。
C与O2反应生成CO的平衡常数很大,可推动TiO2直接氯化反应平衡向生成TiCl4方向移动
解析 本题考查盖斯定律的应用、平衡常数的计算、外界条件对平衡和转化率的影响等。①由盖斯定律可知,反应(ⅱ)-反应(ⅰ)可得2C(s)+O2(g)═2CO(g) ΔH=-51 kJ·ml-1-172 kJ·ml-1=-223 kJ·ml-1。
②C与O2反应生成CO的平衡常数很大,可推动TiO2直接氯化反应平衡向生成TiCl4方向移动,故碳氯化的反应趋势大于直接氯化。③碳氯化反应中,正向反应为气体分子数增大的放热反应,依据勒·夏特列原理,增大压强,平衡向左移动;升高温度,平衡向左移动,平衡转化率减小。
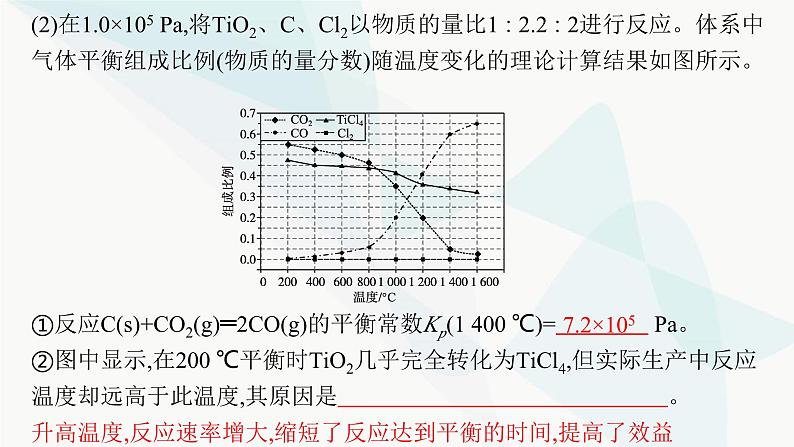
(2)在1.0×105 Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应C(s)+CO2(g)═2CO(g)的平衡常数Kp(1 400 ℃)= Pa。 ②图中显示,在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是 。
升高温度,反应速率增大,缩短了反应达到平衡的时间,提高了效益
解析 ①根据图像可知,1 400 ℃时CO2、CO的组成比例分别为0.05、0.6,
②实际生产中反应温度高于200 ℃,原因是升高温度,反应速率增大,缩短了反应达到平衡的时间,可以达到最佳效益。
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2-C“固—固”接触的措施是 。
将固体TiO2和C粉碎并充分混合
解析 将固体TiO2和C粉碎并充分混合,可增大反应物间的接触面积。
规律方法 1.化学平衡移动的判断方法(1)依据勒·夏特列原理判断。通过比较改变条件瞬时的正、逆反应速率的相对大小来判断平衡移动的方向。①若外界条件改变,引起v(正)>v(逆),则化学平衡向正反应方向(或向右)移动;②若外界条件改变,引起v(正)
2.转化率大小变化分析判断反应物转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况具体分析。常见有以下几种情形:
【变式训练1-1】CH4-CO2催化重整反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·ml-1。有利于提高CH4平衡转化率的条件是( )A.高温低压B.低温高压C.高温高压D.低温低压
解析由于题给反应正向为吸热且气体体积增大的反应,要提高CH4的平衡转化率,需在高温低压下进行。
【变式训练1-2】(2021广东化学,14)反应X==2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )A.a为c(X)随t的变化曲线B.t1时,c(X)=c(Y)=c(Z)C.t2时,Y的消耗速率大于生成速率D.t3后,c(Z)=2c0-c(Y)
解析 本题考查化学反应速率与化学平衡。从①②步反应中X、Y、Z的量的关系可知,a表示X的浓度变化,A项正确;t1时,X、Y、Z浓度交于同一点,B项正确;t2时反应未达到平衡,Y的浓度处于下降趋势,C项正确;t3时X已完全反应,则c(Y)+ =c0,则c(Z)=2[c0-c(Y)],D项错误。
☞突破2 化学平衡常数(K)及转化率(α)的计算
化学平衡常数(K)及转化率(α)的计算是高考的重点、热点和难点,主要涉及温度一定时浓度平衡常数和压强平衡常数的计算。
典例2 (2022全国乙卷,28节选)油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)在1 470 K、100 kPa反应条件下,将n(H2S)∶n(Ar)=1∶4的混合气进行H2S热分解反应:2H2S(g)═S2(g)+2H2(g)的ΔH=+170 kJ·ml-1。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为______,平衡常数Kp=_____kPa。
解析 设起始时H2S的物质的量为1 ml,平衡时消耗H2S的物质的量为x ml,则
(2)在1 373 K、100 kPa反应条件下,对于n(H2S)∶n(Ar)分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。
①n(H2S)∶n(Ar)越小,H2S平衡转化率 ,理由是 。 ②n(H2S)∶n(Ar)=1∶9对应图中曲线 ,计算其在0~0.1 s之间,H2S分压的平均变化率为 kPa·s-1。
等温等压下加入惰性气体,平衡向气体分子数增加的方向移动
(2)①H2S分解的反应是气体分子数增大的反应,因此等温等压下加入惰性气体,平衡向气体分子数增加的方向移动,即H2S的平衡转化率越大。②由图像和转化率大小关系可知,曲线a、b、c、d、e分别表示n(H2S)∶n(Ar)为4∶1、1∶1、1∶4、1∶9和1∶19时的H2S转化率与时间的关系,因此n(H2S)∶n(Ar)=1∶9对应的是曲线d。设起始时H2S的物质的量为1 ml,则Ar的物质的量为9 ml,由题图可知,当0.1 s时H2S的转化率为24%,则 2H2S(g) S2(g)+2H2(g)起始/ml1 0 0转化/ml0.24 0.12 0.240.1 s/ml0.76 0.12 0.24
则0.1 s时气体的总物质的量为0.76 ml+0.12 ml+0.24 ml+9 ml=10.12 ml。起始时,H2S的分压为100 kPa×0.1=10 kPa,0.1 s时H2S的分压为100 kPa× ≈7.51 kPa,即变化值约为2.49 kPa,则变化率为24.9 kPa·s-1。
3.压强平衡常数计算的一般步骤
【变式训练2-1】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
下列说法正确的是( )A.上述生成Ni(CO)4(g)的反应为吸热反应B.25 ℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为0.5 ml3·L-3C.在某条件下达到平衡,测得Ni(CO)4、CO的浓度均为0.5 ml·L-1,则此时温度高于80 ℃D.80 ℃时,在相同容器中充入0.3 ml CO和0.3 ml Ni(CO)4,同时加入足量Ni,此时v(正)>v(逆)
【变式训练2-2】(1)活性炭还原NO2的反应为2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 ml NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图1所示,C点时该反应的平衡常数Kp=_____MPa (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(2)以CO作为还原剂与磷石膏(主要成分为CaSO4·2H2O)反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,反应体系起始总压强为0.1a MPa,不同温度下反应后所得固态物质的物质的量如图2所示。在低于800 ℃时主要反应的化学方程式为 ;1 150 ℃下,反应CaSO4+CO CaO+CO2+SO2达到平衡时,c平(SO2)=8.0×10-5 ml·L-1, CO的转化率为80%,则c始(CO)= ml·L-1,该反应的压强平衡常数Kp= Mpa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
解析(1)Kp的表达式为Kp= ,先计算平衡时,混合气体中各组分的物质的量分数,设平衡时NO2的变化量为x ml,则 2NO2(g)+2C(s) N2(g)+2CO2(g)起始/ml 1 0 0变化/ml x 0.5x x平衡/ml 1-x 0.5x x平衡时物质的量分数
由于C点时c(NO2)=c(CO2),即1-x=x,解得x=0.5。把x=0.5代入上述物质的量分数算式中,得到NO2、N2、CO2的物质的量分数分别为0.4、0.2、0.4,由于NO2与CO2的物质的量分数相等,故p(CO2)=p(NO2),
突破3 常见的化学反应速率、化学平衡图像分析
1.速率—时间图像反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
(1)t1时增大反应物的浓度,正反应速率瞬间增大,然后逐渐减小,而逆反应速率逐渐增大;(2)t2时升高温度,正反应和逆反应速率均增大,吸热反应的反应速率增大得快;(3)t3时减小压强,容器容积增大,浓度变小,正反应速率和逆反应速率均减小,正反应的反应速率减小得多;(4)t4时使用催化剂,正反应速率和逆反应速率均瞬间增大但仍相等。
2.转化率(或含量)—时间图像反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
(1)图甲表示压强对反应物转化率的影响,对于气体反应物系数之和大于气体反应产物系数之和的反应,压强越大,反应物的转化率越大;(2)图乙表示温度对反应物转化率的影响,对于吸热反应,温度越高,反应物的转化率越大;(3)图丙表示催化剂对反应物转化率的影响,催化剂只能改变化学反应速率,不能改变反应物的转化率。
3.恒压(温)线反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
分析时可沿横轴作一条平行于纵轴的虚线,即为等压线或等温线,然后分析另一条件变化对该反应的影响。
4.特殊类型图像(1)对于化学反应mA(g)+nB(g) pC(g)+qD(g),如下图所示,M点前,表示从反应物开始,v(正)>v(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应ΔH<0。
(2)对于化学反应mA(g)+nB(g) pC(g)+qD(g),如下图所示,L线上所有的点都是平衡点。L线的左上方(E点),A的百分含量大于此压强时平衡体系的A的百分含量,所以E点v(正)>v(逆);则L线的右下方(F点),v(正)
规律方法 解答化学平衡图像题的四步骤
【变式训练3-1】(2021湖南卷,16节选)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 ml NH3通入3 L 的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)= ml·L-1·min-1(用含t1的代数式表示);
解析 根据题图可知,从反应达平衡时(即t1时),氨气和氢气的分压都为1.2×100 kPa,氮气的分压为0.4×100 kPa,列三段式为: 2NH3 N2+3H2 总压起始/ml0.100200 kPa转化/ml2nn3n平衡/ml0.1-2nn3n(1.2+1.2+0.4)×100 kPa
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是 (用图中a、b、c、d表示),理由是 ;
t2时刻,将容器的容积迅速缩小为原来的一半,则所有气体的分压突然增大为原平衡时的2倍,则N2的分压突变为0.8×100 kPa,之后平衡逆向移动,氮气的分压减小
解析 t2时刻,将容器的容积迅速缩小为原来的一半,则所有气体的分压突然增大为原平衡时的2倍,则N2的分压突变为0.8×100 kPa,之后平衡逆向移动,氮气的分压减小,所以符合条件的曲线为b。
(3)在该温度下,反应的标准平衡常数Kθ= 。
【变式训练3-2】探究CH3OH合成反应中化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·ml-1Ⅱ.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.4 kJ·ml-1Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+40.9 kJ·ml-1回答下列问题:
(1)不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。
T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响
解析 从图乙中看到在T1时,p不同时三条曲线交于一点,说明压强的改变对平衡无影响。而反应Ⅲ前后分子数不变,反应以Ⅲ为主,所以升高温度平衡向正方向移动,CO2的转化率升高。图乙纵坐标表示CO2的平衡转化率,图甲纵坐标表示CH3OH的平衡产率,反应Ⅰ、Ⅱ都是体积减小的反应,增大压强平衡向正反应方向移动,故p1>p2>p3。
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填字母)。 A.低温、高压B.高温、低压C.低温、低压D.高温、高压
解析 由反应的方程式可知,低温、高压可提高CO2的平衡转化率和CH3OH的平衡产率。
【变式训练3-3】298 K时,将20 mL 3x ml·L-1 Na3AsO3溶液、20 mL 3x ml·L-1I2溶液和20 mL NaOH溶液混合,发生反应:
(1)下列可判断反应达到平衡的是 (填字母)。
鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率本章综合与测试评课ppt课件: 这是一份鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率本章综合与测试评课ppt课件,共28页。PPT课件主要包含了双基夯实·课前排查,核心突破·要点讲解,夯实基础·一遍落实,答案A,答案AD等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向教课内容课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向教课内容课件ppt,共28页。PPT课件主要包含了目录索引,必备知识,自我检测等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向作业课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向作业课件ppt,共23页。













