





还剩32页未读,
继续阅读
所属成套资源:全套人教版高中化学必修第二册课时教学课件
成套系列资料,整套一键下载
人教版高中化学必修第二册第六章本章总结6教学课件
展开
这是一份人教版高中化学必修第二册第六章本章总结6教学课件,共40页。
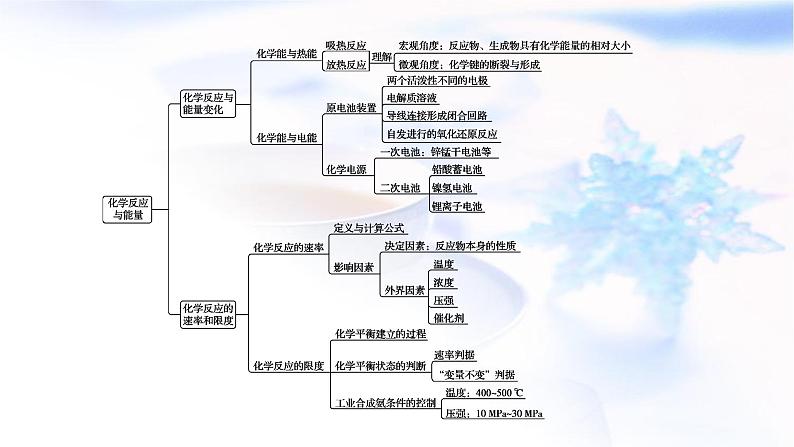
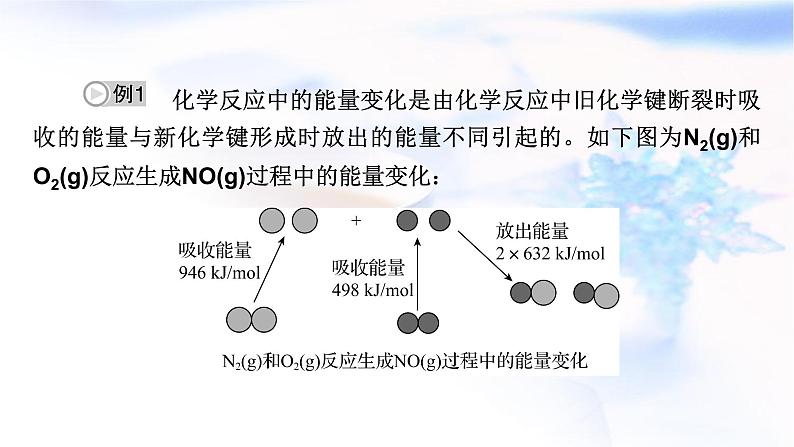
第六章 化学反应与能量本章总结构建·知识网络总结·专题提升1.化学键的断裂与形成是化学反应中能量变化的主要原因(1)化学反应的本质是旧化学键的断裂和新化学键的形成。(2)化学键断裂要吸热,化学键形成要放热。吸收的热量和放出的热量数值不相等就形成了热效应。(3)反应物与生成物的能量差若以热能形式表现,即为放热或吸热。若二者能量比较接近,则放热或吸热不明显。化学键与化学反应中的能量变化3.化学反应中能量变化的计算(1)用E(反应物)表示反应物的总能量,E(生成物)表示生成物的总能量,ΔQ表示能量变化,则ΔQ=E(生成物)-E(反应物)。(2)用Q(吸)表示反应物化学键断裂时吸收的总能量,Q(放)表示生成物化学键形成时放出的总能量,ΔQ表示能量变化,则ΔQ=Q(吸)-Q(放)。 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是 ( )A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJB.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量C.通常情况下,N2(g)和O2(g)混合能直接生成NOD.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水【答案】B 【解析】根据图示可以看出拆开1 mol N2和1 mol O2需要吸收的能量分别为946 kJ和498 kJ,生成2 mol NO(g)放出的能量=2 mol×632 kJ/mol,故反应吸收能量为180 kJ,A错误。N2和O2的反应是吸热反应,反应物的总能量小于生成物的总能量,B正确。N2与O2在高压放电时才能化合生成NO,C错误。NO不是酸性氧化物,不能与NaOH溶液反应,D错误。原电池电极反应式的书写1.电极反应式的书写(1)原电池负极反应式的书写。①较活泼金属作负极时,电极本身被氧化。若生成的阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,如Zn-2e-===Zn2+,Cu-2e-===Cu2+。②负极本身不反应。氢氧(酸性)燃料电池,负极反应为H2-2e-===2H+;氢氧(碱性)燃料电池,负极反应为H2+2OH--2e-===2H2O。(2)原电池正极反应式的书写。书写时总的原则是首先根据化合价变化或氧化性强弱判断得电子的微粒;其次确定该微粒得电子后生成什么物质。如氢氧(酸性)燃料电池,正极反应为O2+4H++4e-===2H2O;氢氧(碱性)燃料电池,正极反应为O2+2H2O+4e-===4OH-。(3)书写复杂电极反应式的方法——加减法。①写出总反应。如Li+LiMn2O4===Li2Mn2O4。②写出其中容易写出的一个半反应(正极或负极)。如Li-e-===Li+(负极)。③利用总反应与上述的一极反应相减,即得另一个电极的反应式,即LiMn2O4+Li++e-===Li2Mn2O4(正极)。 微型银—锌电池可用作电子仪器的电源,其电极分别是Ag/Ag2O和Zn,电解质为KOH溶液,电池总反应为Ag2O+Zn+H2O ===2Ag+Zn(OH)2,下列说法正确的是 ( )A.电池工作过程中,KOH溶液浓度降低B.电池工作过程中,电解液中OH-向正极迁移C.负极发生反应Zn+2OH--2e-===Zn(OH)2D.正极发生反应Ag2O+2H++2e-===2Ag+H2O【答案】C 【解析】根据题给总反应方程式可知,KOH没有消耗,但消耗H2O,故浓度增大,A错误;原电池中,阴离子向负极定向移动,B错误;负极金属Zn放电,生成Zn(OH)2,C正确;Ag2O在正极发生反应,电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,D错误。(1)计算模式。设a mol·L-1、b mol·L-1分别为A、B两物质的起始浓度,mx mol·L-1为反应物A的转化浓度,nx mol·L-1为反应物B的转化浓度,则: “三段式”法在化学反应速率计算中的应用(2)基本步骤。①确定反应物或生成物的起始加入量;②确定反应过程中各物质浓度的变化量;③确定反应进行至某时刻时各物质的量;④依据题干中的条件建立等式关系进行解答;⑤应用化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之比进行解答。 X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y2Z。达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )【答案】B 典练·素养提升素养解读 能量是现代社会人类一切活动的基础,而许多能量变化都与化学反应密切相关。通过本章内容的学习,能帮助我们逐步培养宏观辨识与微观探析、变化观念与平衡思想、科学探究与创新意识、科学态度与社会责任等方面的学科核心素养。关于此反应说法错误的是 ( )A.一定属于吸热反应 B.一定属于可逆反应C.一定属于氧化还原反应 D.一定属于分解反应【答案】A 【解析】观察示意图知该反应的反应物是一种,生成物是两种,该物质发生分解反应,一般的分解反应是吸热反应,但也有的分解反应如2H2O2===2H2O+O2↑的反应是放热反应,A错误,D正确;根据图示可知有一部分反应物未参加反应,所以该反应是可逆反应,B正确;该反应中反应物为化合物,生成物中有单质,元素化合价有变化,属于氧化还原反应,C正确。2.(变化观念与平衡思想)“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O===2Mg(OH)2 。下列关于该电池的说法错误的是 ( )A.镁片作为正极B.食盐水作为电解质溶液C.电池工作时镁片逐渐被消耗D.电池工作时实现了化学能向电能的转化【答案】A 【解析】根据原电池原理镁为负极发生氧化反应;氧气在正极发生还原反应。3.(科学态度与社会责任)一种“即食即热型快餐”适合外出旅行时食用。其内层是用铝箔包裹并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质混合并发生反应,此时便可对食物进行加热,这两包化学物质最合适的选择是 ( )A.浓硫酸与水 B.生石灰与水C.熟石灰与水 D.氯化钠与水【答案】B 【解析】浓硫酸溶于水虽然放热,但浓硫酸是液体,又具有强烈的腐蚀性,不适宜给食品加热;而相同质量的生石灰和熟石灰分别溶于水,前者放出的热量比后者多;氯化钠溶于水能量变化不明显。4.(变化观念与平衡思想)化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是 ( )A.化学反应中能量变化的主要原因是化学键的断裂与生成B.铝热反应中,反应物的总能量比生成物的总能量低C.图Ⅰ所示的装置能将化学能转变为电能D.图Ⅱ所示的反应为吸热反应【答案】A 【解析】铝热反应是放热反应,所以反应物的总能量比生成物的总能量高,B错误;图Ⅰ所示的装置中没有形成闭合回路,不能构成原电池,因此不能将化学能转变为电能,C错误;图Ⅱ所示的反应中反应物的总能量高于生成物的总能量,为放热反应,D错误。5.(变化观念与平衡思想)化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是 ( )A.Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加B.正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-C.锌筒作负极,发生氧化反应,锌筒会变薄D.使用一段时间后,电解质溶液的酸性减弱,导电能力下降【答案】A下列说法能说明A、B容器均达到平衡状态的是________(填字母序号)。a.A、B容器中气体的颜色均不发生变化b.A、B容器中NO和O2物质的量浓度比均为2∶1c.A、B容器中气体的密度不再发生变化d.A、B容器中气体的平均摩尔质量不再发生变化【答案】ad 【解析】NO和O2无颜色,NO2为红棕色气体,因此当气体颜色不再改变,说明反应达到平衡,a正确;NO和O2的量按照化学反应方程式系数比投入,任何时刻NO和O2物质的量浓度比均为2∶1,因此不能说明反应达到平衡,b错误;组分都是气体,气体质量不变,A为恒容状态,气体体积不变,A容器中,密度不变,不能说明反应达到平衡,c错误;该反应为非等体积反应且无状态变化,且建立平衡过程中平均摩尔质量发生改变,故当气体平均摩尔质量不变时,说明反应达到平衡,d正确。(2)某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:①该反应的化学方程式为_____________________________。②若X、Y、Z均为气体,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为________。③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时________(填“增大”“减小”或“相等”)。【答案】(1)0.16 mol·L-1·min-1 61.5%(2)①3X+Y2Z ②9∶10 ③增大
第六章 化学反应与能量本章总结构建·知识网络总结·专题提升1.化学键的断裂与形成是化学反应中能量变化的主要原因(1)化学反应的本质是旧化学键的断裂和新化学键的形成。(2)化学键断裂要吸热,化学键形成要放热。吸收的热量和放出的热量数值不相等就形成了热效应。(3)反应物与生成物的能量差若以热能形式表现,即为放热或吸热。若二者能量比较接近,则放热或吸热不明显。化学键与化学反应中的能量变化3.化学反应中能量变化的计算(1)用E(反应物)表示反应物的总能量,E(生成物)表示生成物的总能量,ΔQ表示能量变化,则ΔQ=E(生成物)-E(反应物)。(2)用Q(吸)表示反应物化学键断裂时吸收的总能量,Q(放)表示生成物化学键形成时放出的总能量,ΔQ表示能量变化,则ΔQ=Q(吸)-Q(放)。 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是 ( )A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJB.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量C.通常情况下,N2(g)和O2(g)混合能直接生成NOD.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水【答案】B 【解析】根据图示可以看出拆开1 mol N2和1 mol O2需要吸收的能量分别为946 kJ和498 kJ,生成2 mol NO(g)放出的能量=2 mol×632 kJ/mol,故反应吸收能量为180 kJ,A错误。N2和O2的反应是吸热反应,反应物的总能量小于生成物的总能量,B正确。N2与O2在高压放电时才能化合生成NO,C错误。NO不是酸性氧化物,不能与NaOH溶液反应,D错误。原电池电极反应式的书写1.电极反应式的书写(1)原电池负极反应式的书写。①较活泼金属作负极时,电极本身被氧化。若生成的阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,如Zn-2e-===Zn2+,Cu-2e-===Cu2+。②负极本身不反应。氢氧(酸性)燃料电池,负极反应为H2-2e-===2H+;氢氧(碱性)燃料电池,负极反应为H2+2OH--2e-===2H2O。(2)原电池正极反应式的书写。书写时总的原则是首先根据化合价变化或氧化性强弱判断得电子的微粒;其次确定该微粒得电子后生成什么物质。如氢氧(酸性)燃料电池,正极反应为O2+4H++4e-===2H2O;氢氧(碱性)燃料电池,正极反应为O2+2H2O+4e-===4OH-。(3)书写复杂电极反应式的方法——加减法。①写出总反应。如Li+LiMn2O4===Li2Mn2O4。②写出其中容易写出的一个半反应(正极或负极)。如Li-e-===Li+(负极)。③利用总反应与上述的一极反应相减,即得另一个电极的反应式,即LiMn2O4+Li++e-===Li2Mn2O4(正极)。 微型银—锌电池可用作电子仪器的电源,其电极分别是Ag/Ag2O和Zn,电解质为KOH溶液,电池总反应为Ag2O+Zn+H2O ===2Ag+Zn(OH)2,下列说法正确的是 ( )A.电池工作过程中,KOH溶液浓度降低B.电池工作过程中,电解液中OH-向正极迁移C.负极发生反应Zn+2OH--2e-===Zn(OH)2D.正极发生反应Ag2O+2H++2e-===2Ag+H2O【答案】C 【解析】根据题给总反应方程式可知,KOH没有消耗,但消耗H2O,故浓度增大,A错误;原电池中,阴离子向负极定向移动,B错误;负极金属Zn放电,生成Zn(OH)2,C正确;Ag2O在正极发生反应,电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,D错误。(1)计算模式。设a mol·L-1、b mol·L-1分别为A、B两物质的起始浓度,mx mol·L-1为反应物A的转化浓度,nx mol·L-1为反应物B的转化浓度,则: “三段式”法在化学反应速率计算中的应用(2)基本步骤。①确定反应物或生成物的起始加入量;②确定反应过程中各物质浓度的变化量;③确定反应进行至某时刻时各物质的量;④依据题干中的条件建立等式关系进行解答;⑤应用化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之比进行解答。 X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y2Z。达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )【答案】B 典练·素养提升素养解读 能量是现代社会人类一切活动的基础,而许多能量变化都与化学反应密切相关。通过本章内容的学习,能帮助我们逐步培养宏观辨识与微观探析、变化观念与平衡思想、科学探究与创新意识、科学态度与社会责任等方面的学科核心素养。关于此反应说法错误的是 ( )A.一定属于吸热反应 B.一定属于可逆反应C.一定属于氧化还原反应 D.一定属于分解反应【答案】A 【解析】观察示意图知该反应的反应物是一种,生成物是两种,该物质发生分解反应,一般的分解反应是吸热反应,但也有的分解反应如2H2O2===2H2O+O2↑的反应是放热反应,A错误,D正确;根据图示可知有一部分反应物未参加反应,所以该反应是可逆反应,B正确;该反应中反应物为化合物,生成物中有单质,元素化合价有变化,属于氧化还原反应,C正确。2.(变化观念与平衡思想)“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O===2Mg(OH)2 。下列关于该电池的说法错误的是 ( )A.镁片作为正极B.食盐水作为电解质溶液C.电池工作时镁片逐渐被消耗D.电池工作时实现了化学能向电能的转化【答案】A 【解析】根据原电池原理镁为负极发生氧化反应;氧气在正极发生还原反应。3.(科学态度与社会责任)一种“即食即热型快餐”适合外出旅行时食用。其内层是用铝箔包裹并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质混合并发生反应,此时便可对食物进行加热,这两包化学物质最合适的选择是 ( )A.浓硫酸与水 B.生石灰与水C.熟石灰与水 D.氯化钠与水【答案】B 【解析】浓硫酸溶于水虽然放热,但浓硫酸是液体,又具有强烈的腐蚀性,不适宜给食品加热;而相同质量的生石灰和熟石灰分别溶于水,前者放出的热量比后者多;氯化钠溶于水能量变化不明显。4.(变化观念与平衡思想)化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是 ( )A.化学反应中能量变化的主要原因是化学键的断裂与生成B.铝热反应中,反应物的总能量比生成物的总能量低C.图Ⅰ所示的装置能将化学能转变为电能D.图Ⅱ所示的反应为吸热反应【答案】A 【解析】铝热反应是放热反应,所以反应物的总能量比生成物的总能量高,B错误;图Ⅰ所示的装置中没有形成闭合回路,不能构成原电池,因此不能将化学能转变为电能,C错误;图Ⅱ所示的反应中反应物的总能量高于生成物的总能量,为放热反应,D错误。5.(变化观念与平衡思想)化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是 ( )A.Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加B.正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-C.锌筒作负极,发生氧化反应,锌筒会变薄D.使用一段时间后,电解质溶液的酸性减弱,导电能力下降【答案】A下列说法能说明A、B容器均达到平衡状态的是________(填字母序号)。a.A、B容器中气体的颜色均不发生变化b.A、B容器中NO和O2物质的量浓度比均为2∶1c.A、B容器中气体的密度不再发生变化d.A、B容器中气体的平均摩尔质量不再发生变化【答案】ad 【解析】NO和O2无颜色,NO2为红棕色气体,因此当气体颜色不再改变,说明反应达到平衡,a正确;NO和O2的量按照化学反应方程式系数比投入,任何时刻NO和O2物质的量浓度比均为2∶1,因此不能说明反应达到平衡,b错误;组分都是气体,气体质量不变,A为恒容状态,气体体积不变,A容器中,密度不变,不能说明反应达到平衡,c错误;该反应为非等体积反应且无状态变化,且建立平衡过程中平均摩尔质量发生改变,故当气体平均摩尔质量不变时,说明反应达到平衡,d正确。(2)某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:①该反应的化学方程式为_____________________________。②若X、Y、Z均为气体,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为________。③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时________(填“增大”“减小”或“相等”)。【答案】(1)0.16 mol·L-1·min-1 61.5%(2)①3X+Y2Z ②9∶10 ③增大
相关资料
更多









