


所属成套资源:高考化学真题与模拟题分类训练专题(2份打包,含解析+原卷版,可预览)
高考化学真题与模拟题分类训练专题14 化学反应原理综合(2份打包,含解析+原卷版,可预览)
展开
这是一份高考化学真题与模拟题分类训练专题14 化学反应原理综合(2份打包,含解析+原卷版,可预览),文件包含高考化学真题与模拟题分类训练专题14化学反应原理综合含解析doc、高考化学真题与模拟题分类训练专题14化学反应原理综合原卷版doc等2份试卷配套教学资源,其中试卷共128页, 欢迎下载使用。
专题14 化学反应原理综合
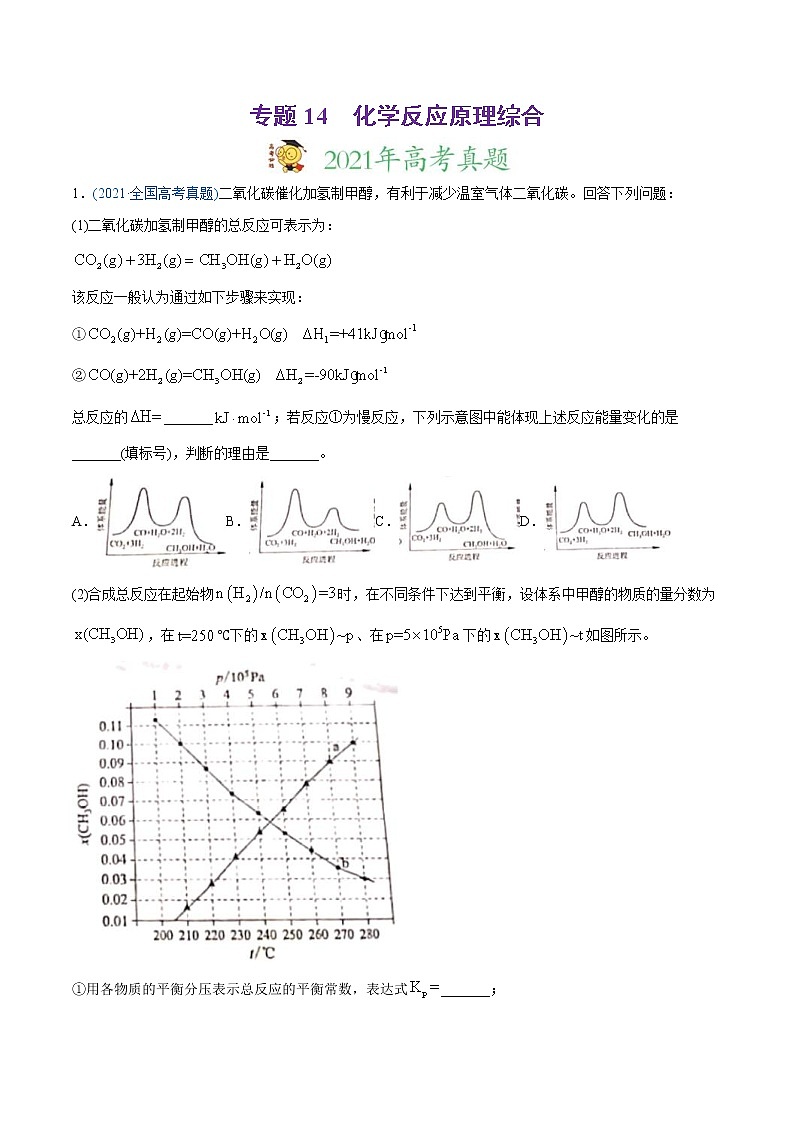
1.(2021·全国高考真题)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的_______;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______(填标号),判断的理由是_______。
A.B.C.D.
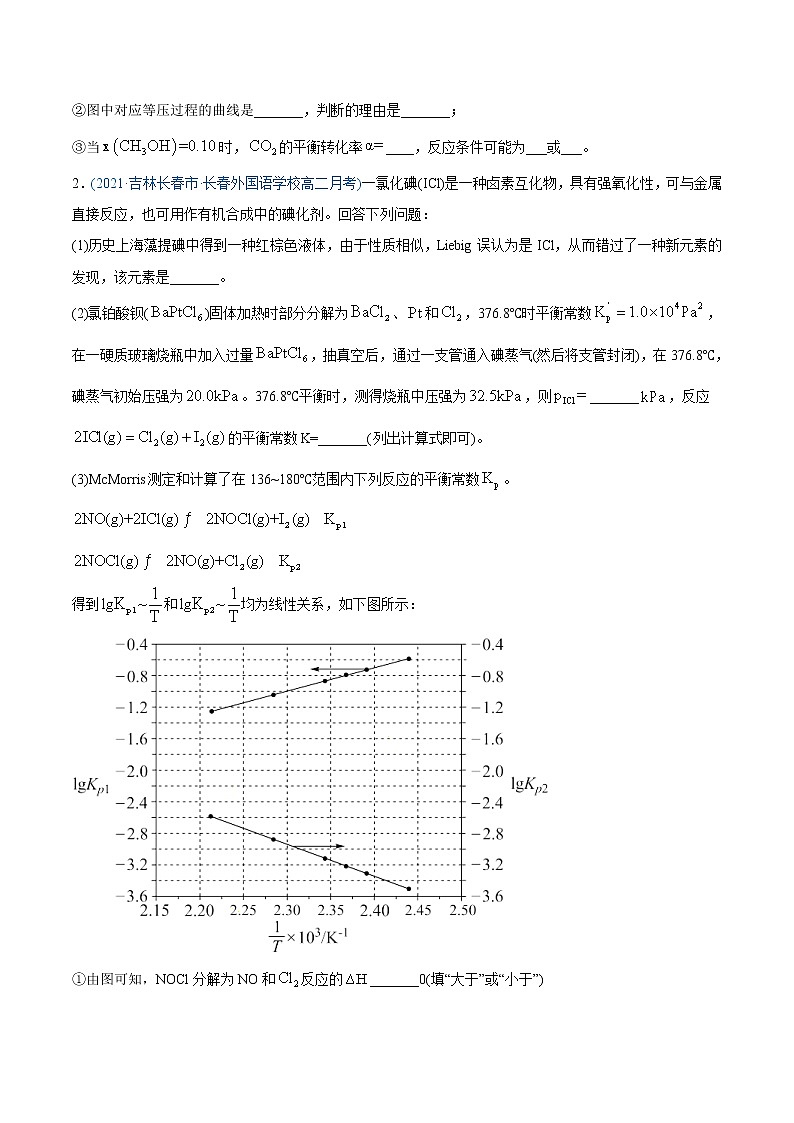
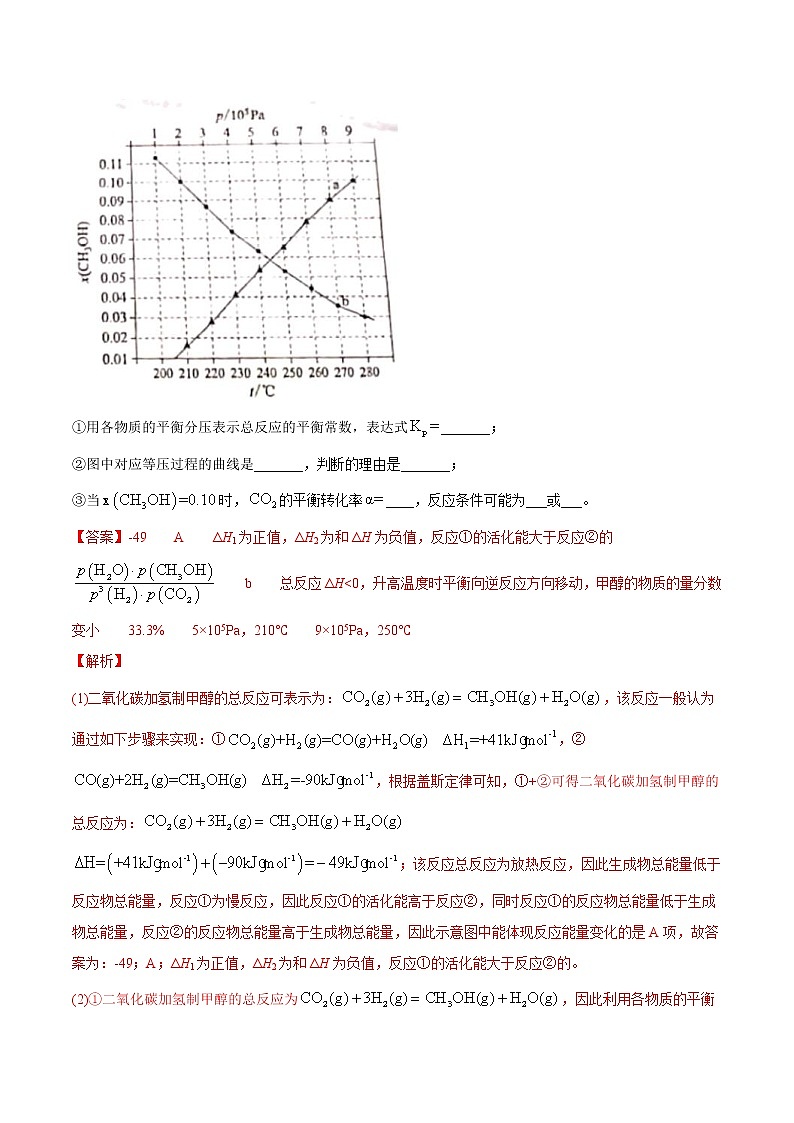
(2)合成总反应在起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为,在℃下的、在下的如图所示。
①用各物质的平衡分压表示总反应的平衡常数,表达式_______;
②图中对应等压过程的曲线是_______,判断的理由是_______;
③当时,的平衡转化率____,反应条件可能为___或___。
2.(2021·吉林长春市·长春外国语学校高二月考)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是ICl,从而错过了一种新元素的发现,该元素是_______。
(2)氯铂酸钡()固体加热时部分分解为、和,376.8℃时平衡常数,在一硬质玻璃烧瓶中加入过量,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为。376.8℃平衡时,测得烧瓶中压强为,则_______,反应的平衡常数K=_______(列出计算式即可)。
(3)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数。
得到和均为线性关系,如下图所示:
①由图可知,NOCl分解为NO和反应的_______0(填“大于”或“小于”)
②反应的K=_______(用、表示):该反应的_______0(填“大于”或“小于”),写出推理过程_______。
(4)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(v)光的照射下机理为:
其中表示一个光子能量,表示NOCl的激发态。可知,分解1mol的NOCl需要吸收_______mol光子。
3.(2021·广东高考真题)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g)2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g)CO(g)+H2O(g) ∆H2
c)CH4(g)C(s)+2H2(g) ∆H3
d)2CO(g)CO2(g)+C(s) ∆H4
e)CO(g)+H2(g)H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=_______(写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分_______步进行,其中,第_______步的正反应活化能最大。
(4)设K为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K随(温度的倒数)的变化如图所示。
①反应a、c、e中,属于吸热反应的有_______(填字母)。
②反应c的相对压力平衡常数表达式为K=_______。
③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程_______。
(5)CO2用途广泛,写出基于其物理性质的一种用途:_______。
4.(2021·河北高考真题)当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
物质
H2(g)
C(石墨,s)
C6H6(l)
燃烧热△H(kJ•mol-1)
-285.8
-393.5
-3267.5
(1)则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为________。
(2)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO(aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1,当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为________mol•L-1(写出表达式,考虑水的电离,忽略HCO的电离)
(3)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。
保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于________kPa。
(4)我国科学家研究Li—CO2电池,取得了重大科研成果,回答下列问题:
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在___(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O Ⅱ.C2O=CO2+CO
Ⅲ.__________ Ⅳ.CO+2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_________。
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为_______(用a、b、c字母排序)。
5.(2021·湖南高考真题)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I:氨热分解法制氢气
相关化学键的键能数据
化学键
键能
946
436.0
390.8
一定温度下,利用催化剂将分解为和。回答下列问题:
(1)反应_______;
(2)已知该反应的,在下列哪些温度下反应能自发进行?_______(填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,时反应达到平衡,用的浓度变化表示时间内的反应速率_______(用含的代数式表示)
②时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后分压变化趋势的曲线是_______(用图中a、b、c、d表示),理由是_______;
③在该温度下,反应的标准平衡常数_______。(已知:分压=总压×该组分物质的量分数,对于反应,,其中,、、、为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。
(4)电解过程中的移动方向为_______(填“从左往右”或“从右往左”);
(5)阳极的电极反应式为_______。
KOH溶液KOH溶液
6.(2021·浙江高考真题)含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量:。判断该反应的自发性并说明理由_______。
(2)已知。时,在一恒容密闭反应器中充入一定量的和,当反应达到平衡后测得、和的浓度分别为、和。
①该温度下反应的平衡常数为_______。
②平衡时的转化率为_______。
(3)工业上主要采用接触法由含硫矿石制备硫酸。
①下列说法正确的是_______。
A.须采用高温高压的反应条件使氧化为
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和的转化率
D.在吸收塔中宜采用水或稀硫酸吸收以提高吸收速率
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是_______。
A. B. C. D. E. F. G.
③对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图3中画出反应的转化率与最适宜温度(曲线Ⅰ)、平衡转化率与温度(曲线Ⅱ)的关系曲线示意图(标明曲线Ⅰ、Ⅱ)_______。
(4)一定条件下,在溶液体系中,检测得到pH-时间振荡曲线如图4,同时观察到体系由澄清→浑浊→澄清的周期性变化。可用一组离子方程式表示每一个周期内的反应进程,请补充其中的2个离子方程式。
Ⅰ.
Ⅱ.①_______;
Ⅲ.;
Ⅳ.②_______。
7.(2021·浙江高三专题练习)“氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:
(1)电解饱和食盐水制取氯气的化学方程式是______。
(2)下列说法不正确的是______。
A.可采用碱石灰干燥氯气
B.可通过排饱和食盐水法收集氯气
C.常温下,可通过加压使氯气液化而储存于钢瓶中
D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl 2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1______0。(填”>”、“=”或“”或”、“<”或“=”)c点对应逆反应速率v(逆)。
④若反应Ⅲ在c点的体系总压强为0.80MPa,则c点反应的Kp=___________(MPa)-2(Kp为以分压表示的平衡常数)。
(3)载人飞船,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液中电解液,总反应为:,CO在___________极产生,阳极的电极反应式为___________。
6.(2021·广西南宁市·高三二模)SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g) +2SO2(g)=CO2(g) +2S(s) +2H2O(l) ΔH= -295.9 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH= -297.2 kJ·mol-1
则CH4的燃烧热ΔH=_______。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示) ,该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:
①由分析可知X为_______ (填化学式)。
②0~t1时间段的温度为_______。
(3)燃煤烟气中可通过反应SO2(g)+2CO(g)2CO2(g)+S(l)实现硫的回收。将1molSO2和2molCO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106Pa条件下反应,5min时,反应达到平衡,气体密度减小16g·L-1。
①0~5min内,CO的反应速率是_______;若升高温度,气体的密度增加(S仍为液体),则该反应的ΔH_______(填“>”或“”“”、0,经20 min达到平衡,此时CH4的转化率为50%。
①0~20 min时间内生成氢气的平均速率为___________;
②反应在T℃时的平衡常数计算表达式为___________。
(3)其它条件相同,在不同催化剂(A、B)作用下,反应CH4(g)+CO2(g)2CO(g)+2H2(g)进行相同时间后,CO的产率随反应温度的变化如下图:
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用E(A)、E(B)表示,则E(A)___________E(B)(填“>”、“
相关试卷
这是一份高考化学真题与模拟题分类训练专题16 化学实验综合题(2份打包,含解析+原卷版,可预览),文件包含高考化学真题与模拟题分类训练专题16化学实验综合题含解析doc、高考化学真题与模拟题分类训练专题16化学实验综合题原卷版doc等2份试卷配套教学资源,其中试卷共124页, 欢迎下载使用。
这是一份高考化学真题与模拟题分类训练专题15 工艺流程题(2份打包,含解析+原卷版,可预览),文件包含高考化学真题与模拟题分类训练专题15工艺流程题含解析doc、高考化学真题与模拟题分类训练专题15工艺流程题原卷版doc等2份试卷配套教学资源,其中试卷共92页, 欢迎下载使用。
这是一份高考化学真题与模拟题分类训练专题11 化学实验基础(2份打包,含解析+原卷版,可预览),文件包含高考化学真题与模拟题分类训练专题11化学实验基础含解析doc、高考化学真题与模拟题分类训练专题11化学实验基础原卷版doc等2份试卷配套教学资源,其中试卷共58页, 欢迎下载使用。









