






所属成套资源:(新高考)高考化学大一轮复习课件 (含解析)
(新高考)高考化学大一轮复习课件第5章第30讲配合物分子间作用力超分子(含解析)
展开
这是一份(新高考)高考化学大一轮复习课件第5章第30讲配合物分子间作用力超分子(含解析),共60页。PPT课件主要包含了复习目标,配位键配合物,配合物理论的应用,分子极性的判断方法,分子结构与性质简答,真题演练明确考向,课时精练等内容,欢迎下载使用。
1.了解配位键的形成和配合物的组成。2.了解分子间作用力的类型、特征、实质及其对物质性质的影响。3.能列举存在氢键的物质,并能解释氢键对物质性质的影响。
1.配位键(1)配位键的形成:成键原子一方提供 ,另一方提供 形成共价键。(2)配位键的表示:常用“ ”来表示配位键,箭头指向接受孤电子对的原子,如 可表示为 ,在 中,虽然有一个N—H形成过程与其他3个N—H形成过程不同,但是一旦形成之后,4个共价键就完全 。
孤电子对 空轨道
2.配位化合物(1)概念:金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物。(2)形成条件中心离子或原子:有空轨道,一般是带正电的金属离子,特别是过渡金属离子,如Fe3+、Cu2+、Zn2+、Ag+等,但也有电中性的原子等。配位体:其中的配位原子(配位体中直接同中心离子或原子配合的原子)有孤电子对。配位体可以是分子,如CO、NH3、H2O等,也可以是离子,如F-、Cl-、Br-、I-、CN-、SCN-、OH-等。
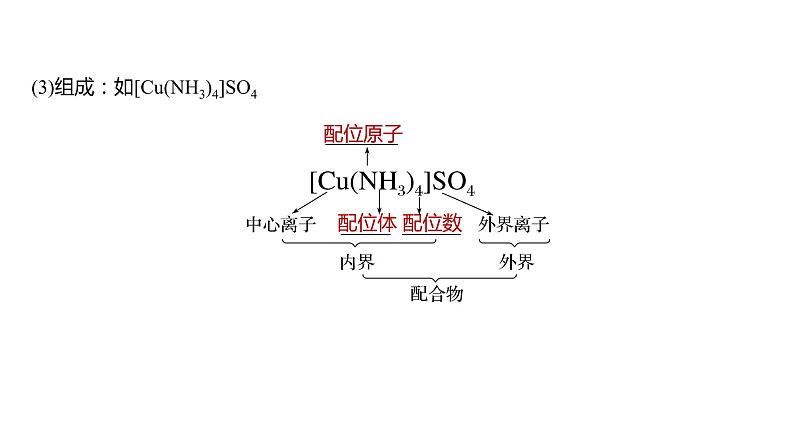
(3)组成:如[Cu(NH3)4]SO4
1.配位键实质上是一种特殊的共价键( )2.提供孤电子对的微粒既可以是分子,也可以是离子( )3.有配位键的化合物就是配位化合物( )4.配位化合物都很稳定( )5.在配合物[C(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀( )6.Ni(CO)4是配合物,它是由中心原子与配体构成的( )
1.下列组合中,中心原子的电荷数和配位数均相同的是A.K[Ag(CN)2]、[Cu(NH3)4]SO4B.[Ni(NH3)4]Cl2、[Cu(NH3)4]SO4C.[Ag(NH3)2]Cl、K3[Fe(SCN)6]D.[Ni(NH3)4]Cl2、[Ag(NH3)2]Cl
2.Ⅰ.铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂消毒剂。(1)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间结构都是三角锥形,但NF3不易与Cu2+形成配离子。其原因是____________________________________________________________________________________________________________________________________________。
N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F原子、偏离N原子,使得氮原子的原子核对孤电子对吸引力增强,难与Cu2+形成配位键
(2)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间结构,[Cu(OH)4]2-的结构可用示意图表示为____________________________________。1 ml该离子中含有σ键个数为______。
(3)胆矾CuSO4·5H2O可写作[Cu(H2O)4]SO4·H2O,其结构示意图如下:下列有关胆矾的说法正确的是_____(填字母)。A.所有氧原子都采取sp3杂化B.氧原子存在配位键和氢键两种化学键C.Cu2+的价层电子排布式为3d84s1D.胆矾中的水在不同温度下会分步失去
Ⅱ.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还能以其他个数比配合。按要求填空:(4)若Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1∶1配合所得离子显红色。该离子的离子符号是____________。(5)若Fe3+与SCN-以个数比1∶5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为____________________________________。
[Fe(SCN)]2+
FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl
(1)单核配体的确认要注意是否带有电荷,如F-、Cl-等,如配合物[CCl(NH3)5]Cl2,中心离子为C3+,配体是Cl-和NH3,而不是氯原子。(2)高考中常考有关配合物的结构示意图,不考虑空间结构,但要注意配体中的配位原子一定要与中心原子或中心离子直接相连。如[Cu(NH3)4]2+中NH3中N原子为配位原子,所以N原子必须要与铜离子直接相连。
分子间作用力与分子的性质 超分子
1.分子间作用力及其对性质的影响
2.分子的性质(1)分子的极性
(2)分子的溶解性①“相似相溶”的规律:非极性溶质一般能溶于 溶剂,极性溶质一般能溶于 溶剂。②若溶剂和溶质分子之间可以形成氢键,则溶质的溶解度 。③随着溶质分子中憎水基个数的增多,溶质在水中的溶解度减小。如甲醇、乙醇和水以任意比互溶,而戊醇在水中的溶解度明显减小。(3)分子的手性具有完全相同的组成和原子排列的一对分子,如同左手与右手一样 ,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。有手性异构体的分子叫手性分子。
3.超分子(1)概念超分子是由 的分子通过 形成的分子聚集体。(2)超分子内分子间的作用力超分子内部分子之间通过非共价键相结合,包括氢键、静电作用、疏水作用以及一些分子与金属离子形成的弱配位键等。(3)超分子的应用在分子水平上进行分子设计,有序组装甚至复制出一些新型的分子材料。
1.以极性键结合起来的分子一定是极性分子( )2.碘化氢的沸点高于氯化氢的沸点是因为碘化氢分子间存在氢键( )3. 为手性分子( )4.非极性分子中,一定含有非极性共价键( )5.卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大( )6.BCl3与NCl3均为三角锥形,为极性分子( )
7.H2O比H2S稳定是因为水分子间存在氢键( )8.可燃冰(CH4·8H2O)中甲烷分子与水分子之间形成了氢键( )
1.下列各组分子中,都属于含极性键的非极性分子的是A.CO2、H2S B.C2H4、CH4C.Cl2、C2H2 D.NH3、HCl
一、键的极性与分子的极性判断
2.下列叙述正确的是A.以非极性键结合起来的双原子分子一定是非极性分子B.以极性键结合起来的分子一定是极性分子C.非极性分子只能是双原子单质分子D.非极性分子中,一定含有非极性共价键
(1)只含非极性键的分子一定是非极性分子,如H2、P4等。(2)含极性键的双原子分子一定是极性分子,如HCl、CO等。(3)ABn(n≥2)型分子:①根据分子结构判断若分子是对称的(直线形、正三角形、正四面体形等),极性键的极性向量和等于零时,为非极性分子,否则是极性分子。如CH4、CO2等含有极性键,是非极性分子;H2O、NH3等含有极性键,是极性分子。
②利用孤电子对判断若中心原子A中无孤电子对,则为非极性分子;若有孤电子对,则为极性分子。③利用化合价判断若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。如BCl3、CO2是非极性分子;SO2、NF3是极性分子。
3.(1)H2O在乙醇中的溶解度大于H2S,其原因是_______________________________。
二、分子间作用力对物质性质的影响
水分子与乙醇分子之间能形成氢键
(2)已知苯酚( )具有弱酸性,其K=1.1×10-10;水杨酸第一步电离形成的离子 能形成分子内氢键,据此判断,相同温度下电离平衡常数K2(水杨酸)___K(苯酚)(填“>”或“”“”“”或“”“
相关课件
这是一份新高考化学一轮复习精品课件 第6章 第34讲 分子的性质 配合物与超分子 (含解析),共60页。PPT课件主要包含了键的极性与分子极性,必备知识,关键能力,分子间作用力,应用举例,超分子,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份2024届高考化学一轮复习配合物与超分子课件,共44页。PPT课件主要包含了复习目标,专项突破,归纳整合,配合物,同步练习,思考与讨论,超分子,超分子的实例,超分子的自组装等内容,欢迎下载使用。
这是一份第32讲 分子的性质 配合物与超分子-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共58页。PPT课件主要包含了复习目标,键的极性与分子极性,考点一,必备知识,专项突破,分子间作用力,考点二,易错辨析,超分子,考点三等内容,欢迎下载使用。









