




所属成套资源:人教版化学选择性必修1PPT课件
高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀ppt课件,共23页。PPT课件主要包含了学习目标,第1课时水的电离,认识水的电离,了解水的离子积常数等内容,欢迎下载使用。
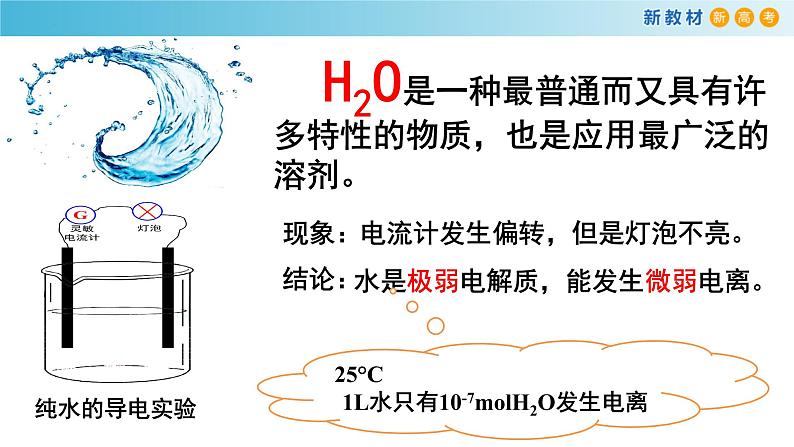
H2O是一种最普通而又具有许多特性的物质,也是应用最广泛的溶剂。
电流计发生偏转,但是灯泡不亮。
水是极弱电解质,能发生微弱电离。
25°C 1L水只有10-7mlH2O发生电离
了解水的电离平衡及影响因素
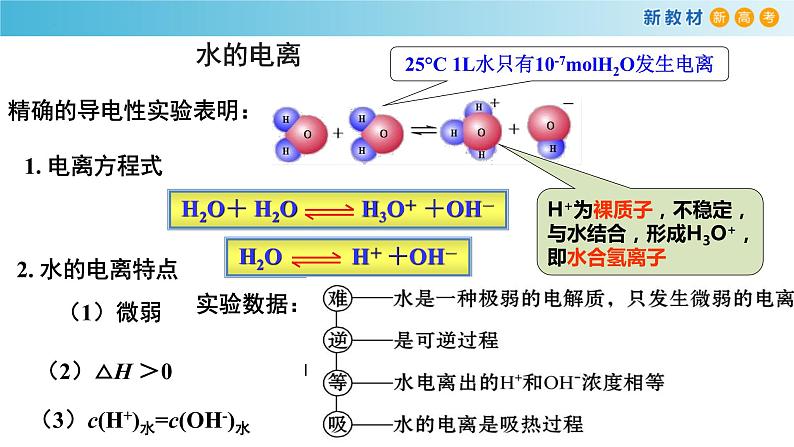
H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子
精确的导电性实验表明:
实验数据:25℃ 时 1 L 水约等于 55.6 ml 约有 10-7 ml H2O 分子发生电离
25°C 1L水只有10-7mlH2O发生电离
(3)c(H+)水=c(OH-)水
【思考】如何衡量水的电离的限度?
KW=c(H+)·c(OH-)
K电离 .c(H2O) =c(H+) .c(OH-)
已知 25℃ 时,1 L 纯水电离出的 n(H+) = n(OH-) = 1×10-7 ml则 Kw = c(H+)×c(OH-) = 1×10-14
室温下55.6ml H2O中有1×10-7ml H2O电离,因此c(H2O)可视为常数。
(4)数值: 25℃时,Kw=c(H+)·c(OH-) =1×10-14
(3)表达式: Kw=c(H+)·c(OH-);
(1)定义:在一定温度下,水中c(H+)和c(OH-)的乘积是一个常数,这个常数叫做水的离子积常数。
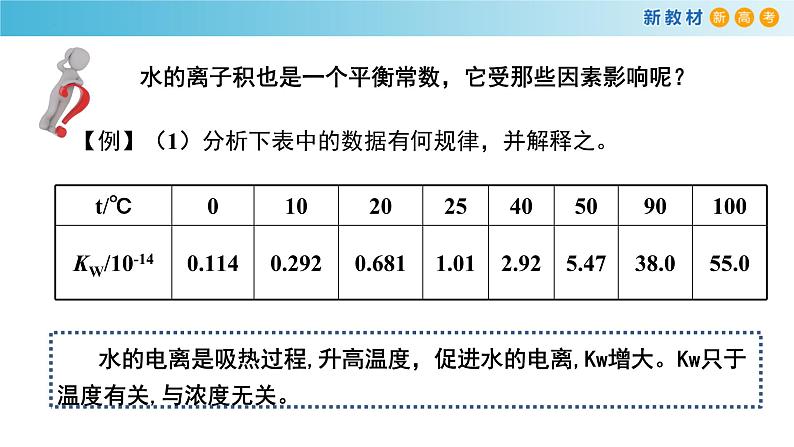
水的离子积也是一个平衡常数,它受那些因素影响呢?
【例】(1)分析下表中的数据有何规律,并解释之。
水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只于温度有关,与浓度无关。
Kw既适用于纯水,也适应于稀的电解质水溶液;P46
纯水中: c(H+)= c(OH-)
Kw只受温度影响, T不变, Kw不变。水的电离过程是吸热,T↑, Kw↑
4.影响水的电离平衡的因素
⑴温度:水的电离是吸热过程,升高温度,促进水电离。故升高温度,KW增大。
⑵加入酸溶液或碱溶液:
加入酸或碱,抑制水电离,Kw不变。
⑶加入活泼金属(Na、K):
4、总结: 水的电离平衡的影响因素:
① 酸、碱:抑制水的电离,Kw不变。平衡逆向移动 ,水的电离程度变小。
② 温度:T↑,促进水的电离, Kw↑,平衡正向移动 ,水的电离程度变大。
③ 外加能消耗H+或OH-的物质:平衡正向移动 ,水的电离程度变大。
5.水电离出的c(H+)或者c(OH-)的计算
0.01 ml·L-1的盐酸中c酸(H+)=0.01 ml·L-1(HCl电离产生)。根据25 ℃时水的离子积Kw=1.0×10-14,可得c酸(H+)·c水(OH-)=1.0×10-14,解得c水(H+)=c水(OH-)=1.0×10-12 ml·L-1[水电离出的c(H+)、c(OH-)在任何时候都是相等的]。
(1) 在25℃ 0.01ml/L盐酸溶液中:c(H+) = , c(OH-) = ; c(H+)水= , c(OH-)水= 。
提示:由于c(H+)溶液=0.01 ml·L-1,溶液中c(OH-)=Kw÷c(H+)溶液=(1.0×10-14÷0.01) ml·L-1=1.0×10-12 ml·L-1。由于溶液中的OH-只来源于水的电离,所以水电离出的c(H+)=1.0×10-12 ml·L-1。
(2) 在25℃ 0.01ml/L NaOH溶液中:c(H+)= , c(OH-)= ; c(H+)水= , c(OH-)水= 。
0.01 ml·L-1NaOH溶液中c碱(OH-)=0.01 ml·L-1 (NaOH电离产生)。根据25 ℃时水的离子积Kw=1.0×10-14,可得c碱(OH-)·c水(H+)=1.0×10-14,解得c水(H+)=c水(OH-)=1.0×10-12 ml·L-1。
思考:室温下,0.1 ml/L 的醋酸溶液,c(H+) = 0.001 ml/L 水电离的 c(H+)=___________
1.0×10-11 ml/L
c(H+)水 = c(OH-)水
溶液中c(H+)增大,抑制水的电离,使水电离出来的c(OH-)减小
≈ 0.001ml/L
Kw = c(H+)×c(OH-) = 1×10-14
酸溶液中:c(H+)≈c酸(H+)、 c(OH-)=c水(OH-)
碱溶液中:c(H+)=c水(H+)、 c(OH-)=c碱(OH-)
(1) 因为H2O H++OH-,所以由水电离出的c(H+)=c(OH-)。
(2)酸溶液中的OH-和碱溶液中的H+都是水电离出的。
(3)KW表达式中的c(H+)和c(OH-)是溶液中H+和OH-的总浓度。
(4)酸溶液中Kw=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度),即c(H+)水=c(OH-)水=Kw/c(H+)酸。
(5)碱溶液中Kw=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度),即c(H+)水=Kw/c(OH-)碱。
1.判断正误(正确的打“√”,错误的打“×”)
(1)升高温度,水的电离平衡右移,溶液中的c(H+)和c(OH-)均增大,但Kw不变。( )(2)25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时纯水中的c(H+)>c(OH-)。( )(3)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。 ( )(4)向水中加入酸抑制水的电离,向水中加入碱促进水的电离。( )
2.在氨水中存在的粒子有 ;在氯水中存在的粒子有 。
NH3、NH3•H2O、H2O、OH-、NH4+、H+
Cl2、H2O、H+、OH-、ClO-、HClO、Cl-
3.现有下列物质①100 ℃纯水; ②25 ℃ 0.1 ml·L-1 盐酸;③25 ℃ 0.1 ml·L-1 KOH溶液;④25 ℃ 0.1 ml·L-1 Ba(OH)2溶液。
(1)这些物质与25 ℃纯水相比,能促进水电离的是__________(填序号,下同),能抑制水的电离的是__________,水电离的c(OH-)等于溶液中c(OH-)的是__________,水电离的c(H+)等于溶液中c(H+)的是__________。
(2)从②和③溶液中水的电离度相等,进而可推出的结论是同一温度下,__________时,水的电离度相等。
酸溶液中的c(H+)等于碱溶液中的c(OH-)
4.如图中三条曲线表示不同温度下水的离子积常数,下列说法不正确的是( )
A.图中温度:T3>T2>T1B.图中pH关系:pH(B)=pH(D)=pH(E)C.图中五点Kw间的关系:E>D>A=B=CD.C点的溶液可能显酸性
【解析】选。升高温度促进水的电离,根据图象知,离子积常数KW3>KW2>KW1,所以温度T3>T2>T1,A正确;根据图象知,B、D、E三点溶液的c(H+)相等,则pH相等,B正确;温度越高,离子积常数越大,KW间的关系:E>D>A=B=C,C正确;C点时,Kw=1×10-14,c(OH-)=1×10-6,溶液的pH=8,显碱性,D错误。
5.某温度下,纯水中c(H+)=2.0×10-7 ml·L-1,则此时c(OH-)=_____________;温度不变,向水中滴入盐酸使c(H+)=5.0 ml·L-1,则溶液中c(OH)=_____________。
解析:纯水中c(H+)始终等于c(OH-),所以c(OH-)=2.0×10-7 ml·L-1。此温度下,KW=c(H+)·c(OH-)=4.0×10-14。向水中滴加盐酸,KW不变,
2.0×10-7 ml·L-1
8.0×10-15 ml·L-1
H2O⇌H++OH-Kw=c(H+)·c(OH-)外界条件对水电离平衡及Kw的影响
相关课件
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优质ppt课件,文件包含第二节水的电离和溶液的酸碱性ppt、实验活动2强酸与强碱的中和滴定mp4等2份课件配套教学资源,其中PPT共58页, 欢迎下载使用。
这是一份高中化学第二节 金属材料优秀课件ppt,共23页。PPT课件主要包含了学习目标,第1课时水的电离,认识水的电离,了解水的离子积常数等内容,欢迎下载使用。
这是一份2020-2021学年第二节 水的电离和溶液的pH教学课件ppt,文件包含人教版化学选修一321《水的电离》课件pptx、人教版化学选修一321《水的电离》教学设计docx等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。











