




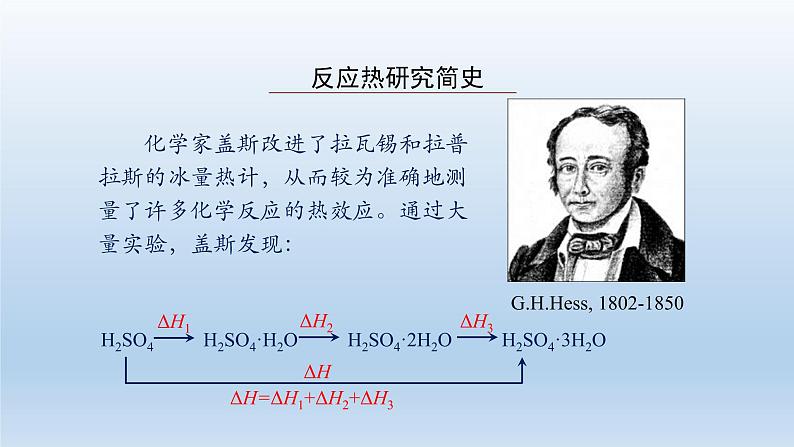


选择性必修1第二节 反应热的计算习题ppt课件
展开
这是一份选择性必修1第二节 反应热的计算习题ppt课件,文件包含反应热的计算pptx、反应热的计算-练习题docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
练习题课后练习1.已知: ①Zn(s) +O2(g)ZnO(s) ΔH = −348.3 kJ·mol−1②2Ag(s) +O2(g)Ag2O(s) ΔH = −31.0 kJ·mol−1则Zn(s) + Ag2O(s)ZnO(s) + 2Ag(s)的ΔH等于( )A.+317.3 kJ·mol−1 B.−379.3 kJ·mol−1 C.−332.8 kJ·mol−1 D.−317.3 kJ·mol−1 2.一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100 g CaCO3沉淀,则完全燃烧1 mol无水乙醇时放出的热量是( )A.0.5Q B.Q C.2Q D.5Q3.已知: 2H2(g) + O2(g)===2H2O(l) ΔH=−571.6 kJ·mol−1CH4(g) + 2O2(g)===CO2(g) + 2H2O(l) ΔH=−890 kJ·mol−1现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )A.1∶1 B.1∶3 C.1∶4 D.2∶34.将煤转化为水煤气的主要化学反应为C(s) + H2O(g)CO(g) + H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:C(s) + O2(g)===CO2(g) ΔH=-393.5 kJ·mol−1H2(g) + O2(g)===H2O(g) ΔH=-242.0 kJ·mol−1CO(g) + O2(g)===CO2(g) ΔH=-283.0 kJ·mol−1写出C(s)与水蒸气反应的热化学反应方程式。 5.家用液化气的主要成分之一是丁烷(C4H10),当1 kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104 kJ。(1)写出丁烷燃烧的热化学方程式。 (2)已知1 mol液态水变为水蒸气需要吸收44 kJ的热量,计算1 mol丁烷完全燃烧生成二氧化碳和水蒸气时放出的热量。 【参考答案】1.D 2.C 3.B4.C(s)+H2O(g)===CO(g)+H2(g) ΔH =+131.5 kJ·mol−15.(1)C4H10(g) +13/2O2(g) === 4CO2(g) + 5H2O(l) ΔH = −2 900 mol·L−1 (2)2 680 kJ
相关课件
这是一份高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算说课课件ppt,共36页。
这是一份化学选择性必修1第二节 反应热的计算公开课ppt课件,共19页。PPT课件主要包含了学习目标,一盖斯定律,二反应热的计算等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算教课课件ppt,共52页。PPT课件主要包含了目标素养,知识概览,自主预习,预习检测等内容,欢迎下载使用。









