





所属成套资源:人教版化学选择性必修1课件PPT整册+部分视频素材
人教版 (2019)选择性必修1第三节 化学反应的方向一等奖课件ppt
展开
这是一份人教版 (2019)选择性必修1第三节 化学反应的方向一等奖课件ppt,共31页。PPT课件主要包含了学习目标,可逆反应进行的方向,化学反应进行的方向,化学反应速率角度,化学平衡角度,“自发过程”,“方向1”,自发方向2,自发反应,非自发反应等内容,欢迎下载使用。
1、知道化学反应是有方向的。 2、知道化学反应的方向与反应的焓变和熵变有关。 3、能判断熵的变化(熵增或熵减) 4、能结合具体事例说明反应自发进行的方向。
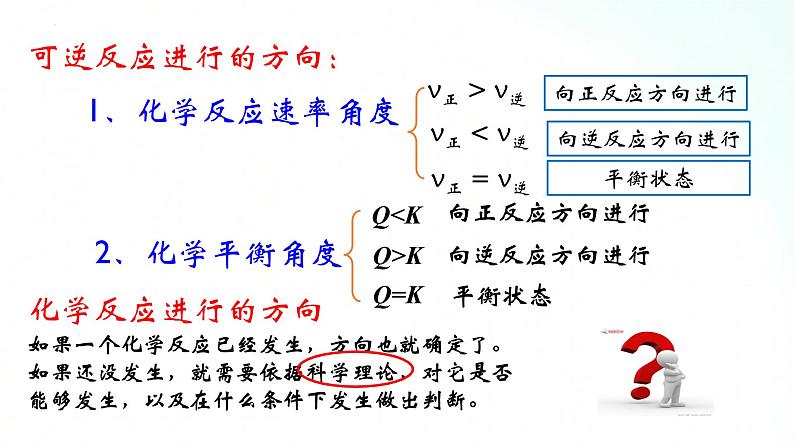
如果一个化学反应已经发生,方向也就确定了。如果还没发生,就需要依据科学理论,对它是否能够发生,以及在什么条件下发生做出判断。
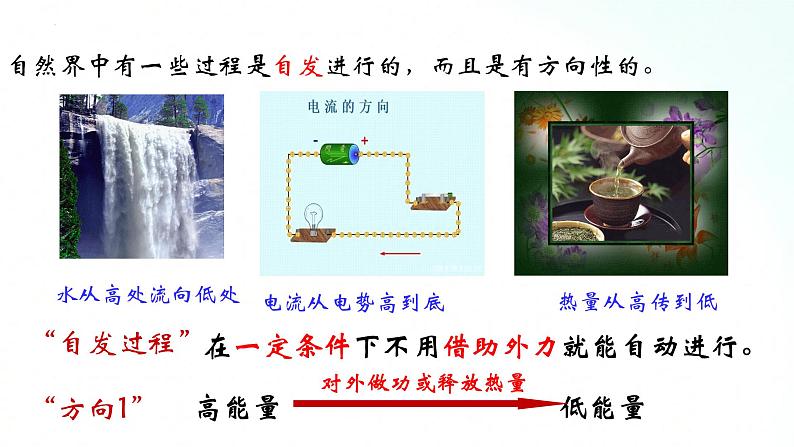
自然界中有一些过程是自发进行的,而且是有方向性的。
在一定条件下不用借助外力就能自动进行。
高能量 低能量
非自发过程 :在一定条件下,需要持续借助外力才能进行的过程。
“自发”是有一定条件的
“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
在一定条件下,不需外界帮助就能自动进行的化学反应。
有些化学反应也是自发进行的,而且有方向性。
在一定条件下,必须借助某种外力才能进行的化学反应。
如何解释下列化学反应是自发反应?
①H2(g)+1/2O2(g)= H2O(l)②1/2H2(g)+1/2Cl2(g)= HCl(g)③Na(s)+H2O(l)=NaOH(aq)+1/2H2(g)④铁生锈:2Fe(s)+3/2O2(g)= Fe2O3(s)⑤NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
∆H= -286kJ·ml-1
∆H= -92kJ·ml-1
∆H= -184kJ·ml-1
∆H= -824kJ·ml-1
∆H= -57.3kJ·ml-1
课堂练习1、请说说下列反应能够自发进行的原因。
放热反应H < 0体系的能量降低
一、焓判据(能量判据)
对于化学反应而言,绝大多数的放热反应能自发进行,且放出的热量越多,体系能量降低越多,反应越完全。
19世纪,化学家们曾认为决定化学反应能否自发进行的因素是反应热:放热反应可以自发进行,吸热反应则不能自发进行。你同意这种观点吗?
焓判据:体系趋向于从能量高的状态转变为能量低的状态,因此放热反应( △H0 △
2N2O5(g)=4NO2(g)+O2 (g) △H=+109.8kJ/ml
NaHCO3(s)+HCl =NaClaq)+CO2(g)+ H2O(l) △H= +31.4kJ/ml
焓变只是反应能否自发进行的一个因素,但不是惟一因素。只根据焓变来判断反应方向是不全面的。
这些吸热反应也是自发反应
吸热反应能自发进行。怎么解释?
阅读课本P41-42了解描述体系混乱(或无序)程度的物理量熵
体系除了具有从高能状态自发地转变为低能状态的倾向,还有从有序自发地转变为无序的倾向。
德国科学家克劳修斯(R. Clausius)最早提出了另一个推动体系变化的因素,并称之为“熵”(符号S)的概念,用熵表示体系混乱度,S=Q/T。
描述体系混乱(或无序)程度的物理量。单位:J·ml-1·K-1
课堂练习2、试根据熵的定义判断下列过程中体系的熵变大于零还是小于零。(1)水蒸气冷凝成水(2)硫酸铜溶于水 (3)CaCO3(s)=CaO(s)+CO2(g)(4) 2N2O5(g)=4NO2(g)+O2(g) (5)2H2(g)+ O2(g) =2H2O (l)
化学反应中,固态物质或液态物质生成气态物质,体系的混乱度增大;从较少的气态物质生成较多的气态物质,体系的混乱度也增大
(1) 与物质的存在状态有关:对于同一种物质,等物质的量的该物质其熵值(混乱度)大小与物质的存在状态有关。S(g)>S(l)>S(s),即气态>液态>固态。(2) 与物质的量有关:物质的量越大,分子数越多,熵值越大。(3) 不同物质熵值间的关系:物质的组成越复杂,其熵值越大,一般组成物质的原子种类相同时,一个分子中的原子数目越多,其混乱度越大,熵值也越大。
大多数产生气体的反应、气体物质的物质的量增大的反应,熵变通常都是正值( △S >0),是自发反应。
熵变:变化前后体系或反应前后物质的熵的变化。用符号∆S表示。
∆S=S(生成物)-S(反应物)
熵判据:体系趋向于从有序转变为无序,因此熵增反应( △s>0 )有利于反应自发进行。
2.粗硅的制备:SiO2(s)+2C(s)=Si(s)+2CO(g)C的还原性是弱于Si的,此反应为什么能够发生呢?
1.金属钾的制备:Na(l)+KCI(l)=K(g)+NaCI(l)Na的活泼性是弱于K的,此反应为什么能够发生呢?
思考:如何解释下列反应发生的原因。
主要是因为Na的沸点高于K的沸点。我们可以控制反应温度,使K沸腾为气体,Na保持液体。从而使反应熵值增大,即S>0,以利于反应自发。
3. H3PO4(l)+NaCI(s)= NaH2PO4(s)+HCI(g) H3PO4的酸性是弱于HCI,此反应为什么能够发生呢?
2NO(g)+2CO(g)=N2(g)+2CO2(g)4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)
思考:判断下列自发反应熵的变化
这些化学反应的ΔS0
4、汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)=N2(g)+2CO2(g)。由此可知,下列说法正确的是( )A.该反应是熵增大的反应B.该反应不能自发进行,因此需要合适的催化剂C.该反应常温下能自发进行,催化剂条件只是增大反应的速率D.该反应常温下能自发进行,因为正反应是吸热反应
5、某化学反应的ΔH=-122 kJ·ml-1,ΔS=+231 J·ml-1·K-1,则此反应在下列哪种情况下可自发进行( )A.在任何温度下都能自发进行B.在任何温度下都不能自发进行C.仅在高温下自发进行D.仅在低温下自发进行
相关课件
这是一份化学人教版 (2019)第三节 化学反应的方向优秀课件ppt,共16页。PPT课件主要包含了问题解决2问题解决2等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三节 化学反应的方向优质ppt课件,共3页。
这是一份高中化学人教版 (2019)选择性必修1第三节 化学反应的方向获奖课件ppt,文件包含新人教版化学选择性必修一23化学反应的方向课件pptx、新人教版化学选择性必修一23化学反应的方向针对练习含解析docx、新人教版化学选择性必修一23化学反应的方向教案doc等3份课件配套教学资源,其中PPT共31页, 欢迎下载使用。










