
山西省长治市城区2023届高三(上)摸底检测化学试题(word版,含答案)
展开山西省长治市城区2023届高三(上)摸底检测
理科综合(化学试题)
注意事项:
1.答题前,考生务必将自己的学校、姓名、班级、准考证号填写在答题卡上相应的位置。
2.全部答案在答题卡上完成,答在本试卷上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5毫米及以上黑色笔迹签字笔写在答题卡上。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Ti-48 Zn-65
第Ⅰ卷(选择题 共42分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求.)
1. 下列有关叙述正确的是
A. 月壤中含有的3He与地球上的4He互为同素异形体
B. 航天服所使用的碳化硅陶瓷、碳纤维均属于无机非金属材料
C. 由铁粉和氧化铝构成的铝热剂可用于焊接钢轨
D. 制取漂白粉是将氯气通入浓NaOH溶液中
2. 普黄酮是一种抗骨质疏松的药物,其结构简式如下,下列有关说法不正确的是
A. 该化合物的分子式为C18H16O3
B. 该化合物能发生加成反应、水解反应、氧化反应
C. 该化合物分子中所有碳原子不可能共面
D. 该化合物一氯代物有9种(不考虑空间异构)
3. 根据下列实验操作和现象能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向Na2S溶液中通入足量CO2,然后再将产生气体导入CuSO4溶液中,产生黑色沉淀 | Ka1(H2CO3)>Ka1(H2S) |
B | 向KBrO3溶液中通入少量Cl2,然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
C | 常温下,用pH计分别测定等体积的1mol/LCH3COONH4溶液和0.1mol/LCH3COONH4的pH,测得pH都等于7 | 同温下,不同浓度的CH3COONH4溶液中水的电离程度相同 |
D | 将炽热的木炭和浓硝酸混合,产生红棕色气体 | 加热条件下,浓硝酸被木炭氧化为NO2 |
A. A B. B
C. C D. D
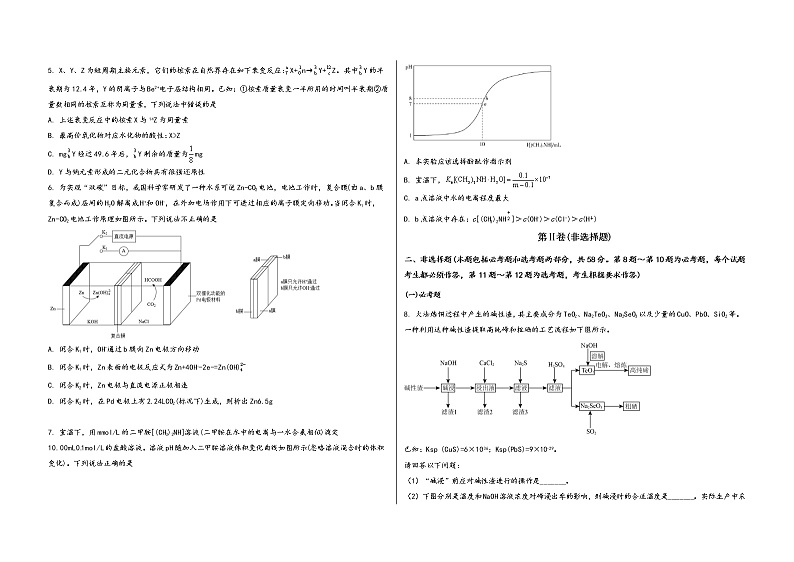
4. 从工业废水(主要成分为KI和BaCl2)中回收单质碘流程如图所示:
下列有关说法错误的是
A. 萃取的过程中,加入苯充分振荡后,要及时打开分液漏斗的活塞放气
B. 碘的升华与加热分离NaCl和NH4Cl固体混合物的原理相同
C. 蒸馏时,温度计水银球应在蒸馏烧瓶支管口处
D. 整个过程应注意防止环境的污染
5. X、Y、Z为短周期主族元素,它们的核素在自然界存在如下衰变反应:X+n→Y+Z。其中Y的半衰期为12.4年,Y的阴离子与Be2+电子层结构相同。已知:①核素质量衰变一半所用的时间叫半衰期②质量数相同的核素互称为同量素,下列说法中错误的是
A. 上述衰变反应中的核素X与14Z为同量素
B. 最高价氧化物对应水化物的酸性:X>Z
C. mgY经过49.6年后,Y剩余的质量为mg
D. Y与钠元素形成的二元化合物具有很强还原性
6. 为实现“双碳”目标,我国科学家研发了一种水系可逆Zn-CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH-,在外加电场作用下可透过相应的离子膜定向移动。当闭合K1时,Zn-CO2电池工作原理如图所示。下列说法不正确的是
A. 闭合K1时,OH-通过b膜向Zn电极方向移动
B. 闭合K1时,Zn表面的电极反应式为Zn+4OH--2e-=Zn(OH)
C. 闭合K2时,Zn电极与直流电源正极相连
D. 闭合K2时,在Pd电极上有2.24LCO2(标况下)生成,则析出Zn6.5g
7. 室温下,用mmol/L的二甲胺[(CH3)2NH]溶液(二甲胺在水中的电离与一水合氨相似)滴定10.00mL0.1mol/L的盐酸溶液。溶液pH随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
A. 本实验应该选择酚酞作指示剂
B. 室温下,
C. a点溶液中水的电离程度最大
D. b点溶液中存在:c[(CH3)2NH]>c(OH-)>c(Cl-)>c(H+)
第Ⅱ卷(非选择题)
二、非选择题(本题包括必考题和选考题两部分,共58分。第8题~第10题为必考题,每个试题考生都必须作答,第11题~第12题为选考题,考生根据要求作答)
(一)必考题
8. 火法炼铜过程中产生的碱性渣,其主要成分为TeO2、Na2TeO3、Na2SeO3以及少量的CuO、PbO、SiO2等。一种利用这种碱性渣提取高纯碲和粗硒的工艺流程如下图所示。
已知:Ksp (CuS)=6×10-36;Ksp(PbS)=9×10-29。
请回答以下问题:
(1)“碱浸”前应对碱性渣进行的操作是_______。
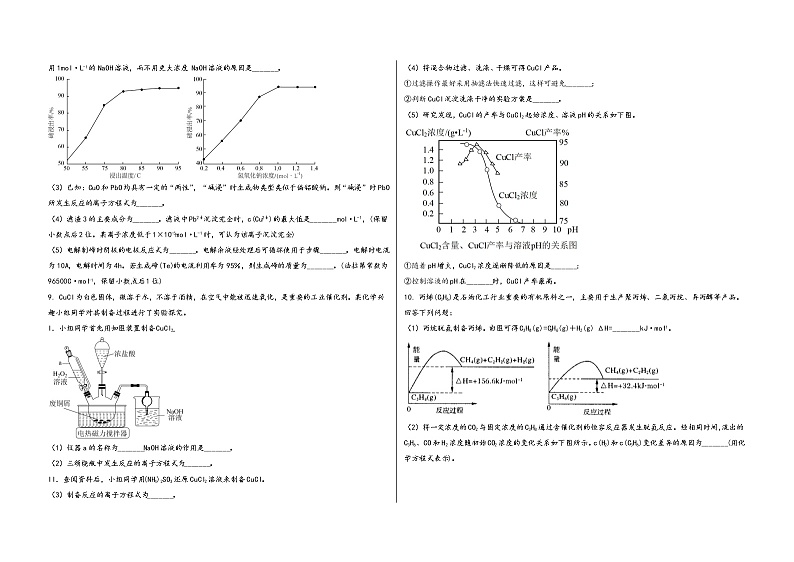
(2)下图分别是温度和NaOH溶液浓度对碲浸出率的影响,则碱浸时的合适温度是_______。实际生产中采用1mol·L-1的NaOH溶液,而不用更大浓度 NaOH溶液的原因是_______。
(3)已知:CuO和PbO均具有一定的“两性”,“碱浸”时生成物类型类似于偏铝酸钠。则“碱浸”时PbO所发生反应的离子方程式为_______。
(4)滤渣3的主要成分为_______。滤液中Pb2+沉淀完全时,c(Cu2+)的最大值是_______mol·L-1,(保留小数点后2位。某离子浓度低于1×10-5mol·L-1时,可认为该离子沉淀完全)
(5)电解制碲时阴极的电极反应式为_______。电解余液经处理后可循环使用于步骤_______。电解时电流为10A,电解时间为4h。若生成碲(Te)的电流利用率为95%,则生成碲的质量为_______。(法拉第常数为96500C·mol-1,保留小数点后1位)
9. CuCl为白色固体,微溶于水,不溶于酒精,在空气中能被迅速氧化,是重要的工业催化剂。某化学兴趣小组同学对其制备过程进行了实验探究。
I.小组同学首先用如图装置制备CuCl2。
(1)仪器a的名称为_______NaOH溶液的作用是_______。
(2)三颈烧瓶中发生反应的离子方程式为_______。
II.查阅资料后,小组同学用(NH4)2SO3还原CuCl2溶液来制备CuCl。
(3)制备反应的离子方程式为_______。
(4)将混合物过滤、洗涤、干燥可得CuCl产品。
①过滤操作最好采用抽滤法快速过滤,这样可避免_______;
②判断CuCl沉淀洗涤干净的实验方案是_______。
(5)研究发现,CuCl的产率与CuCl2起始浓度、溶液pH的关系如下图。
①随着pH增大,CuCl2浓度逐渐降低的原因是_______;
②控制溶液的pH在_______时,CuCl产率最高。
10. 丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)=C3H6(g)+H2(g) ΔH=_______kJ·mol-1。
(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应。经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如下图所示。c(H2)和c(C3H6)变化差异的原因为_______(用化学方程式表示)。
(3)已知Arrhenius 经验公式为Rlnk=RlnA-(Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为_______J·mol-1,当其实验数据发生变化如图中b线所示,则可能的原因是_______。
(4)工业上用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3 (g)
②CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3和Cl2发生反应,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 58 | 58 |
该温度下,若平衡时HC1的体积分数为10%。此时CH2=CHCH3的转化率为_______。反应①的压力平衡常数Kp=_______kPa-1(保留小数点后2位)。
(5)一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图所示。
保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是_______。
A. 适当提高反应温度 B. 改变催化剂
C. 适当降低反应温度 D. 改变反应物浓度
(二)选考题(.请考生从给出的2道题任选一题作答,并用2B铅笔在答题卡上把所选题目题号后的方框涂黑。注意所做题目的题号必修与所涂题目的题号一致,并且在解答过程中写清每问的小题号,在答题卡指定位置答题。如果多做,则每学科按所做的第一题计分。
【化学--选修3:物质结构与性质】
11. 目前已经确认了16种元素是植物生长所必需的,其中硼、铁、铜、钼等7种元素为必需的微量元素。回答下列问题:
(1)钼位于第5周期与Cr同族,试写出钼的基态价电子排布式_______,钼位于周期表第_______纵行。
(2)铁元素能与多种分子或离子形成配位键,如[FeCl2(H2O)4]+、Fe(CO)5。
①[FeCl2(H2O)4]+中每个H2O的O周围σ键电子对有_______对,游离态的水中H-O-H的键角比该配离子中H-O-H的键角小,其原因是_______。
②CO分子中C原子和O原子,上均存在孤电子对,在Fe(CO)5中_______(填元素符号)更容易Fe提供孤电子对。
(3)硼氢化钠(NaBH4)具有很强的还原性,常用于有机合成,的VSEPR模型为_______与其互为等电子体的阳离子有_______(写一种)。
(4)一种铜的溴化物立方晶胞如图所示。
该化合物的化学式为_______,在晶体中与Br紧邻的Br有_______个,若Cu原子与最近的Br原子的核间距为apm,则该晶体的密度计算表达式为_______g·cm-3(用NA表示阿伏加德罗常数的值)。
【化学--选修5:有机化学基础】
12. 以芳香族化合物A为原料制备某药物中间体G的路线如图:
已知:①同一碳原子上连两个羟基时不稳定,易发生反应:RCH(OH)2→RCHO+H2O。
②R1CHO+R2CH2COOHR1CH=CHR2+CO2↑+H2O。
③
请回答下列问题:
(1)G中含氧官能团的名称为____。
(2)C→D的反应类型是____,C的分子式为____。
(3)E的结构简式为____。
(4)F→G的化学方程式为____。
(5)H是D的同分异构体,同时满足下列条件的H有____种(不包括立体异构)。
①遇氯化铁溶液发生显色反应;
②能发生水解反应;
③苯环上只有两个取代基。
其中,核磁共振氢谱显示4组峰,且峰的面积之比为3:2:2:1的结构简式为____(写一种即可)。
(6)根据上述路线中的相关知识,设计以 和乙酸为原料制备 的合成路线____。(无机试剂任选)
参考答案
一.选择题
1. B 2. B 3. A 4. B 5. C 6. C 7. B
二. 非选择题
8. (1)粉碎
(2)①. 80℃~90℃ ②. 当NaOH溶液浓度为1 mol∙L-1时浸出率已很高,若再增大浓度浸出率没有明显提高,且会导致后续在调pH时消耗更多的硫酸,增加成本
(3)PbO+2OH-=PbO+H2O
(4) ① CuS、PbS ②. 6.67×10-13
(5)①. TeO+4e-+3H2O=Te+6OH- ②. 碱浸和溶解TeO2 ③. 45.4 g
9. (1)①. 恒压漏斗(或恒压滴液漏斗) ②. 吸收挥发出来的HCl,防止污染空气
(2)Cu+H2O2+2H+Cu2++2H2O
(3)2Cu2+++2C1-+H2O=2CuCl↓++2H+
(4)①. CuCl被空气氧化 ②. 取最后一次洗涤液于试管中,向其中加入过量盐酸,再滴加氯化钡溶液,若无白色沉淀生成,则洗涤干净
(5)①. 随着pH增大,Cu2+水解程度增大 ②. 3.2(3-4之间的合理答案均可)
10. (1)+124.2kJ·mol-1
(2)CO2+H2CO+H2O
(3)①. ②. 催化剂中毒(答案合理即可)
(4)①. 69.5% ②. 0.15
(5)AB
11. (1)①. 4d55s1 ②. 6
(2)①. 3 ②. 游离态的水分子中O原子孤电子对对σ键的斥力比该配离子水分子中O原子的σ键之间的斥力大,造成H—O—H键角减小 ③. C
(3)①. 正四面体 ②.
(4)①. CuBr ②. 12 ③.
12. (1)(酚)羟基、酯基
(2) ①. 取代反应 ②. C7H5BrO2
(3)
(4) ++H2O
(5)①. 9 ②. (或)
(6)
山西省长治市郊区2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份山西省长治市郊区2023届高三(上)摸底检测化学试题(word版,含答案),共7页。试卷主要包含了5 Ti-48 Zn-65, 常温下,向1L0等内容,欢迎下载使用。
山西省朔州市朔城区2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份山西省朔州市朔城区2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65,5NA等内容,欢迎下载使用。
山西省盂县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份山西省盂县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65, 实验测得0,62,10ml/L等内容,欢迎下载使用。












