



鲁科版 (2019)必修 第一册第1节 铁的多样性学案
展开
这是一份鲁科版 (2019)必修 第一册第1节 铁的多样性学案,文件包含312铁的其他化合物及其相互转化-2021-2022学年高一化学精讲精练新鲁科版必修第一册解析版docx、312铁的其他化合物及其相互转化-2021-2022学年高一化学精讲精练新鲁科版必修第一册原卷版docx等2份学案配套教学资源,其中学案共226页, 欢迎下载使用。
3.1.2 铁的其他化合物及其相互转化
考点精讲
考点1:铁的氧化物
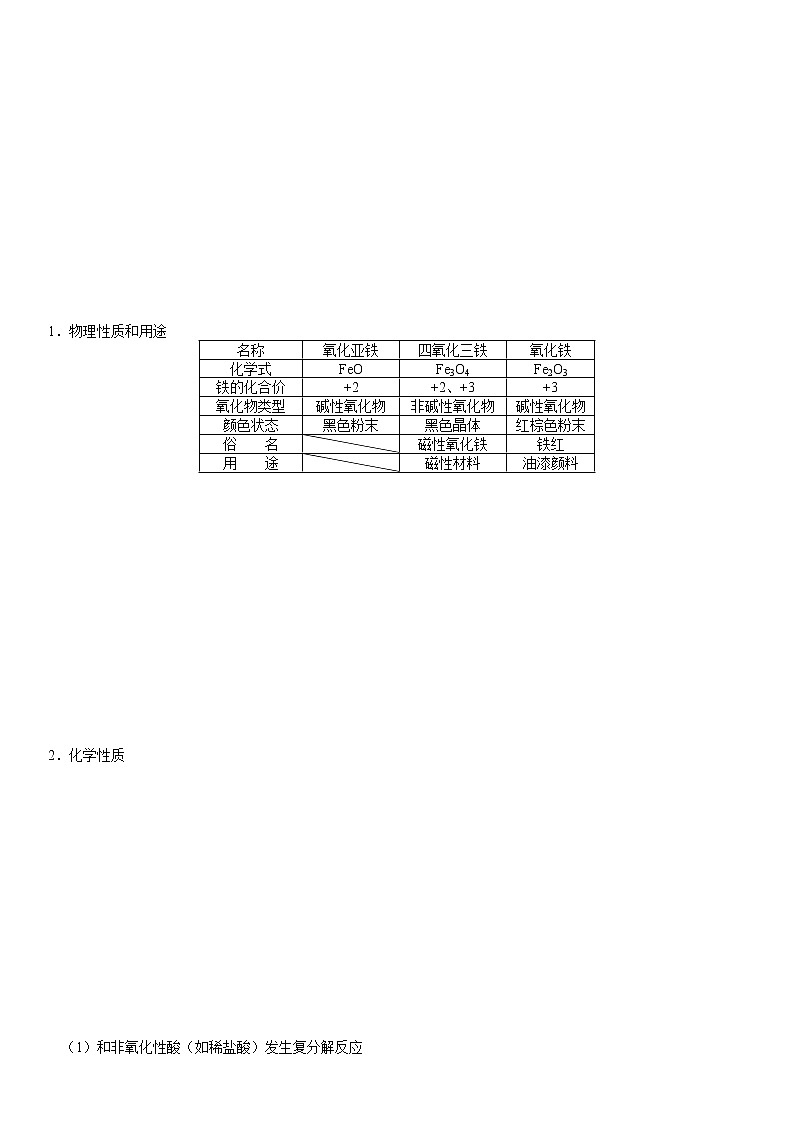
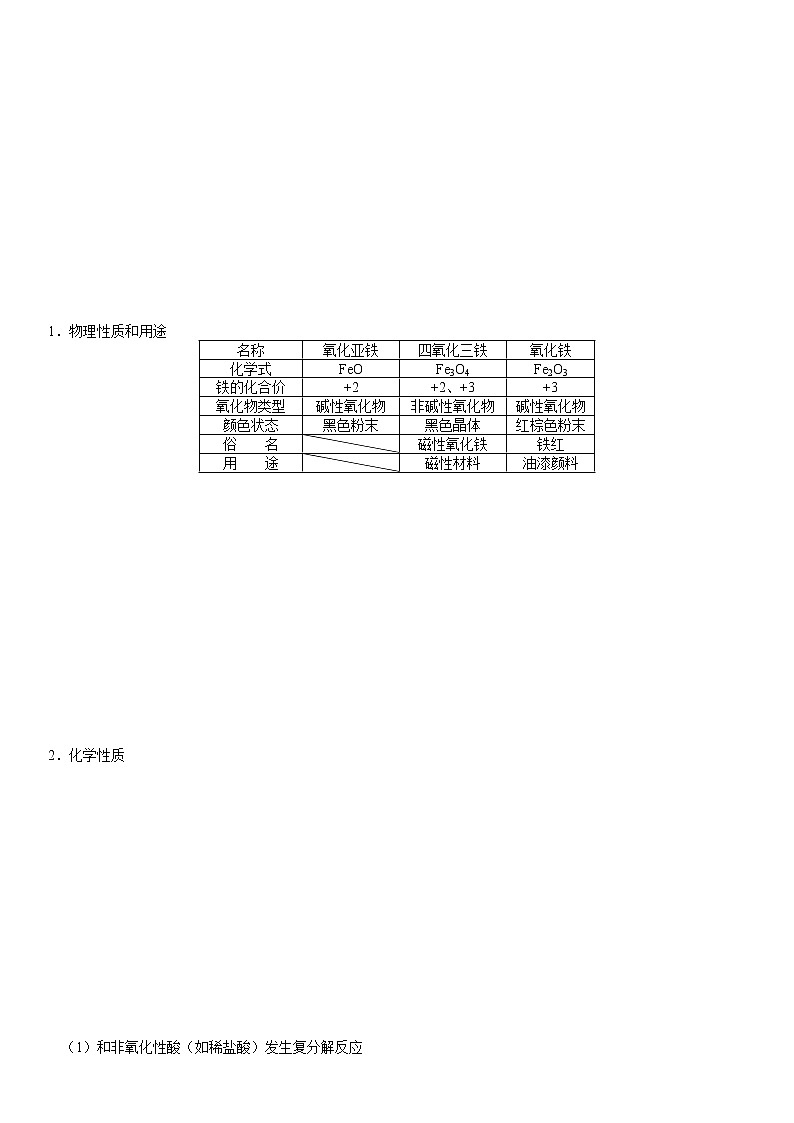
1.物理性质和用途
名称
氧化亚铁
四氧化三铁
氧化铁
化学式
FeO
Fe3O4
Fe2O3
铁的化合价
+2
+2、+3
+3
氧化物类型
碱性氧化物
非碱性氧化物
碱性氧化物
颜色状态
黑色粉末
黑色晶体
红棕色粉末
俗 名
磁性氧化铁
铁红
用 途
磁性材料
油漆颜料
2.化学性质
(1)和非氧化性酸(如稀盐酸)发生复分解反应
①FeO:FeO+2H+Fe2++H2O
②Fe3O4:Fe3O4+8H+Fe2++2Fe3++4H2O
③Fe2O3:Fe2O3+6H+2Fe3++3H2O
(2)能够被某些还原剂还原(以Fe3O4为例)
①H2:FeO+H2Fe+H2O
②CO:Fe2O3+3CO2Fe+3CO2(高炉炼铁的主反应)
③C:Fe3O4+2C3Fe+2CO2↑
④Al:2Al+Fe2O32Fe+Al2O3(铝热反应)
【典例1】(2020·山西晋阳高一上学期期末)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
①按上图组装仪器,检查装置的气密性;②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为________________________________。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的质量分数为____________。
Ⅱ.铁矿石中含铁量的测定
(3)溶液A中铁元素可能的存在形式______________;
(4)请从以下试剂中选择最佳试剂用最简单的实验验证A中铁元素的存在形式,试剂为:________________。
a.酸性KMnO4溶液 b.NaOH溶液
c.KSCN溶液 d.氯水
(5)步骤④中煮沸的作用是________________________。
(6)若滴定过程中KI变成I2,消耗0.5000mol·L-1的KI溶液20.00mL,则铁矿石中铁的质量分数为________。
(7)由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为___________。
【举一反三】
(1)如何通过实验证明步骤③通入的Cl2过量?
(2)步骤⑤用到的主要玻璃仪器是什么?
【技巧与方法】确定铁的氧化物组成的方法
1.简单的铁的氧化物:元素物质的量比法
(1)方法:计算铁和氧的物质的量之比,n(Fe)∶n(O)=a∶b
(2)结果
①若a∶b=1∶1,则铁的氧化物为FeO;
②若a∶b=2∶3,则铁的氧化物为Fe2O3;
③若a∶b=3∶4,则铁的氧化物组成如下表:
氧化物组成
Fe3O4
FeO与Fe2O3
FeO、Fe2O3、Fe3O4
物质的量比
1∶1
1∶1∶x(x为任意值)
2.混合价态铁的氧化物:FeO和Fe2O3组合法
(1)已知铁的氧化物为FeaOb,设化学式为nFeO·mFe2O3
(2)根据铁元素和氧元素守恒:计算m、n的数值即可。
【针对训练】
1.中国每年要进口5亿吨左右的铁矿石,占世界海上铁矿石贸易量的一半以上,关于铁矿石的说法正确的是( )。
A.赤铁矿的主要成分是Fe3O4
B.铁矿石的主要成分与铁锈的主要成分相同
C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色
D.FeO俗称铁红
2.下列有关铁矿石与铁的氧化物的说法中正确的是( )。
A.赤铁矿的主要成分是Fe3O4,磁铁矿的主要成分是Fe2O3,FeO俗称铁红
B.铁矿石的主要成分与铁锈的主要成分相同
C.铁的氧化物都不溶于水,也不与水反应
D.铁的氧化物能与酸反应生成盐和水,因此Fe3O4、Fe2O3、FeO都是碱性氧化物
3.(2021·武汉高一检测)铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )。
A.FeO·3Fe2O3 B.2FeO·3Fe2O3
C.FeO·2Fe2O3 D.2FeO·Fe2O3
4.实验室用下图装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
(1)为了安全,在点燃D处的酒精灯之前,在b处必须______________。
(2)装置B的作用是_______________________________________,装置C中盛装的液体是__________。
(3)若为FeO和Fe2O3物质的量之比1∶1的固体混合物,反应完全后,U形管的质量增加7.2g,则混合物中Fe2O3的质量为__________。
(4)U形管E右边连接干燥管F的目的是_____________________,若无干燥管F,测得Fe2O3的质量将__________(填“偏大”“偏小”或“无影响”)。
考点2:铁的氢氧化物
1.物理性质和制备
Fe(OH)2
Fe(OH)3
颜色状态
白色固体
红褐色固体
水溶性
难溶于水
难溶于水
制备
Fe3++3OH-Fe(OH)3↓
Fe2++2OH-Fe(OH)2↓
2.化学性质
(1)稳定性
①Fe(OH)3:2Fe(OH)3Fe2O3+3H2O
②Fe(OH)2:4Fe(OH)2+O2+2H2O4Fe(OH)3↓(白色沉淀灰绿色红褐色)
(2)与稀盐酸反应
①Fe(OH)3:Fe(OH)3+3H+Fe3++3H2O
②Fe(OH)2:Fe(OH)2+2H+Fe2++2H2O
【典例2】(2019·浙江选考)某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:
(1)仪器1的名称为___________。装置5的作用为____________________。
(2)实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中:_____________。
(3)装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因____________________________。
【举一反三】
(1)如何排除装置3、4及溶液中的氧气?
(2)用化学方程式表示4中析出灰绿色沉淀的原因。
【技巧与方法】Fe(OH)2的制备实验
由于Fe(OH)2不稳定,很容易被氧气氧化,所以实验室制备Fe(OH)2一定要做到隔绝氧气。配制溶液的蒸馏水要煮沸,以除去水中的氧气。通过设置相关实验装置以隔绝空气,如以下装置:
【针对训练】
1.下列关于Fe(OH)2的制备能够成功的是( )。
A.向FeCl2溶液中逐滴加入NaOH溶液
B.向FeSO4溶液中逐滴加入氨水
C.先将装有NaOH溶液的长滴管插入FeSO4溶液液面下,再挤出NaOH溶液可制得Fe(OH)2白色沉淀
D.取适量新配制的FeSO4溶液于试管中,再加入一层植物油(密度小于水,且不溶于水),然后向试管内逐滴加入NaOH溶液
2.(2019·太原高一检测)实验室用如图所示装置制取Fe(OH)2,下列说法正确的是( )。
A.FeSO4溶液为黄色
B.苯的作用是隔离氧气
C.可将苯换成酒精进行实验
D.沉淀的颜色变化是白色→灰绿色→红褐色
3.将新制的Fe(OH)2沉淀过滤出来,在空气中加热,所生成的产物是( )。
A.FeO B.Fe3O4 C.Fe2O3 D.Fe
4.14g铁溶于足量盐酸中,加入NaOH溶液,得到红褐色沉淀,过滤,将红褐色沉淀加热灼烧,得到红棕色粉末的质量是( )。
A.1g B.1.6g C.2g D.1.8g
考点3:铁的及其化合物之间的转化关系
1.铁元素的类价图
2.铁及其常见化合物间的转化关系
(1)通过氧化还原反应实现的转化
①Fe+2HClFeCl2+H2↑或2FeCl3+Fe3FeCl2
②2Fe+3Cl22FeCl3
③FeCl2+ZnZnCl2+Fe
④2FeCl2+Cl22FeCl3
⑥2FeCl3+3Zn(过量)2Fe+3ZnCl2
⑦2FeCl3+Fe3FeCl2或2FeCl3+Cu2FeCl2+CuCl2
⑩4Fe(OH)2+O2+2H2O4Fe(OH)3↓
(2)通过非氧化还原反应实现的转化
⑤FeCl2+2NaOHFe(OH)2↓+2NaCl
⑧FeCl3+3NaOHFe(OH)3↓+3NaCl
⑨Fe(OH)2+2HClFeCl2+2H2O
⑾2Fe(OH)2FeO+2H2O(隔绝空气)
⑫Fe(OH)3+3HClFeCl3+3H2O
⒀2Fe(OH)3Fe2O3+3H2O
⑭Fe2O3+6HCl2FeCl3+3H2O
⑮Fe2O3+6HCl2FeCl3+3H2O
【典例3】(2021·九江高一检测)利用“价类二维图”研究物质的性质,是一种有效的学习方法。以下是铁元素及其化合物的二维图的部分信息。
(1)X、Y的化学式分别为_________,_________。
(2)图中只具有还原性的物质是_________(写化学式)。
(3)可以证明FeCl2既具有氧化性又具有还原性的试剂分别为_________、_________(任举一例即可)。
(4)某实验小组设计如下实验探究亚铁盐的性质。
实验方案
现象
Ⅰ
1.0mL0.1mol/LFeSO4溶液中滴入1.0mL0.5mol/LNaOH溶液
生成白色沉淀,3min后沉淀基本变为红褐色
Ⅱ
1.0mL0.1mol/LFeSO4溶液中滴入1.0mL 0.5mol/L NaHCO3溶液
生成白色沉淀,3min后沉淀颜色几乎不变
①实验I中最后生成红褐色沉淀的化学方程式是_______________________。
②对实验II所得白色沉淀展开研究:(已知Fe(HCO3)2常温常压下在水中不能大量存在)
i.取II中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
根据以上现象,实验II中生成的白色沉淀的化学式为______________。
③研究过程中发现实验II中白色沉淀在空气中久置最终也变为红褐色。则该沉淀比实验I中所得的Fe(OH)2的还原性_________(填“强”或“弱”)。
【举一反三】
(1)写出实验II生成白色沉淀的离子方程式。
(2)写出实验II中白色沉淀在空气中久置最终也变为红褐色的化学方程式。
【针对训练】
1.(2021·江西临川高一检测)铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )。
A.Fe(OH)3、Fe2O3 B.Fe(OH)2、Fe2O3
C.Fe(OH)2、Fe(OH)3 D.Fe(OH)2、Fe3O4
2.下列变化中不可能通过一步反应完成的是( )。
A.Fe2O3→Fe(OH)3 B.FeCl2→Fe(OH)2
C.Fe→Fe3O4 D.Fe(OH)2→Fe(OH)3
3.几种物质间的相互转化关系如图所示:
(1)在A转化为B及气体的反应中应加入的试剂是________(填化学式)。
(2)写出B的化学式:__________,F的化学式:__________。
(3)写出G→H的化学方程式:______________________。
(4)写出检验D溶液中金属阳离子的方法:________________(用离子方程式表示);向D溶液中加入A,发生反应的离子方程式是__________________。
合格考达标练
1.(2020·温州学考模拟)火星被称为“红色的星球”,这是因为它的岩石和土壤中含有丰富的( )。
A.FeO B.Fe3O4 C.Fe2O3 D.Fe
2.录音磁带是在醋酸纤维、聚酯纤维等纤维制成的片基上均匀涂上一层磁性材料--磁粉制成的。制取该磁粉的主要物质是( )。
A.FeO B.Fe2O3 C.Fe3O4 D.Al2O3
3.(2021·开封高一检测)在稀硫酸中加入适量铁粉,反应完全后再加入适量氢氧化钠溶液,放置片刻,从反应体系中观察到颜色变化是( )。
A.无色→灰绿色→红褐色
B.无色→浅绿色→白色→灰绿色→红褐色
C.灰绿色→绿褐色→蓝色
D.无色→白色→浅绿色→灰绿色→红褐色
4.下列实验可以制得铁红的是( )。
A.铁丝在氧气中燃烧
B.在空气中加热氢氧化铁
C.隔绝空气加热氢氧化亚铁
D.红热的铁丝与水蒸气反应
5.(2021·南昌高一检测)下列离子方程式中,正确的是( )。
A.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.氯气与氯化亚铁溶液反应:2FeCl2+Cl2=2FeCl3
C.氯化铁溶液与铁反应:Fe3++Fe=2Fe2+
D.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓
6.能与大量Fe3+共存的是( )。
A.Fe B.S2- C.Cu2+ D.Cu
7.在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )。
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
8.在铁的某种氧化物中,铁元素与氧元素的质量比为21∶8,则该氧化物的化学式是( )。
A.FeO B.Fe3O4 C.Fe2O3 D.Fe5O7
9.(2020·山东合格考)高铁酸钠(Na2FeO4)是一种常用水处理剂。工业湿法制备高铁酸钠的离子方程式为2Fe(OH)3+3ClO-+4OH-2FeO42-+3Cl-+5H2O。下列说法错误的是( )。
A.Na2FeO4中Fe的化合价为+6
B.FeO42-是还原反应的产物
C.生成1mol Cl-转移2 mol电子
D.Na2FeO4杀菌的同时形成Fe(OH)3胶体能吸附悬浮杂质
10.(2020·北京合格考真题)硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是( )。
A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+
B.过程②中,Fe3+作氧化剂
C.回收S的总反应为2H2S+O2=2H2O+2S↓
D.过程③中,各元素化合价均未改变
11.写出除去下列杂质(括号内)所用的试剂或方法,并写出对应的离子方程式(无离子方程式的写化学方程式)。
编号
物质
试剂(或方法)
离子方程式
①
FeCl3溶液(FeCl2)
②
FeCl2溶液(FeCl3)
③
FeCl2溶液(CuCl2)
④
Cu粉(Fe粉)
12.(2020·玉林高一检测)某金属A及其化合物之间有如下的转化关系:
(1)请写出A、B、C的化学式:A__________;B__________;C__________。
(2)写出E转化为C的化学方程式:_____________________________。
(3)写出A转化为D的离子方程式:_____________________________。
等级考提升练
1.“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能是( )。
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
2.(2020·沈阳高一检测)实验室用FeCl2和烧碱制备Fe(OH)2,为了使生成的产物不容易被氧化,下列说法不正确的是( )。
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入试管内
D.产生Fe(OH)2沉淀后,不能振荡试管
3.(2020·哈尔滨高一检测)已知反应Fe3O4+4CO3Fe+4CO2,下列说法正确的是( )。
A.铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸
B.Al可替换CO置换出Fe,说明Al比Fe活泼,并且只能和酸反应置换出氢气
C.Fe3O4俗称磁性氧化铁,FeO在空气中受热可转化为Fe3O4
D.碳钢主要是由Fe3O4和碳组成的合金
4.(2020·湖州高一检测)某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体,实验装置如图所示(夹持装置略,气密性已检验),下列推断不合理的是( )。
A.B中收集到的气体是氢气
B.烧杯中双氧水的作用是将Fe2+还原为Fe3+
C.A中的氧化铁与盐酸反应生成氯化铁
D.烧杯中的溶液在氯化氢气氛下,蒸发浓缩、冷却结晶、过滤后得到氯化铁晶体
5.(2020·太原高一检测)A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如图,下列推断正确的是( )。
A.物质B是H2 B.物质C是Cl2
C.物质D是FeCl2 D.物质F是FeCl2
6.(双选)已知下述三个实验均能发生化学反应:
①
②
③
将铁钉放入硫酸铜溶液中
向硫酸亚铁溶液中滴入几滴氯水
将铜丝放入氯化铁溶液中
下列判断正确的是( )。
A.实验①中铁钉只作还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Cu2+>Fe2+
7.(2020·烟台高一检测)新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示:
有关上述转化过程的下列叙述正确的是( )。
A.MFe2O4表现了还原性
B.MFe2Ox表现了还原性
C.SO2和NO2表现了还原性
D.SO2和NO2发生了分解反应
8.如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈红色,判断下列说法中不正确的是( )。
A.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
B.该条件下H2燃烧的产物中可以含有一定量的H2O2、H2O等
C.将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性
D.酸性FeSO4溶液中加入双氧水的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O
9.(2020·北京昌平区高一检测)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
以下说法不正确的是( )。
A.①中一定发生了氧化还原反应
B.污水处理中产生Fe(OH)3胶体,使悬浮物聚沉,利用了胶体具有较强吸附能力的特点
C.另一种在碱性条件下制备K2FeO4的反应可能是:2Fe(OH)3+3ClO-=2FeO42-+3Cl-+4H++H2O
D.K2FeO4还可以用于处理废水,例如可以把废水中的CN-转化为两种无毒气体,反应过程中,CN-做还原剂,被K2FeO4氧化
10.已知氧化性:Fe3+>I2>SO42-,下列说法或离子方程式正确的是( )。
A.反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+可以进行
B.Fe3O4可写成FeO·Fe2O3,Fe3I8可写成FeI2·2FeI3
C.还原性:Fe2+>SO2>I-
D.反应H2SO4(浓)+2HI=I2+SO2↑+2H2O不能进行
11.根据表中信息判断,下列选项不正确的是( )。
反应
①
②
③
反应物
FeCl3、Cu
FeBr2、Cl2(少量)
KMnO4和浓盐酸
生成物
CuCl2……
FeCl3、FeBr3
MnCl2、Cl2……
A.反应①的另一产物不可能是Fe
B.反应②中若FeBr2与过量Cl2反应有Br2生成,说明还原性:Fe2+>Br-
C.反应③中氧化剂和还原剂的物质的量之比为1∶8
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Cu2+
12.(双选)部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是( )。
A.滤液A中的阳离子为Fe2+、H+
B.样品中Fe元素的质量为2.24g
C.样品中CuO的质量为4.0g
D.V=896
13.铁是人体中必需微量元素中含量最多,体内缺失会引起贫血。含FeO42-的盐具有强氧化性,能杀菌消毒,如高铁酸钾是一种新型、高效的消毒剂及绿色净水剂。铁及其化合物之间的相互转化可用下式表示:
请回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是_____(选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+→Cu2++5Fe2++2S,则下列说法正确的是______(选填序号);
a.反应中,所有铁元素均被还原
b.从物质的组成来看,黄铜矿属于复盐
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,有46gCuFeS2参加反应
(3)下列是工业制取高铁酸钾的一种方法,请在方框内填上合适的微粒符号并配平该离子方程式:
____Fe3++______+___Cl2→____FeO42-+___Cl-+______
14.(2018·6月山东合格考真题)利用下图可以从不同的角度研究含铁物质的性质及其转化关系。图中甲~己均含铁元素。回答下列问题:
(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析是因其具有______性;下列关于乙的说法正确的是______(填序号)。
a.属于酸性氧化物,能与碱反应
b.属于碱性氧化物,能与酸反应
c.属于两性氧化物,既能与酸反应,又能与碱反应
(2)已知甲与稀硝酸反应的化学反应方程式为:甲+HNO3(稀)→戊+己+NO↑+H2O(方程式未配平)。若产物中戊和己的物质的量之比为3∶1,则甲与HNO3的物质的量之比为______。
(3)戊与烧碱溶液反应生成丙,放置一段时间后丙转化为丁。丙转化为丁的化学方程式为____________________________________,现象为__________________。
15.化学学习小组为测定“阳光”牌小包装中Fe粉和活性炭质量之比进行了以下探究:
查阅资料:“阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水。
实验步骤:
步骤一:取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。
步骤二:将步骤一中的固体溶于水,过滤,将滤渣洗涤、干燥,以除去“脱氧剂”中NaCl和水;
步骤三:取步骤二中的滤渣,将其分为两等份,每一份质量为16.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量得澄清石灰水,得到干燥、纯净的沉淀20.0g。
步骤四:将步骤三中的另一份滤渣放入烧杯中,加入一定体积足量的稀H2SO4,微热至反应完全。
步骤五:向步骤四的混合物中加入过量的氢氧化钠溶液,过滤后得固体,经洗涤后转移到坩埚中充分加热,冷却、称量,得到固体质量仍为16g。
请回答下列问题:
(1)由步骤一可知,上述“脱氧剂”中的红棕色物质为_________(填化学式);
(2)由步骤三可知,16.0g滤渣中活性炭的质量为_________g;
(3)综上实验所知:该“脱氧剂”中未被氧化的Fe粉和活性炭质量之比为______;
(4)该“脱氧剂”中,铁已被氧化的百分率为_________。
相关学案
这是一份高中第3章 物质的性质与转化第1节 铁的多样性导学案,文件包含311铁与铁盐-2021-2022学年高一化学精讲精练新鲁科版必修第一册解析版docx、311铁与铁盐-2021-2022学年高一化学精讲精练新鲁科版必修第一册原卷版docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
这是一份2020-2021学年第2节 硫的转化学案设计,文件包含322硫酸及其酸雨-2021-2022学年高一化学精讲精练新鲁科版必修第一册解析版docx、322硫酸及其酸雨-2021-2022学年高一化学精讲精练新鲁科版必修第一册原卷版docx等2份学案配套教学资源,其中学案共23页, 欢迎下载使用。
这是一份鲁科版 (2019)必修 第一册第3节 氮的循环导学案,文件包含331氮及其氧化物-2021-2022学年高一化学精讲精练新鲁科版必修第一册解析版docx、331氮及其氧化物-2021-2022学年高一化学精讲精练新鲁科版必修第一册原卷版docx等2份学案配套教学资源,其中学案共134页, 欢迎下载使用。










