






高中化学人教版 (2019)必修 第二册第一节 硫及其化合物授课ppt课件
展开【课程标准要求】 1.能从物质类别和硫元素化合价的角度认识硫酸的性质。2.通过实验探究浓硫酸的吸水性、脱水性和强氧化性,学会硫酸根离子的检验方法。
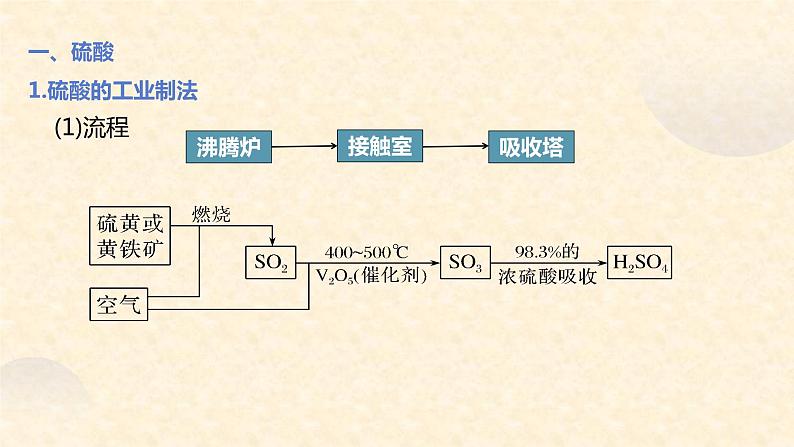
一、硫酸1.硫酸的工业制法
①制气:燃烧硫黄:_________________________________煅烧黄铁矿:_______________________________________②氧化:__________________________________________③吸收:_____________________________________________提醒 工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
SO3+H2O===H2SO4
纯净的硫酸是________黏稠油状液体,密度比水________,能与水以任意比混合,沸点________,难挥发。
(2)稀硫酸——具有酸的通性
①硫酸是一种二元强酸,硫酸的电离方程式:_______________________,②具有酸的通性,能使酸碱指示剂变色,与活泼金属、碱性氧化物、碱、盐等物质发生反应。请写出下列反应的离子方程式。a.和活泼金属(如Fe):____________________________________;b.和金属氧化物(如MgO):________________________________;c.和碱[如Mg(OH)2]:_____________________________________;d.和盐(如Na2CO3):______________________________________。
Fe+2H+===Fe2++H2↑
MgO+2H+===Mg2++H2O
Mg(OH)2+2H+===Mg2++2H2O
(3)浓硫酸的三大特性
一、浓硫酸的三大特性探析
实验1:浓硫酸与蔗糖的反应实验装置:
———————【活动探究】———————
实验2:浓硫酸与铜的反应实验操作:在带导管的橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。在试管中加入2 mL浓硫酸,塞好橡胶塞,使铜丝与浓硫酸接触。加热,将产生的气体先后通入品红溶液和石蕊溶液中,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,观察溶液的颜色。实验装置:
无明显现象,说明铜与浓硫酸常温下不反应
品红溶液褪色,紫色石蕊溶液变红,说明生成了SO2
试管内溶液呈蓝色,说明生成了硫酸铜
1.蔗糖和浓硫酸的“黑面包”实验中,根据实验现象,推测可能发生了哪些化学反应?反应后的产物是什么?主要体现了浓硫酸的哪些化学性质?提示: 蔗糖(C12H22O11)变黑说明有炭生成; 体积膨胀,呈疏松多孔状,说明有大量气体产生;刺激性气味的气体,有可能是SO2;在此过程中,炭可能和浓硫酸发生了反应,生成了CO2和SO2气体。浓硫酸先表现为脱水性,然后表现为强氧化性。
2.如何通过实验证明碳与浓硫酸反应的产物有SO2和CO2?
3.用足量的铜片与含2 ml H2SO4的浓硫酸反应能否得到1 ml SO2?足量的木炭与含2 ml H2SO4的浓硫酸反应能否得到1 ml SO2?提示:都不能。随着反应进行,硫酸浓度降低到一定程度后,与铜或木炭均不反应。
1.浓硫酸吸水性、脱水性的区别
———————【核心归纳】———————
2.浓硫酸强氧化性的体现
【微自测】1.下列描述中正确的打“√”,错误的打“×”。
(1)工业上制取硫酸常用水吸收SO3( )(2)工业上制取硫酸过程中SO2能完全转化为SO3( )(3)浓硫酸有脱水性,因此可以用于干燥H2、CO2等气体( )(4)浓硫酸能使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的脱水性( )(5)金属铜在常温下放入浓硫酸无现象,是浓硫酸把铜钝化了( )(6)浓硫酸具有强氧化性,而稀硫酸无氧化性( )(7)浓硫酸有强烈的吸水性,因此可以干燥SO2、H2S、HI、NH3等气体( )
3.浓硫酸和稀硫酸的区别
1.下列有关说法中正确的是( )
A.浓硫酸在常温下能够使铁、铝等金属钝化,因此浓硫酸在常温下不能与铁、铝发生反应B.白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性C.浓硫酸主要以H2SO4分子存在D.稀硫酸和浓硫酸性质完全相同
———————【实践应用】———————
2.下列有关浓硫酸的叙述正确的是( )
A.在浓硫酸与锌片共热的反应中,浓硫酸既表现出强氧化性又表现出酸性B.浓硫酸与金属活动性顺序中排在氢后面的金属反应生成的气体一般为SO2,与氢前面的金属反应生成的气体一般为H2C.浓硫酸具有吸水性,可以干燥NH3、H2等气体D.H2SO4是不挥发性强酸,硫化氢是挥发性弱酸,所以可用浓硫酸与FeS反应制取H2S气体
硫酸根离子的检验实验操作:在三支试管中分别加入少量稀硫酸、Na2SO4溶液和 Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。
生成白色沉淀,加入盐酸后沉淀不溶解
生成白色沉淀,加入盐酸后沉淀溶解,且有气泡产生
BaSO4不溶于稀盐酸,而BaCO3可溶于盐酸,因此可以用稀盐酸和BaCl2检验SO42-
SO42-+Ba2+==BaSO4↓
CO32-+Ba2+==BaCO3↓
2H++BaCO3== Ba2+ +CO2+H2O↑
A.硫酸 B.盐酸C.NaOH溶液 D.NaNO3溶液
1.设计实验检验某溶液中含有某种离子的实验步骤是什么?
提示:设计实验检验某溶液中的离子一般包括以下四步:取样品→滴加试剂→描述现象→得出结论。
提示:不能。若溶液中含有Ag+,也会产生同样的现象:Ag++Cl-===AgCl↓(白色)。
(1)若除去粗盐中杂质(硫酸盐、CaCl2、MgCl2),将选用的试剂及反应的离子方程式填入下表:
为使杂质离子完全除去,通常加入试剂及顺序有如下三种:①BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;②NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;③BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。总结:为保障杂质离子完全除去,只要碳酸钠溶液在氯化钡溶液之后加入即可。
2.化学方法分离提纯物质的“四原则”和“三必须”(1)“四原则”:一不增(不增加新的杂质);二不减(不减少被提纯的物质);三易分离(被提纯物质与杂质易分离);四易复原(被提纯物质要易复原)。(2)“三必须”:一除杂试剂必须过量;二过量试剂必须除尽;三除杂途径必须最佳。
4.依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
(1)B的化学式是________,C的化学式是________。(2)加入过量A的目的是_________________________。(3)加入过量B的目的是________________________。(4)加热煮沸的目的是_________________________。(5)操作Ⅰ的名称是______________________。
除尽镁离子和硫酸根离子
1.下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化B.浓硫酸在常温下可迅速与铜片反应放出SO2气体C.浓硫酸是一种干燥剂,能够干燥H2、SO2等气体D.浓硫酸在常温下能与单质碳反应放出CO2气体
2.用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的量B.②中选用品红溶液验证SO2的生成C.③中选用NaOH溶液吸收多余的SO2D.为确认CuSO4生成,向①中加水,观察溶液的颜色
3.关于浓H2SO4与Cu反应的叙述正确的是( )
A.在反应中,浓H2SO4只表现出氧化性B.此反应属于复分解反应C.在反应中,浓H2SO4既表现出氧化性,又表现出酸性D.每1 ml铜参加反应就有2 ml H2SO4被还原,同时生成2 ml SO2
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教学ppt课件,共33页。PPT课件主要包含了浓硫酸的物理性质,硫酸的化学性质,物理变化,化学变化,小试牛刀,SO2,浓硫酸具有强氧化性,物质中含有H2O,作干燥剂,常见的硫酸盐等内容,欢迎下载使用。
化学必修 第二册第一节 硫及其化合物课文内容ppt课件: 这是一份化学必修 第二册第一节 硫及其化合物课文内容ppt课件,共28页。PPT课件主要包含了考纲要求,硫酸的工业制备,硫酸的性质,实验探究,a与金属单质的反应,硫酸根离子的检验等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物背景图ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物背景图ppt课件,文件包含人教版高中化学必修第二册第5章第1节基础课时2硫酸硫酸根离子的检验课件ppt、人教版高中化学必修第二册第5章第1节基础课时2硫酸硫酸根离子的检验学案doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。













