

2021海原县一中高三第二次模拟考试化学试题含答案
展开可能用到的元素相对原子质量: C—12 O—16 Na—23 Fe—56 S—32 Cu--64
7.化学与科技、社会、生产密切相关,下列说法错误的是( )
A.中国蓝是古代人工合成的蓝色化合物,其化学式为 ,可改写成
B.采煤工业中,爆破时把干冰和炸药放在一起,既能增强爆炸威力,又能防止火灾
C.“玉兔号”月球车帆板太阳能电池的材料是氮化硅或二氧化硅
D.医用防护口罩中使用的聚丙烯熔喷布,其生产原料来自石油裂解
8.扑热息痛是一种常用的解热镇痛药物,可通过下图路线合成。下列说法正确的是( )
A.甲的苯环上的一氯代物有 2 种 B.乙的分子式为 C6H6NO
C.丙分子中的所有原子可能共面 D.由乙制备丙的反应类型为加成反应
9.某白色固体混合物由中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色试验,通过钴玻璃可观察到紫色。根据实验现象可判断其组成为( )
A. B. C. D.
10.我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)关于该电池,下列说法错误的是( )
(注: TEGDME是一种有机溶剂)
A.充电时,从阳极向阴极移动
B.可以用乙醇代替 TEGDME做有机溶剂
C.放电时,当转移1 mol电子负极质量减轻23 g
D.放电时,正极反应为
11.某种固体消毒剂广泛用于游泳池消毒,其结构如图所示,其中W、X、Y、Z是原子序数依次增大的四种短周期元素,Y的最外层电子数是内层电子数的3倍。下列叙述错误的是( )
A.W和Z组成的化合物可以做灭火剂
B.原子半径:W>X>Y
C.氧化物对应的水化物的酸性:X>W
D.该化合物中X、Y、Z均满足8电子稳定结构
12.下列实验不能达到目的的是( )
选项 | 目的 | 实验 |
A | 制取较高浓度的次氯酸溶液 | 将Cl2通入碳酸钠溶液中 |
B | 加快氧气的生成速率 | 在过氧化氢溶液中加入少量MnO2 |
C | 除去乙酸乙酯中的少量乙酸 | 加入饱和碳酸钠溶液洗涤、分液 |
D | 制备少量二氧化硫气体 | 向饱和亚硫酸钠溶液中滴加浓硫酸 |
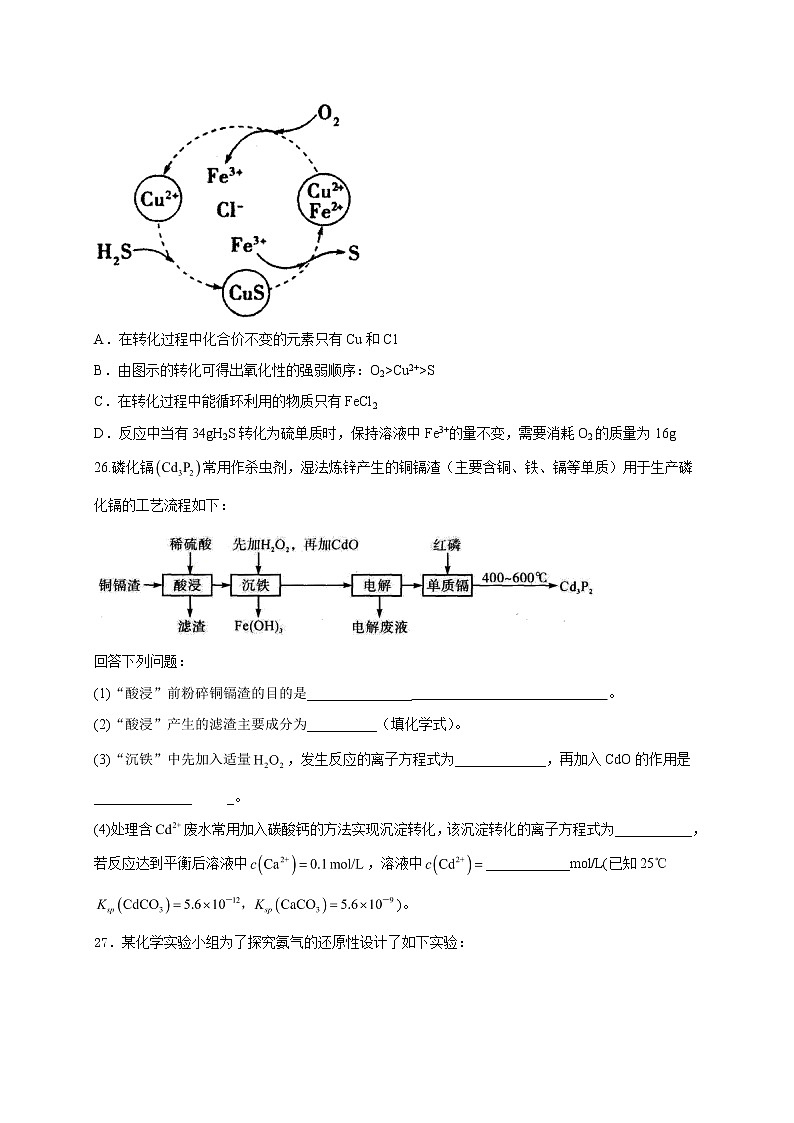
13.硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是( )
A.在转化过程中化合价不变的元素只有Cu和C1
B.由图示的转化可得出氧化性的强弱顺序:O2>Cu2+>S
C.在转化过程中能循环利用的物质只有FeCl2
D.反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为16g
26.磷化镉常用作杀虫剂,湿法炼锌产生的铜镉渣(主要含铜、铁、镉等单质)用于生产磷化镉的工艺流程如下:
回答下列问题:
(1)“酸浸”前粉碎铜镉渣的目的是_______________ 。
(2)“酸浸”产生的滤渣主要成分为__________(填化学式)。
(3)“沉铁”中先加入适量,发生反应的离子方程式为_____________,再加入CdO的作用是______________ _。
(4)处理含废水常用加入碳酸钙的方法实现沉淀转化,该沉淀转化的离子方程式为___________,若反应达到平衡后溶液中,溶液中____________mol/L(已知25℃)。
27.某化学实验小组为了探究氨气的还原性设计了如下实验:
已知:Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+ CuSO4+H2O。
(1)装置X中发生反应的化学方程式为____________,装置W的作用是____________。
(2)随着反应的进行,装置Z中的固体逐渐变成红色,为了探究红色固体的成分,充分反应后进行了如下实验:
实验操作 | 实验现象 | 实验结论 |
取少量红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 无现象 | ①红色固体为______ |
溶液变蓝 | ②红色固体中肯定含有___,可能含有____。 |
(3)为了测定该红色固体的定量组成,该化学实验小组又进行了如下实验:称量20.8 g该红色固体,加入足量稀硫酸,充分搅拌,将反应后的混合物过滤、洗涤、干燥、称重,得固体12.8 g。则20.8 g红色固体中的成分及质量为________。
(4)由(3)可知,装置Z中发生反应的化学方程式为_________。
28.甲醇是一种可再生能源,由制备甲醇可能涉及的反应如下:
反应I:
反应II:
反应II:
回答下列问题:
(1)反应II的_________,若反应I、II、III平衡常数分别为,则_______(用表示)。
(2)反应II自发进行的条件是_________(填“低温”“高温”或“任意温度”)。
(3)在一定条件下,2L恒容密闭容器中充入和,仅发生反应I,实验测得不同反应温度与体系中的平衡转化率的关系,如表所示。
①T_________500℃(填“<”“>”或“=”)
②温度为500℃时,该反应10min时达到平衡,则用H2表示的反应速率为________,该温度下,反应I的平衡常数 __________.
(4)某研究小组将一定量的和充入恒温密闭容器中,加入合适的催化剂(发生反应I、II、III),测得不同温度下体系达到平衡时,的转化率和的产率如图所示。
①该反应达到平衡后,为了同时提高反应速率和甲醇的产量,以下措施一定可行的
是__________(填标号)。
a.升高温度
b.缩小容器体积
c.分离出甲醇
d.增加浓度
②温度高于260℃时,随温度的升高甲醇产率下降的原因是____________.
35.(15分)已知Mn、Fe、Co是组成合金的重要元素,P、S、Cl是农药中的重要元素。回答下列问题:
(1)Mn元素位于元素周期表的______区,基态锰原子的价电子排布图为_____ 。
(2)P、S、Cl三种元素的第一电离能由大到小顺序为________ 。
(3)已知NH3的沸点高于PH3,原因是________ 。
(4)农药“乐果”中的主要成分O,O-二甲基-S-(N-甲基氨基甲酰甲基)二硫代磷酸酯的分子结构为:,其中N原子的杂化类型为________ 。
(5)已知P4(白磷)为正四面体结构,与氧气反应生成非极性分子P4O10,其中P在空间的相对位置不变,则P4O10中σ键和π键的数目之比为_______。
(6)已知一种立方型FeS2晶体的晶胞如图所示,则与体心Fe2+距离最近且等距离的S的数目为____ _。如可用晶胞参数为单位长度建立的坐标系表示晶胞中各原子的位置,并称作原子分数坐标,则该晶胞中体心Fe2+的坐标为__________ 。
(7)已知该立方型FeS2晶体的晶胞参数为a pm,密度为d g·cm-3, 阿伏加德罗常数的值为NA,则a与d的关系是a = ______ (用d、NA表示a)。
36.(15分)有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):
已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
②(-NH2容易被氧化);
③R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)CD的反应类型是______,I的结构简式为______。
(3)FG的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以为原料(无机试剂任选),设计制备的合成路线:______。
高三化学二模答案
7. C 8.A 9.D 10.B 11.C 12.A 13.D
26(14分).答案:(1)增加与酸的接触面积,提高原料的浸出率
(2)Cu
(3) 3分; 调节PH,使铁离子沉淀完全
(4) 3分;
27.(14分)【答案】Li3N +3H2O=3LiOH + NH3 防倒吸 Cu Cu2O Cu 14.4gCu2O、6.4gCu 9CuO+4NH33Cu+3Cu2O+2N2+6H2O
28.(15分)答案:(1) ;
(2)低温
(3)①> 1分 ; ② ;
(4)①bd
②反应Ⅰ、Ⅲ均为放热反应,温度升高平衡向逆方向移动,甲醇产率降低
35.【答案】d 1分 Cl>P>S NH3分子间存在着氢键 sp3 1分 4:1 6 1分 (,,) ×1010
36.【 答案】(1)丙二醛 (2)取代反应
(3) +(CH3CO)2O+CH3COOH (2分)
(4) d (5) 、(符合要求均可)
(6)
2021宁夏海原一中高一上学期第二次月考化学试题含答案: 这是一份2021宁夏海原一中高一上学期第二次月考化学试题含答案,共8页。试卷主要包含了5 K- 39,5L 0等内容,欢迎下载使用。
2020海原县一中高二上学期期末考试化学试题含答案: 这是一份2020海原县一中高二上学期期末考试化学试题含答案,共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2021海原县一中高二上学期期末考试化学试题含答案: 这是一份2021海原县一中高二上学期期末考试化学试题含答案











