






2.2离子反应
展开
这是一份2.2离子反应,共43页。PPT课件主要包含了考点一,水溶液中,熔融状态下,强电解质,弱电解质,考点二,真题演练·素养通关,答案C等内容,欢迎下载使用。
考纲要求1.了解电解质的概念,了解强电解质和弱电解质的概念。2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。3.了解离子反应的概念、离子反应发生的条件。4.能正确书写离子方程式。5.掌握常见离子的检验方法。6.正确判断常见离子在溶液中能否大量共存。
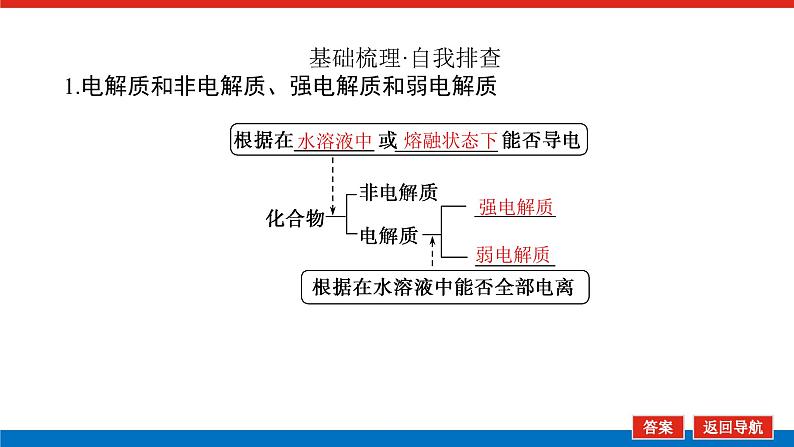
基础梳理·自我排查1.电解质和非电解质、强电解质和弱电解质
2.电解质的电离电离是指电解质在_______________状态下,离解成自由移动离子的过程。3.电离方程式的书写(1)强电解质的电离方程式中,用“____”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“____”连接。如Na2SO4:__________________,HClO:_______________。(2)多元弱酸的电离分步书写,多元弱碱的电离一步写完。如:H2CO3:__________________,___________________;Fe(OH)3:___________________。(3)酸式盐的电离多元强酸酸式盐与多元弱酸酸式盐的阴离子电离情况不同。如NaHSO4溶液中:______________________;NaHCO3溶液中:____________________、___________________。
HClO⇌H++ClO-
Fe(OH)3⇌Fe3++3OH-
4.电解质溶液的导电性(1)电解质的导电原理熔融电解质或电解质溶液中的导电微粒是________的阴、阳离子,它们在外电场作用下能产生定向移动从而导电。(2)电解质溶液导电能力大小的影响因素①电解质溶液导电能力的大小取决于溶液中_________________和____________。②温度升高时,弱电解质电离程度增大,离子浓度增大,导电性会________;但强电解质溶液的导电性________。
微点拨 强、弱电解质与物质类别的关系
考点专练·层级突破练点一 基本概念的判断1.下列说法正确的是( )A.酸、碱、盐都是电解质B.电解质都是易溶于水的物质C.氧化物都是电解质D.氢化物都不是电解质
2.今有12种物质:①Al ②稀硝酸 ③HNO3 ④液氨 ⑤CO2 ⑥空气 ⑦NaCl ⑧CaCO3 ⑨NaHCO3 ⑩酒精 ⑪Al2O3 ⑫石墨按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
练点二 电离方程式的书写与判断3.写出下列典型物质在水中的电离方程式(1)H2SO4_______________________________________________。(2)H2CO3_______________________________________________。(3)Ca(OH)2_____________________________________________。(4)Fe(OH)3_____________________________________________。(5)NH3·H2O_____________________________________________。(6)NaCl________________________________________________。(7)BaSO4_______________________________________________。(8)CH3COOH___________________________________________。
Ca(OH)2===Ca2++2OH-
NaCl===Na++Cl-
CH3COOH⇌CH3COO-+H+
练后归纳书写电离方程式的两个基本判断
基础梳理·自我排查1.离子反应(1)概念:指_________________的化学反应。(2)本质:反应物中某些离子的_____减小。(3)发生条件①复分解反应类型。②氧化还原反应类型。如FeCl3溶液与Cu反应的离子方程式为_______________________。
2Fe3++Cu===2Fe2++Cu2+
2.离子方程式(1)离子方程式:用______________________来表示反应的式子。(2)离子方程式的意义离子方程式不仅可以表示_____________________,还可以表示__________________。
实际参加反应的离子符号
3.离子方程式的书写步骤书写步骤(以CaCO3与盐酸的反应为例)
CaCO3+2HCl===CaCl2+H2O+CO2↑
CaCO3+2H++2Cl-===Ca2++2Cl-+H2O+CO2↑
CaCO3+2H+===Ca2++H2O+CO2↑
微点拨书写离子方程式时特殊情况的处理
考点专练·层级突破练点一 单一反应离子方程式的书写1.完成下列反应的离子方程式(1)MnO2与浓盐酸反应制Cl2:________________________________。(2)Na2S水溶液在空气中被氧化变质:__________________________。(3)明矾溶于水产生Al(OH)3胶体:___________________________。(4)Na2O2溶于水:_________________________________________。(5)浓盐酸与铁屑反应:____________________________________。(6)钠与CuSO4溶液反应:____________________________________。
2S2-+O2+2H2O===2S↓+4OH-
Al3++3H2O⇌Al(OH)3(胶体)+3H+
2Na2O2+2H2O===4Na++4OH-+O2↑
Fe+2H+===Fe2++H2↑
2Na+Cu2++2H2O===Cu(OH)2↓+2Na++H2↑
练点二 多重反应离子方程式的书写2.完成下列反应的离子方程式(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:_______________________________________________________。(2)CuSO4溶液与Ba(OH)2溶液混合:_______________________________________________________。(3)NH4HCO3与过量NaOH溶液混合:_______________________________________________________。(4)Ba(OH)2与H2SO4两稀溶液混合:_______________________________________________________。(5)Fe(OH)3溶于HI溶液中:_______________________________________________________。
2Fe(OH)3+6H++2I-===2Fe2++6H2O+I2
练点三 “限定条件”离子方程式的书写3.(1)Ca(HCO3)2溶液与NaOH溶液反应①NaOH不足:_________________________________________;②NaOH过量: _________________________________________。(2)Ba(OH)2溶液与NaHSO4溶液的反应①溶液呈中性时: ______________________________________;②溶液呈碱性时: ______________________________________。
4.(1)①FeBr2溶液中通入少量Cl2:_________________________________________________________;②FeBr2溶液中通入与其等物质的量的氯气:_________________________________________________________;③FeBr2溶液中通入足量Cl2:_________________________________________________________。(2)①少量铁粉加入到足量稀硝酸中:_________________________________________________________;②n(Fe)∶n[HNO3(稀)]=1∶3:_________________________________________________________;③足量铁粉加入到少量稀硝酸中:_________________________________________________________。
2Fe2++Cl2===2Fe3++2Cl-
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
练后归纳警惕离子方程式正误判断的三大陷阱(1)“原理”陷阱离子反应应符合客观事实,而命题者往往设置不符合“反应原理”的陷阱,如Fe和非氧化性酸反应应生成Fe2+,金属和氧化性酸反应不生成H2,忽略隐含反应,不符合配比关系,“===”“⇌”使用是否正确以及反应条件等。(2)“拆分”陷阱离子方程式的正误判断中,常常设置物质是否能“拆分陷阱”,氧化物、弱电解质、沉淀、多元弱酸的酸式酸根在离子方程式中均不能拆分。(3)“守恒”和“量比”陷阱离子方程式应符合质量守恒、电荷守恒和得失电子守恒,忽视某些守恒关系是命题者经常设置的“陷阱”。
6.[2019·天津卷,2]下列离子方程式能用来解释相应实验现象的是( )
相关课件
这是一份人教版高考化学一轮复习2.2离子反应课件
这是一份化学第2章 元素与物质世界第2节 电解质的电离 离子反应课文内容课件ppt,共41页。PPT课件主要包含了知识铺垫,新知预习,自主测试,意义书写步骤,探究1,探究2,探究3,素养脉络,随堂检测,答案C等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二节 离子反应示范课课件ppt,共41页。PPT课件主要包含了第一章物质及其变化,有白色沉淀生成,离子之间,离子符号,原子个数,电荷总数,相互交换离子等内容,欢迎下载使用。










