



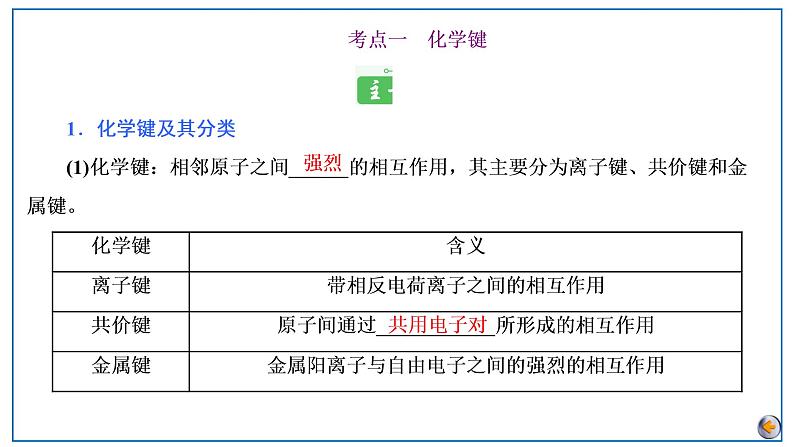
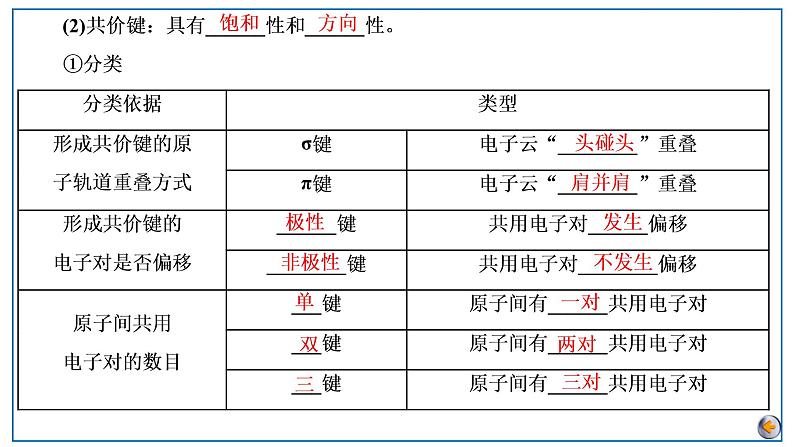





所属成套资源:2023届高考总复习 化学(人教版2019)一轮总复习课件+练习
2023版高考化学一轮复习课件 第五章 物质结构基础 第三节 化学键 分子结构与性质
展开
这是一份2023版高考化学一轮复习课件 第五章 物质结构基础 第三节 化学键 分子结构与性质,文件包含第五章物质结构基础第三节化学键分子结构与性质pptx、核心素养测评十七化学键分子结构与性质doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
核心素养测评() 化学键 分子结构与性质一、选择题:本题包括12个小题,每小题仅有1个选项符合题意。1.(2021·重庆市选择性考适应性测试)下列化学用语表述正确的是( )A.S2Cl2的结构式为Cl—S—S—ClB.S2-的结构示意图为C.PCl3的电子式为D.丙烯的球棍模型为解析:A S2-的结构示意图为,B项错误;PCl3的电子式为,C项错误;丙烯分子结构中含碳碳双键,该球棍模型表示丙烷,D项错误。2.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2催化剂,CO2+H2O。下列有关说法正确的是( )A.反应物和生成物都是非极性分子B.0.5 mol HCHO含有1 mol σ键C.HCHO、CO2分子中中心原子杂化类型相同D.HCHO能溶解在H2O中解析:D A项,HCHO、H2O都是极性分子,错误;B项,根据结构式可知,0.5 mol HCHO含有1.5 mol σ键,错误;C项,HCHO、CO2分子中中心原子分别采用sp2、sp杂化,错误;D项,HCHO和H2O都属于极性分子,HCHO能溶解在H2O中,正确。3.下列各组化合物中,化学键的类型相同的是( )A.CaCl2和Na2S B.Na2O和Na2O2C.CO2和NH4Cl D.HCl和NaOH解析:A A项,CaCl2和Na2S中都只有离子键;B项,Na2O只有离子键,而Na2O2除有离子键外,还有非极性共价键(过氧根离子中);C项,CO2中只有共价键,NH4Cl中既有离子键又有共价键;D项,HCl只有共价键,而NaOH中除有共价键(氢氧根离子中)外,还有离子键。4.下列物质性质的变化规律,与共价键的键能大小有关的是( )A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高B.HF、HCl、HBr、HI的热稳定性依次增强C.金刚石的硬度、熔点、沸点都高于晶体硅D.NaF、NaCl、NaBr、NaI的熔点依次降低解析:C A项,F2、Cl2、Br2、I2属于分子晶体,影响其熔、沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越大,沸点越高,与共价键的键能大小无关,错误;B项,HF、HI、HBr、HCl属于共价化合物,影响稳定性的因素是共价键强弱,共价键的键能越大物质越稳定,与共价键的键能大小有关,但是HF、HCl、HBr、HI的热稳定性依次减弱,错误;C项,金刚石、晶体硅属于共价晶体,原子之间存在共价键,原子半径越小,键能越大,熔、沸点越高,与共价键的键能大小有关,正确;D项,NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,键能越小,熔、沸点越低,与共价键的键能大小无关,错误。5.(2021·江苏选择性考试适应性测试)氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应为N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气。下列有关氨的说法正确的是( )A.NH3的空间结构为平面三角形B.NH3与H2O能形成分子间氢键C.NH3的水溶液不能导电D.氨催化氧化制硝酸是利用了NH3的氧化性解析:B NH3的孤电子对数为1,价层电子对数为4,其空间结构为三角锥形,故A错误;N和O的电负性比较大,半径比较小, NH3与H2O之间存在分子间氢键,也存在同种分子间氢键,故B正确;NH3溶于水得到氨水,氨水中存在自由移动的铵根离子和氢氧根离子,即可导电,故C错误;氨催化氧化制硝酸,NH3中N元素的化合价为-3价,硝酸中N元素化合价为+5价,NH3中的N元素的化合价升高,作还原剂,利用的是NH3的还原性,故D错误。6.现有下列两组命题,②组命题正确,且能用①组命题正确解释的是( )选项①组②组AH—I的键能大于H—Cl的键能HI比HCl稳定BH—I的键能小于H—Cl的键能HI比HCl稳定CHI分子间的范德华力大于HCl的HI的沸点比HCl的高DHI分子间的范德华力小于HCl的HI的沸点比HCl的低 解析:C HCl比HI稳定,是由于H—Cl的键能大于H—I的键能,故A、B错误;HI的沸点比HCl的高,是由于HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力大于HCl分子间作用力,故C正确,D错误。7.用价层电子对互斥模型(VSEPR)可以预测许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是( )A.SO2、CS2、HI都是直线形的分子B.BF3键角为120°,SnBr2键角大于120°C.CH2O、BF3、SO3都是平面三角形的分子D.PCl3、NH3、PCl5都是三角锥形的分子解析:C A.SO2是V形分子,CS2、HI是直线形的分子,错误;B.BF3键角为120°,是平面三角形结构;而Sn原子价电子数是4,在SnBr2中两个价电子与Br形成共价键,还有一个孤电子对,对成键电子对有排斥作用,使键角小于120°,错误;C.CH2O、BF3、SO3都是平面三角形的分子,正确;D.PCl3、NH3都是三角锥形的分子,而PCl5是三角双锥形分子,错误。8.某化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3°。下列推断不正确的是( )A.AB2分子的空间结构为V形B.A—B为极性共价键,AB2分子为非极性分子C.AB2与H2O相比,AB2的熔点、沸点比H2O的低D.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键解析:B 根据A、B的电负性值及其所处元素周期表中的位置关系,可判断A元素为O,B元素为F,该分子为OF2。O—F为极性共价键。因为OF2分子的键角为103.3°,OF2分子中键的极性不能抵消,所以其为极性分子。9.(2022·长春模拟)一定条件下,氨与氟气发生反应:4NH3+3F2===NF3+3NH4F,其中NF3空间结构与NH3相似。下列有关说法错误的是( )A.除F2单质外,反应物和生成物均为共价化合物B.NF3中各原子均满足8电子稳定结构C.NF3中只含极性共价键D.NH4F中既含有离子键又含有共价键解析:A NH3和NF3为共价化合物,NH4F为离子化合物。10.CH、—CH3、CH都是重要的有机反应中间体,下列有关它们的说法不正确的是( )A.碳原子均采取sp2杂化B.CH与NH3、H3O+空间结构均为三角锥形C.CH中碳原子采取sp2杂化,所有原子均共面D.CH与OH-形成的化合物中不含有离子键解析:A A项,CH中C原子采取sp2杂化,—CH3中C原子采取sp3杂化,CH中C原子采取sp3杂化,错误;B项,三者均为三角锥形结构,正确;C项,CH中C的价层电子对数为3,为sp2杂化,微粒空间结构为平面三角形,正确;D项,CH3OH中不含离子键,正确。11.通常状况下,NCl3是一种油状液体,其分子空间结构与氨分子相似,下列对NCl3的有关叙述正确的是( )A.NCl3分子中N—Cl的键长比CCl4分子中C—Cl的键长长B.NCl3分子是非极性分子C.NCl3分子中的所有原子均达到8电子稳定结构D.NBr3比NCl3易挥发解析:C 因碳原子半径比氮原子半径大,故N—Cl的键长比C—Cl的键长短;NCl3分子空间结构类似NH3,故NCl3是极性分子;NBr3与NCl3结构相似,由于NBr3的相对分子质量较大,分子间作用力较大,所以NBr3的沸点比NCl3高,因此NBr3比NCl3难挥发。12.近年来,科学家合成了一系列具有独特化学性质的氢铝化合物(AlH3)n,常用作还原剂。已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150 ℃且熔融状态不导电,燃烧时放出大量的热量。Al2H6的球棍模型如图所示。下列说法不正确的是( )A.Al2H6中Al元素为+3价,H元素为-1价B.Al2H6中都是极性共价键C.Al2H6为离子化合物D.Al2H6在空气中完全燃烧,产物为氧化铝和水解析:C 在Al2H6中Al元素为+3价,H元素为-1价,A项正确;Al2H6中含有的化学键都是极性共价键,B项正确;Al2H6为共价化合物,C项错误;Al2H6在空气中完全燃烧,根据元素守恒可知燃烧产物为氧化铝和水,D项正确。二、非选择题:本题包括3个小题。13.芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。(1)天冬酰胺所含元素中,____________(填元素名称)元素基态原子核外未成对电子数最多。(2)天冬酰胺中碳原子的杂化轨道类型有________种。(3)H2S和H2Se的参数对比见下表。化学式键长/nm键角沸点/℃H2S1.3492.3°-60.75H2Se1.4791.0°-41.50 ①H2Se的晶体类型为________,含有的共价键类型为______________。②H2S的键角大于H2Se的原因可能为_______________________________________。解析:(3)①H2S和H2Se的沸点均较低,为分子晶体,不同种元素原子形成的为极性键。②S的电负性强于Se,形成的共用电子对斥力大,故H2S的键角大。答案:(1)氮 (2)2 (3)①分子晶体 极性键 ②S的电负性强于Se,形成的共用电子对斥力大,键角大14.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:(1)X、Y的元素符号依次为________、________。(2)XZ2与YZ2分子的空间结构分别是____________和____________,相同条件下两者在水中的溶解度较大的是________(填分子式),理由是________________________________。(3)Q的元素符号是________,它的基态原子的核外电子排布式为____________,在形成化合物时它的最高化合价为________价。(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键:___________________。解析:(1)X原子核外的M层中只有两对成对电子,则M层的轨道表示式为,故X为S元素,Y原子核外的L层电子数是K层的两倍,则Y原子的核外电子排布式为1s22s22p2,故Y为C元素。(2)Z是地壳内含量(质量分数)最高的元素,则Z为O元素,SO2、CO2的空间结构分别为V形、直线形。(3)Q的核电荷数为24,则Q为Cr元素,其核外电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,其价层电子排布式为3d54s1,则最高化合价为+6价。(4)元素周期表中F的电负性最强,HF溶液中,HF与HF、H2O与H2O、HF与H2O之间存在氢键。答案:(1)S C(2)V形 直线形 SO2 CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”的规律,SO2在H2O中的溶解度较大 (3)Cr 1s22s22p63s23p63d54s1(或[Ar]3d54s1) +6(4)F—H…F、F—H…O、O—H…F、O—H…O15.Ⅰ.(2021·山东高考·节选)非金属氟化物在生产、生活和科研中应用广泛。(1)OF2分子的空间构型为________;OF2的熔、沸点________(填“高于”或“低于”)Cl2O,原因是____________________________________________________________________________________________________________________________________。(2)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为________,下列对XeF2中心原子杂化方式推断合理的是________(填标号)。A.sp B.sp2C.sp3 D.sp3dⅡ.(2021·全国甲卷·节选)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。(3)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为________。SiCl4可发生水解反应,机理如下:含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为__________(填标号)。(4)CO2分子中存在________个σ键和________个π键。(5)甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是________________________________________。解析:(1)根据VSEPR模型知OF2的中心原子O的价层电子对数为2+=4,去掉2个孤电子对,知OF2分子的空间结构是角(V)形;OF2和Cl2O都是分子晶体,结构相似,Cl2O的相对分子质量大,Cl2O的熔、沸点高。(2)XeF2易升华,所以是分子晶体,其中心原子的价层电子对数为2+=5,其中心原子的杂化方式应为sp3d。(3)SiCl4中Si原子价层电子对数为4+=4,因此Si原子采取sp3杂化;由图可知,SiCl4(H2O)中Si原子的σ键数为5,说明Si原子的杂化轨道数为5,由此可知Si原子的杂化类型为sp3d。(4)CO2的结构式为O===C===O,1个双键中含有1个σ键和1个π键,因此1个CO2分子中含有2个σ键和2个π键。(5)甲醇分子之间和水分子之间都存在氢键,因此沸点高于不含分子间氢键的甲硫醇,甲醇分子之间氢键的总强度低于水分子之间氢键的总强度,因此甲醇的沸点介于水和甲硫醇之间。答案:(1)角(V)形 低于 OF2和Cl2O都是分子晶体,结构相似,Cl2O的相对分子质量大,Cl2O的熔、沸点高 (2)5 D (3)sp3 ② (4)2 2 (5)甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多
相关课件
这是一份2024届高中化学一轮复习课件:化学键 分子结构与性质,共3页。PPT课件主要包含了共价键,极性键,阳离子,非金属,不同种,饱和性,方向性,头碰头,肩并肩,不发生等内容,欢迎下载使用。
这是一份2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第3讲 化学键 分子结构与性质课件PPT,共60页。PPT课件主要包含了阳离子,共用电子对,离子键,共价键,答案A,答案B,答案C,答案D,饱和性,方向性等内容,欢迎下载使用。
这是一份2024版高考化学一轮复习专题基础练专题五物质结构与性质元素周期律考点15化学键分子结构与性质作业课件,共23页。PPT课件主要包含了经典3+2,创新1+1等内容,欢迎下载使用。









