



2022年中考化学复习铁的冶炼学案
展开
这是一份2022年中考化学复习铁的冶炼学案,文件包含初三化学复习铁的冶炼教师版docx、初三化学复习铁的冶炼学生版docx等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。
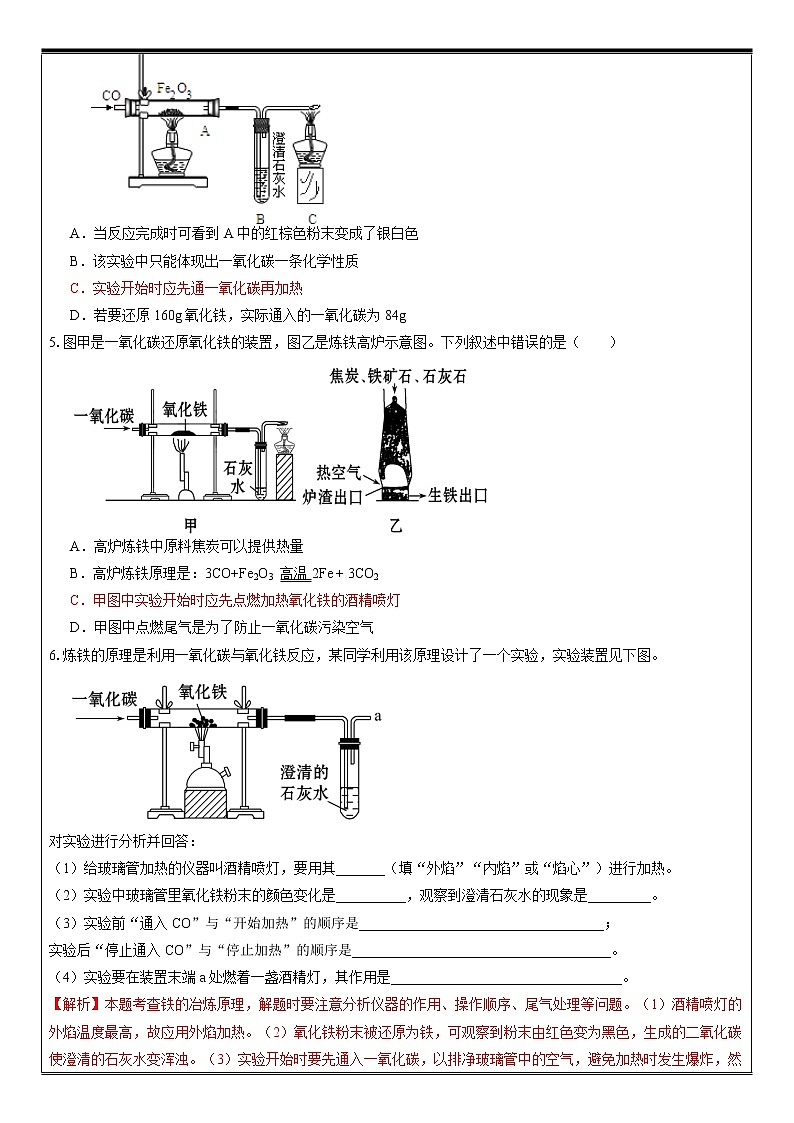
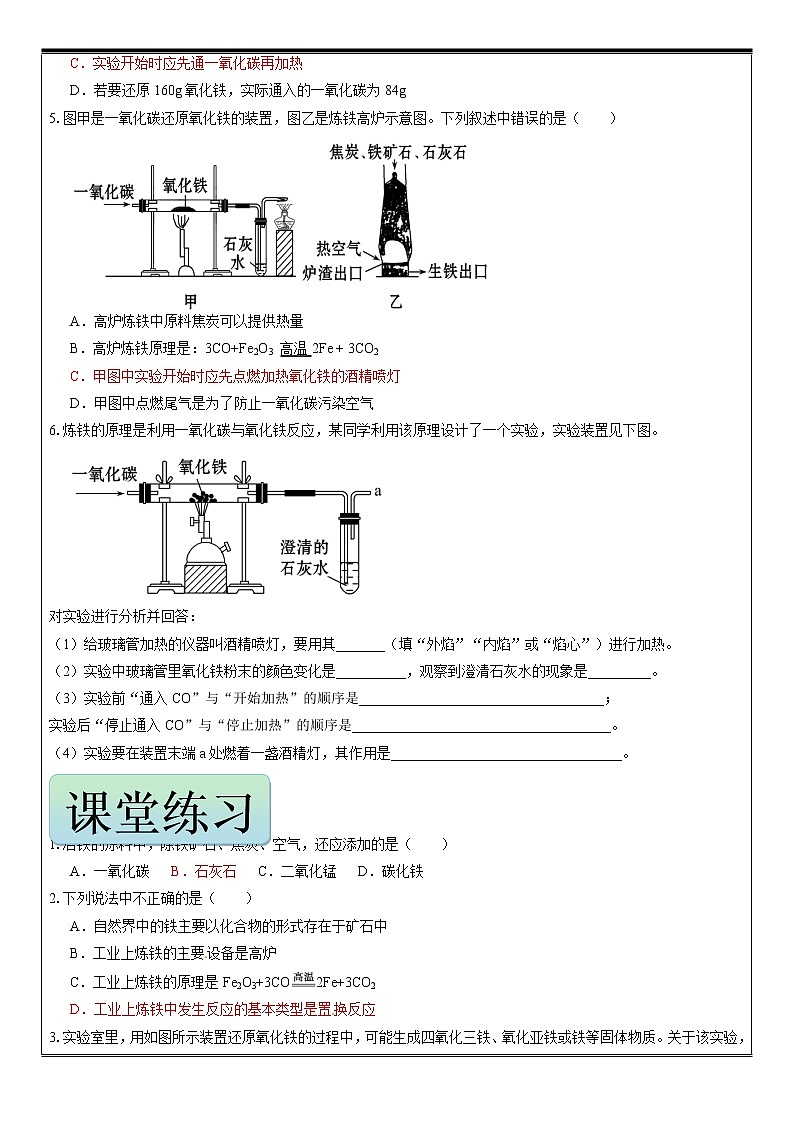
铁的冶炼 学员姓名: 年 级:初三 授课时数: 辅导科目:化学 学科教师:授课主题 铁的冶炼授课日期及时段 教 学 内 容 1.工业炼铁的主要原料中,正确的一组是( ) ①铁矿石 ②焦炭 ③一氧化碳 ④石灰石 ⑤空气 A.①②⑤ B.①②④⑤ C.①③④⑤ D.②③④2.炼铁高炉中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳反应;④焦炭充分燃烧。其中属于化合反应的是( ) A.①和④ B.②和③ C.③和④ D.只有④3.实验室里用如图所示装置还原氧化铁。关于该实验,下列说法错误的是( ) A.实验时,试管中澄清的石灰水变浑浊,证明该反应中有二氧化碳生成 B.实验开始时,点燃酒精灯给玻璃管加热的同时通入纯净的一氧化碳 C.为了减少空气污染,应增加尾气处理装置 D.实验中观察到玻璃管中红色固体变为黑色,并且澄清的石灰水变浑浊4.右图是一氧化碳还原氧化铁的实验装置图,下列有关该反应的说法正确的是( ) A.当反应完成时可看到A中的红棕色粉末变成了银白色 B.该实验中只能体现出一氧化碳一条化学性质 C.实验开始时应先通一氧化碳再加热 D.若要还原160g氧化铁,实际通入的一氧化碳为84g5.图甲是一氧化碳还原氧化铁的装置,图乙是炼铁高炉示意图。下列叙述中错误的是( ) A.高炉炼铁中原料焦炭可以提供热量 B.高炉炼铁原理是:3CO+Fe2O3 高温2Fe + 3CO2 C.甲图中实验开始时应先点燃加热氧化铁的酒精喷灯 D.甲图中点燃尾气是为了防止一氧化碳污染空气6.炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见下图。 对实验进行分析并回答:(1)给玻璃管加热的仪器叫酒精喷灯,要用其_______(填“外焰”“内焰”或“焰心”)进行加热。(2)实验中玻璃管里氧化铁粉末的颜色变化是__________,观察到澄清石灰水的现象是_________。(3)实验前“通入CO”与“开始加热”的顺序是___________________________________;实验后“停止通入CO”与“停止加热”的顺序是_____________________________________。(4)实验要在装置末端a处燃着一盏酒精灯,其作用是_________________________________。 5.书写下列化学方程式:1.冶铁的原料中,除铁矿石、焦炭、空气,还应添加的是( ) A.一氧化碳 B.石灰石 C.二氧化锰 D.碳化铁2.下列说法中不正确的是( ) A.自然界中的铁主要以化合物的形式存在于矿石中 B.工业上炼铁的主要设备是高炉 C.工业上炼铁的原理是Fe2O3+3CO2Fe+3CO2 D.工业上炼铁中发生反应的基本类型是置换反应3.实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质。关于该实验,下列说法错误的是( ) A.实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 B.实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 C.反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成 D.为了减少空气污染,应增加尾气处理装置4.早在春秋战国时期,我国就开始生产和使用铁器。工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置进行实验探究,请按要求填空: (1)写出CO还原Fe2O3的化学方程式 ;(2)实验中盛澄清石灰水的试管中可观察到的现象是 ;(3)右边导气管口放置点燃的酒精灯的目的是 ;(4)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是 。5.某地根据当地资源特点将石灰石开采、加工和高炉炼铁建在一起形成联产。 (1)炼铁的原料有铁矿石、焦炭、石灰石和空气。焦炭的主要作用有两点:其一是生成还原剂CO,其二是 。写出氧化铁在加热时被还原成铁的方程式 。(2)炼铁过程中,固体原料从炉顶往下加,而热空气却是从炉底通入。这样做的优点是 。高炉炼铁排放的废气中含有大量的高温一氧化碳,可作为能源用来煅烧石灰石。请写出煅烧石灰石的化学方程式: 。(3)此联产方式的主要优点是 (答出一点即可)(1)燃烧放热,维持炉温 Fe2O3 + 3CO 2Fe + 3CO2使反应物充分接触 CaCO3 CaO + CO2↑(3)降低成本(或变废为宝、减少环境污染、节约能源、合理利用资源等,其他合理答案均给分) 一、含杂质的反应物或生成物的有关计【例题】1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少? 某钢铁厂每天消耗4 000 t含Fe2O3 80%的赤铁矿石,该钢铁厂理论上可日产含Fe 98%的生铁质量是多少?(计算结果保留到0.1) 2.为了测定某赤铁矿石中氧化铁的质量分数,取矿石样品40 g,加入盐酸,恰好完全反应时,共用去盐酸219 g,过滤、洗涤、干燥后得滤渣8 g(矿石中的杂质既不溶于水也不与盐酸反应)。计算:(1)该赤铁矿石中氧化铁的质量分数。(2)现有这种赤铁矿石1 000 t,用一氧化碳完全还原,理论上可炼出含铁96%的生铁多少吨? 1.某赤铁矿样品中铁元素的质量分数为63%,则该矿石样品中主要成分的质量分数为( )A.95% B.85% C.90% D.80%2.某炼铁厂日产杂质5%的生铁3000t,试计算:(提示:O—16 Fe—56)(1)该3000t生铁中含纯铁多少吨?(2)该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?(计算结果保留整数) 3.化学兴趣小组的同学对某炼铁厂生产的生铁(杂质不与酸反应)进行组成分析。其实验数据如下表。实验步骤相关数据1.称取生铁样品放入烧杯中16g2.加入足量15%的盐酸200.0g3.称取反应后烧杯中物质总质量215.5g 根据表中数据,计算: (1)产生氢气的质量 (2)生铁样品中铁的质量 (3)生铁中铁的质量分数。 1.某校化学兴趣小组的同学,对一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1、K2是活塞)(浓硫酸具有吸水性;NaOH能与CO2反应生成纯碱):(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。①这是关于气体的实验,实验前必须对装置进行 ;②CO还原Fe2O3的化学方程式为 ;③在e处点燃气体的目的是 。(2)关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。①c瓶中应装 (填序号)。 A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸②该实验这样改进的主要优点是 。2.类比法是化学研究物质的重要方法之一.草酸的化学性质与碳酸相似.已知碳酸易分解,草酸在受热条件下也分解,仅生成三种氧化物.某校研究性学习小组对此展开探究: (1)小明首先根据草酸中含有 元素,可推测生成物中含有水.(2)小明对分解生成的其他产物进行猜测、验证:【假设一】生成物中有二氧化碳实验一:将生成的气体通入澄清的石灰水,实验现象是 ,小明据此判断生成物中含有二氧化碳。【假设二】生成物中有一氧化碳实验二:小明用如图装置进行实验,从而证明生成物中含有一氧化碳。请回答:A装置中红色固体粉末是 (填化学式),A装置中的实验现象是 。(3)讨论交流:小芳认为,小明的“实验二”不需要B装置也能够推断出生成物中含有一氧化碳,是否支持小芳的观点:______(填“支持”或“不支持”),请说出你的理由 。小芳认为,从环保的角度看,“实验二”装置有一个缺陷,请你指出该缺陷 ,处理的方法是 。 1.化学兴趣小组的同学设计了用一氧化碳气体还原氧化铁的实验装置,如下图所示。请回答下列问题:(1)为了避免玻璃管a在加热时可能发生爆炸,加热前应____________________________。(2)a管中Fe2O3发生反应的化学方程式为:________________________。(3)B装置除了吸收CO2气体外,还_____________________________________________。写出B装置中NaOH发生反应的化学方程式:________________________。(4)若a管中氧化铁全部还原成铁,冷却后称量铁的质量比反应前氧化铁的质量减少了2.4 g,则加入a管中的氧化铁的质量是______g。 1.含氧化铁80%的赤铁矿,铁元素的质量分数是( ) A.63% B.56% C.70% D.80%2.实验室里用如图所示装置还原氧化铁,关于该实验下列说法错误的是( ) A.玻璃管中发生的反应属于置换反应 B.该实验说明了一氧化碳既可以燃烧又有还原性 C.实验观察到的现象为红棕色固体变黑,澄清石灰水变浑浊 D.实验时,先通入纯净的一氧化碳,再点燃酒精喷灯给玻璃管加热3.如图装置是做CO与Fe2O3反应的实验的部分装置.下列有关说法错误的是( ) A.实验开始要先通入CO(至空气排完),再加热药品 B.实验产生的尾气少,可以直接排放到空气中 C.实验中红棕色固体逐渐变黑,石灰水慢慢变浑 D.实验结束先熄灭酒精灯,并继续通入CO(至玻璃管冷却) 4.铁在地壳中含量居所有金属元素的第 位,由于铁的化学性质 ,所以铁在地壳中以 形式 存在。常见的含铁的矿物有:磁铁矿(主要成分为 )、赤铁矿:(主要成分为 )。工业炼铁时, 把 、 、 一起加入高炉,利用焦炭与氧气反应生成的 把铁从 里还原出来。5.钢铁是使用最多的金属材料。(1)生铁和钢都是铁合金,其中含碳量较高的是______。(2)人们常用“铜墙铁壁”来形容物体的坚固,但铁在一定条件下也能发生各种反应,如铁丝可在氧气中燃烧,反应的化学方程式是:____________________________________。(3)将m g氧化铜加入稀硫酸中完全溶解后,再加入铁粉充分反应,过滤,得到滤渣A和滤液B。再将滤渣A加入足量稀硫酸中,有气泡冒出,充分反应后,剩余固体物质的质量为12.8 g。①滤渣的成分是________,滤液B的成分是________________。②原氧化铜的质量m=________g。
相关学案
这是一份人教版九年级下册课题 3 金属资源的利用和保护第1课时学案,共6页。学案主要包含了常见的金属矿石,铁的冶炼,有关含杂质化学反应的计算等内容,欢迎下载使用。
这是一份考点30生铁的冶炼(解析版)-2022年化学中考一轮过关讲练(人教版)学案,共11页。学案主要包含了单选题等内容,欢迎下载使用。
这是一份2020-2021学年课题 3 金属资源的利用和保护优质学案,文件包含第1课时铁的冶炼学案含答案docx、第1课时铁的冶炼学案学生用docx等2份学案配套教学资源,其中学案共7页, 欢迎下载使用。









