

所属成套资源:2021年上海市各区高考二模化学试卷-精校版(含答案)
2021年上海市闵行区高考二模化学试卷(含答案)
展开
这是一份2021年上海市闵行区高考二模化学试卷(含答案),共8页。试卷主要包含了选择题,综合题等内容,欢迎下载使用。
上海市闵行区2020-2021学年第二学期高三二模化学试卷相对原子质量: H-1 C-12 N-14 O-16 S-32 Fe-56 一、选择题(本题共40分,每小题2分,每题只有一个正确选项)1.不能用来作为新冠病毒的消毒剂是 A.84消毒液 B.漂粉精 C.75%酒精 D.明矾2.第75号元素铼是广泛用于航空发动机涡轮叶片的稀土元素。从信息中不能获取的是 A.质量数 B.周期表中位置 C.质子数 D.核外电子排布3.因被氧化而使溴水褪色的是 A.苯 B.二氧化硫 C.乙烯 D.氢氧化钠溶液4.铝锂合金是应用于航空航天领域的新型材料,下列性质与其应用无关的是 A.导电性好 B.密度小 C.硬度大 D.熔点比铝低5.有关氮肥的说法正确的是 A.氮肥都含铵根离子 B.NH4NO3是复合氮肥 C.自然固氮可产生尿素 D.自然界氮循环能产生铵盐6.关于丙烯的描述正确的是 A.电子式为: B.最多有7个原子共面 C.与1,3-丁二烯是同系物 D.不能发生取代反应7.常温下三氧化硫以液态(SO3)3聚合存在,气化时以SO3存在。已知SO3分子结构是平面三角型。有关说法正确的是 A.由液态变气态是物理变化 B.SO3属于弱电解质 C.SO3含有极性键 D.SO3是极性分子8.在硫酸铜晶体(CuSO4·nH2O)结晶水含量测定的操作中,导致n值偏小的是 A.坩埚未干燥 B.在空气中冷却 C.加热过程中晶体爆溅 D.加热时间过长部分变黑9.下列实验中,所加固体可以完全溶解的是 A.常温下小块铝片投入足量浓硫酸中 B.少量碘片投入足量溴化钠中 C.小块硫磺投入足量二硫化碳中 D.小块铜片投入热乙醇溶液中10.能用键能解释,且结论正确的是 A.熔点:金刚石>晶体硅 B.分子稳定性:H2O>HF C.溶解度:SO2>CO2 D.状态:常温时Cl2是气态11.某溶液可能含有等物质的量的Ba2+、Na+、NH4+、H+、Cl-、I-、SO32-、SO42-中的几种,向该溶液中滴加少量新制氯水,所得溶液为无色。判断不正确的是A.肯定不含NH4+ B.肯定不含H+ C.肯定含有SO32- D.肯定不含Cl-12.有X、Y、Z三种元素,它们的原子序数都小于20,对应离子X+、Y2-、Z-具有相同的电子层结构。有关描述中正确的是 A.原子序数:Z>X>Y B.还原性:Z->Y2- C.Z元素最高价为+7 D.X与Y可形成X2Y2化合物13.在给定条件下,下列物质间转化能实现的是 A. B.C.D.14.港珠澳大桥桥体的钢构件采用了多种防腐方法。有关其分析正确的是A.越靠近海底的钢构件,腐蚀越严重 B.钢构件上镶嵌铝块,属牺牲阳极阴极保护法 C.钢构件若腐蚀,正极反应式为:Fe-2e→Fe2+ D.钢构件表面喷涂环氧树脂涂层,防止形成电解池15.I2(s)+H2(g)2HI(g)能量变化如图所示,有关叙述错误的是A.正反应为吸热反应B.该反应的反应热为E2-E1C.加入催化剂,E1、E2都不变D.若I2为气态,则该反应热大于E2-E116.盆栽鲜花施用S-诱抗素剂(结构如图)以保持鲜花盛开。说法正确的是A.分子式为C14H16O4B.分子中的羟基能被催化氧化 C.能跟溴水发生1,4-加成反应D.1mol该物质与足量钠反应产生0.5 mol 氢气
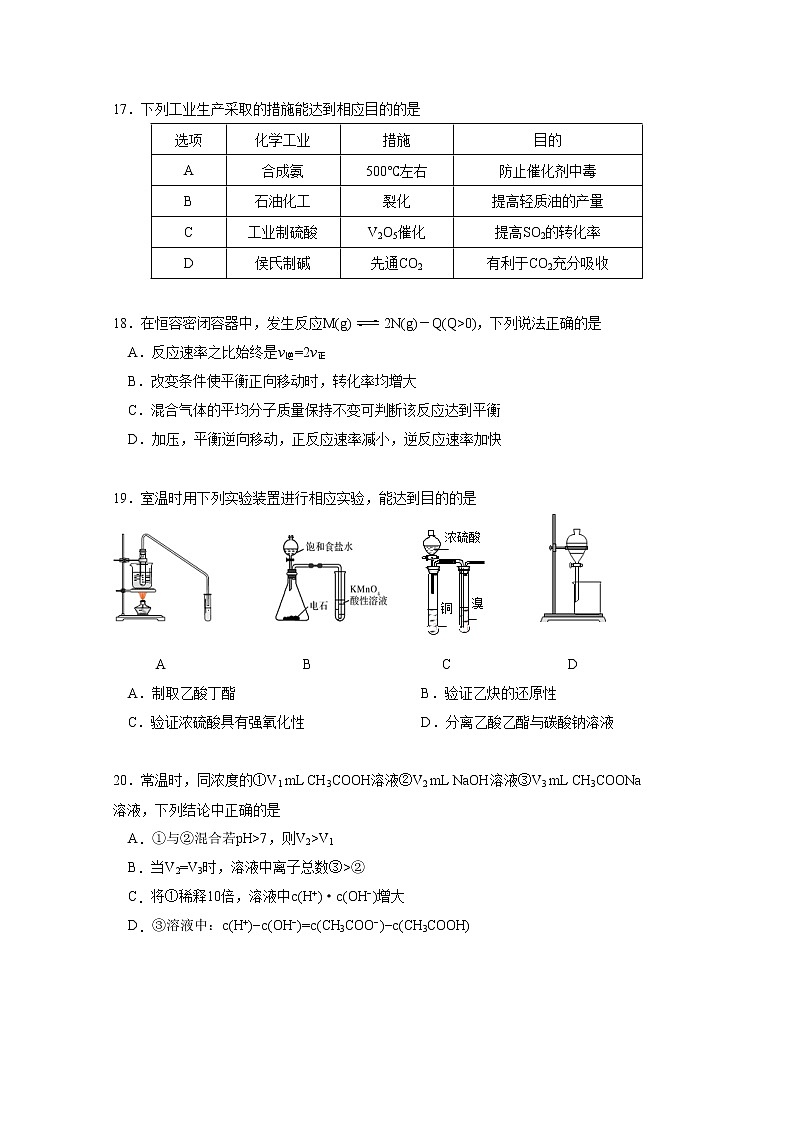
17.下列工业生产采取的措施能达到相应目的的是选项化学工业措施目的A合成氨500℃左右防止催化剂中毒B石油化工裂化提高轻质油的产量C工业制硫酸V2O5催化提高SO2的转化率D侯氏制碱先通CO2有利于CO2充分吸收 18.在恒容密闭容器中,发生反应M(g)2N(g)-Q(Q>0),下列说法正确的是 A.反应速率之比始终是v逆=2v正 B.改变条件使平衡正向移动时,转化率均增大 C.混合气体的平均分子质量保持不变可判断该反应达到平衡 D.加压,平衡逆向移动,正反应速率减小,逆反应速率加快 19.室温时用下列实验装置进行相应实验,能达到目的的是 A B C D A.制取乙酸丁酯 B.验证乙炔的还原性 C.验证浓硫酸具有强氧化性 D.分离乙酸乙酯与碳酸钠溶液 20.常温时,同浓度的①V1 mL CH3COOH溶液②V2 mL NaOH溶液③V3 mL CH3COONa溶液,下列结论中正确的是 A.①与②混合若pH>7,则V2>V1 B.当V2=V3时,溶液中离子总数③>② C.将①稀释10倍,溶液中c(H+)·c(OH−)增大 D.③溶液中:c(H+)−c(OH−)=c(CH3COO−)−c(CH3COOH)
二、综合题(共 60 分)(一)(本题共15分)NaNO2是一种白色易溶于水的固体,俗称工业盐,在漂白、电镀等方面应用广泛。完成下列填空:21.钠元素核外有_________种能量不同的电子;氮元素原子最外层电子的轨道排布式为_________________________________。22.NaNO2晶体类型是____________________;组成NaNO2的三种元素,其对应的简单离子半径由小到大的顺序为_______________________________。 工业上可用NaNO2从含I-的卤水中提取单质碘。流程如下:23.酸性条件下,含I-的卤水发生如下反应。补充完整方程式并配平。 _____ NO2-+_____ I-+_____ __________ → _____ NO↑+_____ I2+_____ __________ 当有0.75mol I-参与反应时,在标准状况下产生气体的体积是____________L。24.上述反应为什么不选用常见的氧化剂氯气,而选择价格并不便宜的NaNO2,可能原因是__________________________________________________________________________。从第②步反应后的溶液中提纯I2涉及到的方法可以是__________(选填编号)。a. 萃取 b. 升华 c. 纸层析 d. 过滤25.在富集碘元素过程中,还使用了NaHSO3溶液。该物质既能水解又能电离,设计实验验证其水解程度和电离程度的相对大小_____________________________________________________________________________________________________________________________。
(二)(本题共15分)尿素和氨气对于提高农作物产量和品质有重要作用。合成尿素的反应为:2NH3(g)+ CO2(g)CO(NH2)2(s)+H2O(l)完成下列填空:26.该反应的化学平衡常数表达式为_________________________。27.在恒定温度下,将NH3和CO2按物质的量之比2:1充入固定体积为10 L的密闭容器,经20 min达到平衡,此时固体质量增加120 g。用CO2表示20min内的化学反应速率为__________。 28.合成尿素时不同温度下相同时间内CO2转化率变化曲线如图。该反应正方向为________________反应(选填“吸热”或“放热”)。a、b、c三点对应温度下的平衡常数大小关系如何:___________________________(用Ka、Kb、Kc表示),理由为_____________________________________________________。 在某温度时,将1.0 mol・L-1氨水滴入10 mL 1.0mol・L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示: 29.a、b、c、d对应的溶液中水的电离程度由大到小的顺序是_______________________________。 30.氨水体积滴至__________时(填“V1”或“V2”),氨水与盐酸恰好完全反应,简述判断依据:____________________________________________________________________________________________;此时溶液中离子浓度由大到小的是___________________________________。
(三)(本题共15分)物质G是升高白细胞的常见药物,合成G的路线如下: 已知:完成下列填空:31.①的反应条件是_________________;②的反应方程式____________________________________________________________。32.试剂X的结构简式为__________________________;④的反应类型是_______________。33.⑤的反应试剂是_____________;步骤④、⑤不能颠倒的原因是__________________________________________________________________________________________________。34.C有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式。①只有两种不同官能团 ②有3种不同化学环境的氢原子 _______________________ 35.设计以为原料合成的路线(无机试剂任选)。
(四)(本题共15分)莫尔盐[(NH4)2Fe(SO4)2・6H2O,392g/mol]是一种重要的还原剂,可通过以下流程制取:Fe2(SO4)3溶液FeSO4溶液 (NH4)2Fe(SO4)2溶液莫尔盐已知:硫酸铵、水合硫酸亚铁、硫酸亚铁铵在水中的溶解度温度溶解度物质 g/100g水10℃20℃30℃40℃(NH4)2SO473.075.478.081.0FeSO4·7H2O40.048.060.0073.3(NH4)2SO4FeSO4·6H2O18.121.224.527.9完成下列填空:36.配制Fe2(SO4)3溶液需加入少量稀硫酸,目的是___________________________________。37.(NH4)2SO4溶液和FeSO4溶液混合会生成(NH4)2Fe(SO4)2的原因是_______________________________________________________________________________。38.隔绝空气下莫尔盐受强热分解会产生多种气体。利用如下装置验证气体中存在H2O、SO2和SO3。验证气体的装置次序为_________________;c装置中足量盐酸的作用是________________________________________________________________________________。a b c d测定莫尔盐样品的纯度:称取莫尔盐样品20.000 g,用蒸馏水配成250 mL溶液,取25.00 mL溶液加入稀硫酸,用0.1000 mol•L-1的KMnO4溶液滴定三次,达到滴定终点时平均消耗10.00 mL KMnO4溶液。39.蒸馏水要预先加热煮沸的原因是______________________________________________;配成250mL溶液的定量仪器为________________________。40.若滴定前不用标准液润洗滴定管,将会导致最终结果________________(选填“偏大”、“偏小”或“不变”);已知滴定反应中n(Fe2+):n(MnO4-)为5:1,该样品的纯度为_________________。2021闵行二模参考答案一、选择题(本题共40分,每小题2分,每题只有一个正确选项)题号12345678910答案DABADBCBCA题号11121314151617181920答案ADABCCBCDB 二、综合题(共60分)(一)(本题共15分)21.(2分) 4 22.(3分)离子(1分) r(Na+)<r(O2-)<r(N3-)(2分)23.(4分)2I-+2NO2-+4H+→I2+2NO+2H2O(2分) 16.8(2分)24.(4分)氯气氧化性太强,还能继续氧化I2(2分) ab(2分)25.(2分)常温下测NaHSO3稀溶液的pH,若pH大于7,则其水解程度大于电离程度,若pH小于7,其水解程度小于电离程度。(合理即可) (二)(本题共15分)26.(1分)27.(2分)0.01mol/(L·min)28.(5分) 放(1分) Ka>Kb>Kc(2分) 该反应正方向放热,升高温度平衡向逆反应方向移动,平衡常数不断减小。(2分)29.(2分)b>c>d>a30.(5分)V1(1分)氨水和盐酸反应为放热反应,由图可知当氨水体积滴到V1时溶液的温度最高,则此刻氨水和盐酸恰好完全反应生成氯化铵。(2分)c(Cl-)>c(NH4+)>c(H+)>c(OH-)(2分) (三)(本题共15分)31.(4分)NaOH溶液(1分) 加热(1分) (2分)32.(3分)(2分) 消去(1分)33.(3分)新制Cu(OH)2悬浊液(1分) 防止-OH消去时发生副反应(2分)34.(2分) CH2=CHCOOH(合理给分)35. (四)(本题共 15 分)36.(1分)防止Fe3+水解37.(2分)硫酸亚铁铵在水中溶解度小于硫酸亚铁和硫酸铵38.(4分) bcad (2分) 吸收氨气并将溶液酸化,排除SO2的干扰(2分)39.(4分)除去氧气防止 Fe2+被氧化(2分) 250 mL容量瓶(2分)40.(4 分)偏大(2分) 98%(2分)
相关试卷
这是一份2022年上海市闵行区高考化学二模试卷,共34页。试卷主要包含了选择题,综合题等内容,欢迎下载使用。
这是一份2023年上海市闵行区高考二模化学答案,共2页。试卷主要包含了选择题,综合题等内容,欢迎下载使用。
这是一份2023年上海市闵行区高三上学期高考一模化学试卷含答案,共7页。








