





科粤版九年级下册7.3 溶液浓稀的表示教学演示ppt课件
展开
这是一份科粤版九年级下册7.3 溶液浓稀的表示教学演示ppt课件,共25页。PPT课件主要包含了让你的记忆重现,浓溶液与稀溶液,·哪种溶液浓,溶质的质量分数,计算公式,476%,M质M液―M剂,我来计算,走进生活等内容,欢迎下载使用。
教学目标:1.掌握溶液浓稀的一种定量表示方式—溶质的质量分数。2.能进行关于溶质质量分数的简单计算。3.理解溶解度与溶质质量分数的区别与联系。教学重点:溶质质量分数的概念及计算教学难点:溶解度与溶质质量分数的区别与联系。
你知道溶液由哪几部分组成的吗?它们之间的质量有什么关系?
溶质 溶剂
溶液质量 = 溶质质量 + 溶剂质量溶质质量 =溶液质量 ―溶剂质量溶剂质量=溶液质量 ―溶质质量
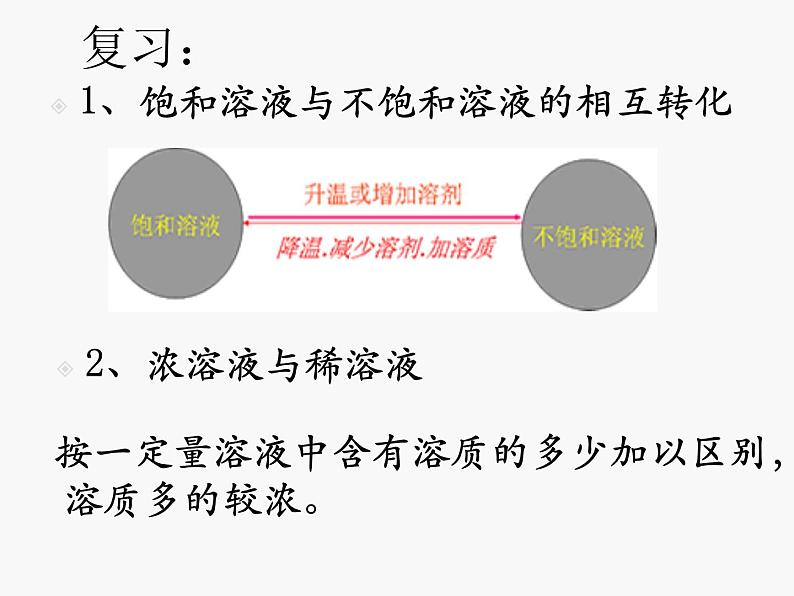
1、饱和溶液与不饱和溶液的相互转化
按一定量溶液中含有溶质的多少加以区别,溶质多的较浓。
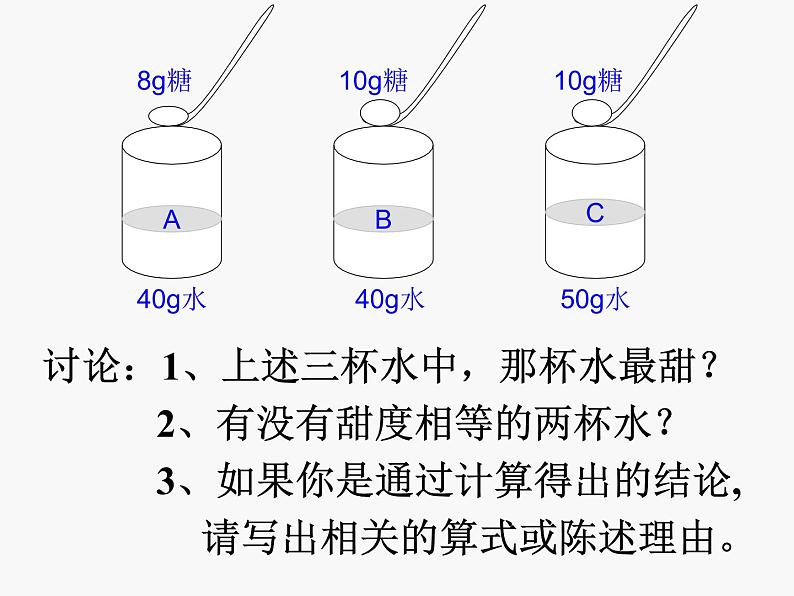
【实验7-8】哪个溶液浓 1.
讨论:1、上述三杯水中,那杯水最甜? 2、有没有甜度相等的两杯水? 3、如果你是通过计算得出的结论, 请写出相关的算式或陈述理由。
溶液中溶质的质量分数是溶质质量与溶液质量之比
1. 现有一瓶氯化钠溶液它的质量分数为5%,则5%的含义是什么?
溶质是( )份 溶剂是( )份溶液是( )份
例题1:把5克食盐溶解在100克水中,所得溶液中溶质的质量分数为多少?
练习1: 从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克氯化钾固体。试确定这瓶溶液中溶质的质量分数。
答:这瓶溶液中氯化钾的质量分数为14%。
解:溶质氯化钾的质量分数=
溶质质量分数公式变形计算
M液=M质+M剂
(1)M质=M液×w%
例2:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解: M质=M液×w% =150kg×16% =24kg M剂=M液-M质 =150kg-24kg =126kg答:配制150kg这种溶液,需要24kg氯化钠和126kg水。
配制200g溶质的质量分数为5%的硫酸铜溶液,需要硫酸铜和水的质量各是多少?
解: M质=M液×w%
=200g ×5%
M剂=M液-M质 =200g-10g =190g
答:需要硫酸铜的质量为10g,水的质量190g。
现有一瓶100g10%的NaOH溶液:(1)若向其中加入100克水,它的质量分数变为多少?(2)若向其中加入10克的氢氧化钠固体,其质量分数又变为多少?
[讨论与交流] P196
溶解度与溶质质量分数的区别与联系
物质溶解性的量度,受温度影响
表示溶液中溶质质量的多少,不受外界条件影响
在餐桌上,当我们发现某种汤太咸时,通常做法是向汤中加 。在这个过程中一定改变的是( )一定不变的是( )(1)水的质量 (2)汤的质量 (3)盐的质量 (4)盐的质量分数
2、有关溶液稀释的计算
无论是加水稀释浓溶液,还是用稀溶液稀释浓溶液,稀释前后溶质的总质量是相等的。
稀释前溶液的质量×稀释前溶液溶质的质量分数
练习1:将80克50%的硫酸稀释成20%的硫酸溶液,所得溶液的质量是多 少?要水多少克
练习2:把100毫升98%的浓硫酸(密度为1.84克/毫升)稀释成10%的稀硫酸(密度为1.07克/毫升),需要加水多少毫升?
例:在抗击“非典型性肺炎”的战斗中,人们广泛使用过氧乙酸消毒液,在室内外进行消毒。现要配制10Kg 0.4%的过氧乙酸消毒液,请计算需用含过氧乙酸40%的市售原液的质量是多少?所需稀释用水的质量为多少?
解:设所需要40%的市售原液的质量为x,则根据稀释前后溶质质量不变的原则列得
10Kg × 0.4% = х× 40%
х = 0.1Kg 稀释用水的质量 = 10Kg - 0.1Kg = 9.9Kg
答:需用含过氧乙酸40%的市售原液的质量是0.1Kg,所需稀释用水的质量为9.9Kg。
·配制一定溶质质量分数的溶液
例:如何配制50g质量分数为8%的氯化钠溶液?
方法与步骤:1.计算:配制50g质量分数为8%的氯化钠溶液所需氯化钠和水的质量;2.称取(量取):用托盘天平称量所需的氯化钠质量,倒入烧杯中;用量筒量取所需水的体积(把水的密度近似看做1g/cm);3.溶解:将量筒里的水注入盛有氯化钠的烧杯里,用玻璃棒搅拌,使氯化钠溶解;4.装入试剂瓶:把上述氯化钠溶液装入贴有试剂名称和溶质质量分数标签的试剂瓶中,盖好瓶塞,放到指定的柜中。
例:. 配制 100克 15% 的氯化钠溶液 (1) 计算:需氯化钠 ________ 克,水 ________ 克。 (2) 称量:用 ________ 称量出所需要的一定量的氯化钠,倒入 ________ 里。 (3) 溶解:用 ____ 毫升的量筒 (10 毫升,100 毫升中选择 ) 量取 ____ 毫升的水,倒入盛有氯化钠的 ________ 里,并用 ________ 搅拌,使氯化钠完全溶解,便得到 100克 15% 的氯化钠溶液。(4)装入试剂瓶:贴好标签(试剂名称和质量分数)
配制溶液质量分数偏大偏小的原因:
1、用量筒量取溶剂时,仰视读数
2、若溶质是固体,用天平左盘放砝码,右盘放溶质
3、在烧杯内溶解固体溶质搅拌时有少量溅出
4、溶解时烧杯内有水珠,不干燥
5、样品有杂质
1、使用量筒量溶剂时,俯视读数2、在用量筒倾倒完液体后,仍有少部分溶剂粘附在量筒壁上
3、溶质加入过多(比如天平使用错误)
三、有关化学方程式的溶液计算
在有溶液中反应时根据的化学方程式的计算,要从以下两个方面考虑:(1)在化学方程式中的有关反应物、生成物的质量,是指溶质的质量,而不是溶液的质量或体积。(2)对于反应后所得溶液的质量的求法:溶液质量 = 反应物质量总和―生成气体质量―生成沉淀质量
解:设生成的氢气质量为ⅹ,所用硫酸的质量为У, 生成的硫酸锌的质量为Ζ
相关课件
这是一份2021学年7.3 溶液浓稀的表示教课课件ppt,共15页。PPT课件主要包含了学习目标,蒸发溶剂,加溶剂,X1314g,714cm3等内容,欢迎下载使用。
这是一份初中科粤版7.3 溶液浓稀的表示课前预习ppt课件,共19页。PPT课件主要包含了溶液的浓度,经典例题,知能训练等内容,欢迎下载使用。
这是一份科粤版九年级下册7.3 溶液浓稀的表示示范课ppt课件,共20页。PPT课件主要包含了学习目标,溶液的浓度,配制过程,End,Thankyou等内容,欢迎下载使用。










