
- 知识清单 第三单元 物质构成的奥秘 其他 39 次下载
- 知识清单 第四单元 自然界的水 其他 39 次下载
- 知识清单 第六单元 碳和碳的氧化物 其他 37 次下载
- 知识清单 第七单元 燃料及其利用 其他 35 次下载
- 知识清单 第八单元 金属和金属材料 其他 37 次下载
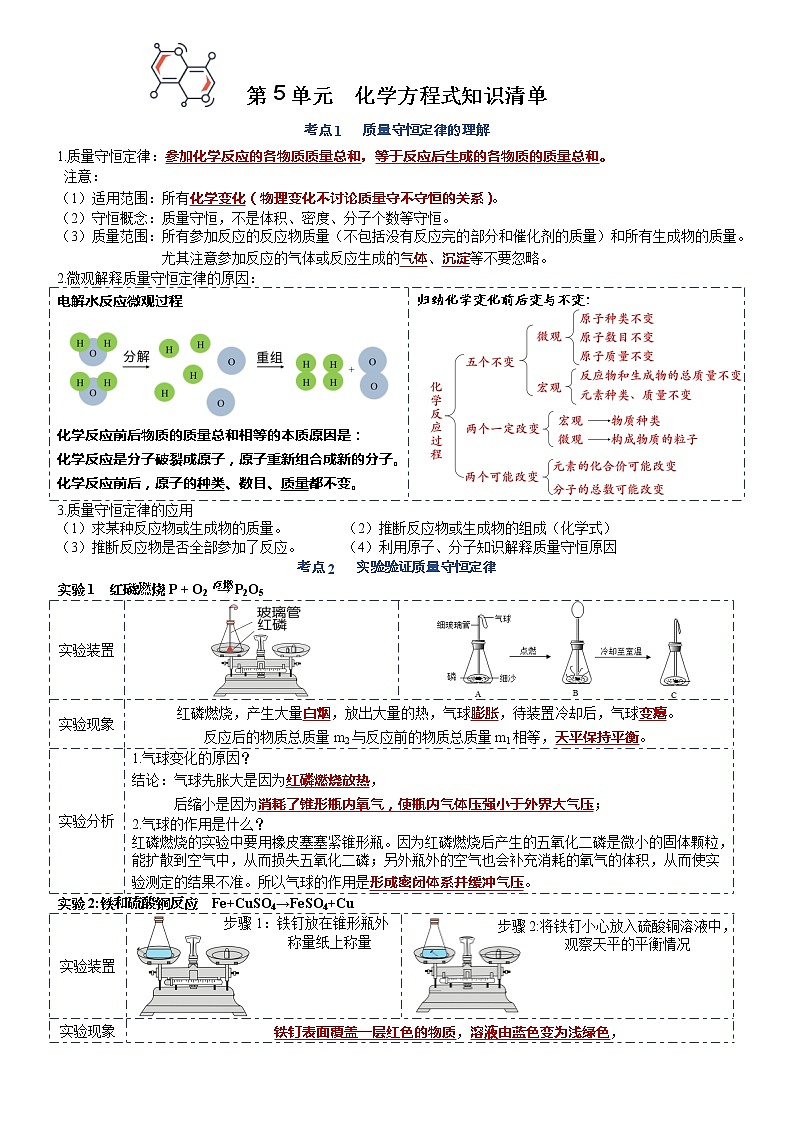
知识清单 第五单元 质量守恒定律
展开第5单元 化学方程式知识清单
考点1 质量守恒定律的理解
1.质量守恒定律:参加化学反应的各物质质量总和,等于反应后生成的各物质的质量总和。
注意:
(1)适用范围:所有化学变化(物理变化不讨论质量守不守恒的关系)。
(2)守恒概念:质量守恒,不是体积、密度、分子个数等守恒。
(3)质量范围:所有参加反应的反应物质量(不包括没有反应完的部分和催化剂的质量)和所有生成物的质量。尤其注意参加反应的气体或反应生成的气体、沉淀等不要忽略。
2.微观解释质量守恒定律的原因:
电解水反应微观过程
化学反应前后物质的质量总和相等的本质原因是: 化学反应是分子破裂成原子,原子重新组合成新的分子。 化学反应前后,原子的种类、数目、质量都不变。 | 归纳化学变化前后变与不变: |
3.质量守恒定律的应用
(1)求某种反应物或生成物的质量。 (2)推断反应物或生成物的组成(化学式)
(3)推断反应物是否全部参加了反应。 (4)利用原子、分子知识解释质量守恒原因
考点2 实验验证质量守恒定律
实验1 红磷燃烧P + O2 → P2O5
实验装置 | ||
实验现象 | 红磷燃烧,产生大量白烟,放出大量的热,气球膨胀,待装置冷却后,气球变瘪。 反应后的物质总质量m2与反应前的物质总质量m1相等,天平保持平衡。 | |
实验分析 |
结论:气球先胀大是因为红磷燃烧放热, 后缩小是因为消耗了锥形瓶内氧气,使瓶内气体压强小于外界大气压;
红磷燃烧的实验中要用橡皮塞塞紧锥形瓶。因为红磷燃烧后产生的五氧化二磷是微小的固体颗粒,能扩散到空气中,从而损失五氧化二磷;另外瓶外的空气也会补充消耗的氧气的体积,从而使实验测定的结果不准。所以气球的作用是形成密闭体系并缓冲气压。 | |
实验2:铁和硫酸铜反应 Fe+CuSO4→FeSO4+Cu
实验装置 | 步骤1:铁钉放在锥形瓶外 称量纸上称量 | 步骤2:将铁钉小心放入硫酸铜溶液中,观察天平的平衡情况 |
实验现象 | 铁钉表面覆盖一层红色的物质,溶液由蓝色变为浅绿色, 反应前后,物质的总质量不变,天平保持平衡。 | |
实验3:化学实验验证质量守恒定律的注意事项
实验方案 | 实验步骤: 1.小烧杯放碳酸钠粉末,小试管盛稀盐酸放入烧杯称量总质量m1。 2.倾斜试管,倒入稀盐酸,发生反应。 3.实验完成,称量m2。 | 实验步骤: 1.称量砂纸打磨镁条和石棉网质量m1。 2.在石棉网上方点燃镁条。 3.实验完成,称量m2。 |
实验现象 | 白色粉末溶解,有大量气泡迅速产生。 天平向右偏转。 | 产生白色固体(还有少量白烟产生), 天平不平衡,发出耀眼的白光,放出热量。 |
反应原理 | Na2CO3+HCl→ NaCl+H2O+CO2 | Mg + O2 → MgO |
实验分析 | 由于镁条燃烧,消耗了空气中的氧气,生成氧化镁,根据质量守恒定律,应该是生成物氧化镁的质量等于反应的镁条和参加反应的氧气质量总和,所以实验理论结果应该是m2﹥m1。但是在实际反应时,镁条不仅和空气中的氧气反应,还和空气中的氮气发生反应生成氮化镁(Mg3N2),和二氧化碳反应生成氧化镁和碳,所以反应后固体的质量可能增大。但伴随着白烟现象,如果逸散的白烟质量小于增加的气体质量,m1<m2,若相等,m1=m2,若逸散质量大于增加的气体质量,m1>m2。 | |
实验结论 | 所有的化学反应均遵守质量守恒定律。 有气体参加或气体生成(或者有烟、雾状物质生成的反应),要验证质量守恒定律, 必须在密闭容器里进行。 | |
考点3 化学方程的意义
考点4 化学方程的书写
- 书写步骤
写——左写反应物,右写生成物,中间连短线;
配——配平;使反应前后各原子总数相等;
等——短线改等号;
注——在等号的上方或下方注明反应条件(点燃、加热“△”、高温、通电、催化剂等);
标——标出生成物中气体与沉淀(气体符号“↑”:反应物无气体,生成物中有气体,在气体的化学式右边标)
反应物和生成物中都有气体,气体生成物就不需注“↑”号;沉淀符号“↓”:溶液中反应如果生成物是固体,在固体生成物的化学式右边标,如果反应物和生成物中都有固体,固体生成物也不需注“↓”号)
查——检查化学式是否写错、是否配平、条件和生成物状态是否标注准确。
考点5 化学方程的配平方法
1.最小公倍数法
步骤:(1)找出两边各出现一次的元素,选择同种原子的个数最多的原子 ,求最小公倍数 ,得分子个数
(2)使该原子数目在反应前后都为所求出的最小公倍数;(3)一般先从氧原子入手,再配平其他原子。
例1: KClO3——KCl+ O2 例2: Al + Fe3 O4—— Fe + Al2O3
2.观察法
步骤:(1)从化学式较复杂的一种生成物(反应物)推求有关反应物(生成物)化学式的化学计量数和这一生成物的化学计量数;(2)根据求得的化学式的化学计量数,再找出其它化学式的相应计量数,这样即可配平。
例1: Fe2O3+ CO——Fe + CO2 例2: H2 O + Fe —— Fe3 O4+ H2
3.奇数配偶法
这种方法适用于化学方程式两边某一元素多次出现,并且两边的该元素原子总数有一奇一偶。
步骤:(1)找出在化学反应中出现次数最多的元素;(2)从原子数为单数的元素入手(一般为氧元素),即乘2;(3)由已推求出的化学计量数决定其它化学式的化学计量数。
例1: C2 H2 +O2 ——CO2 +H2 O 例2: FeS2+ O2 ——Fe2O3 + SO2
4.分数配平法
此方法能配平有单质参加反应或有单质生成的化学反应。
步骤:(1)先配平化合物中各元素的原子;(2)用分数配平单质元素的原子;(3)去分母,使配平后的化学计量数为整数。
例1: C2H2 + O2—— CO2+ H2O
5.定一法
找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数。若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法。
例1: CH3OH+O2——H2O+CO2 例2: C2H5OH+O2——H2O+CO2
一般来说,观察和配平的顺序为:有氢看氢,无氢看氧,原子团优先配平,单质最后配平.
考点6 根据化学方程计算
1.计算依据:利用化学方程式能反映物质间的质量比,且质量比呈正比例关系。
2.计算步骤:①设未知数;②根据题意写出方程式;③根据化学方程式找出已知量与未知量的质量比;
④列出比例式,并求出未知数;⑤答
注意:①由于方程式只能反映物质间的质量比,因此代入方程式中的各个量必须是质量。
②由于方程式中各物质是纯净物,因此代入方程式中的量必须是纯净物的质量。
③单位必须统一。
3.计算中常用的关系式:
(1)m= ρv
(2)单位换算:1L=1000mL,1mL=1cm3
(3)物质的纯度=纯物质的质量/不纯物质的质量×100%
变形:纯物质的质量=不纯物质的质量×物质的纯度 不纯物质的质量=纯物质的质量÷物质的纯度
(4)物质的纯度(纯物质的质量分数)=1-杂质的质量分数








