






















所属成套资源:中考化学总复习成套专题教学PPT课件(安徽专用)
中考化学总复习06第六部分热点题型PPT课件(安徽专用)
展开
这是一份中考化学总复习06第六部分热点题型PPT课件(安徽专用),文件包含18专题十八实验探究题ppt、17专题十七工艺流程题ppt、19专题十九化学计算题ppt、16专题十六与日常生活有关的材料题ppt等4份课件配套教学资源,其中PPT共192页, 欢迎下载使用。
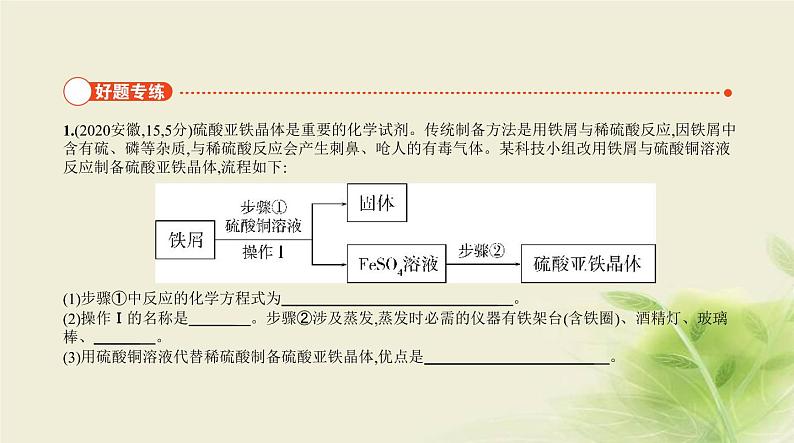
1.(2020安徽,15,5分)硫酸亚铁晶体是重要的化学试剂。传统制备方法是用铁屑与稀硫酸反应,因铁屑中
含有硫、磷等杂质,与稀硫酸反应会产生刺鼻、呛人的有毒气体。某科技小组改用铁屑与硫酸铜溶液
反应制备硫酸亚铁晶体,流程如下: (1)步骤①中反应的化学方程式为 。(2)操作Ⅰ的名称是 。步骤②涉及蒸发,蒸发时必需的仪器有铁架台(含铁圈)、酒精灯、玻璃
棒、 。(3)用硫酸铜溶液代替稀硫酸制备硫酸亚铁晶体,优点是 。
答案 (5分,化学方程式2分,其余每空1分)(1)Fe+CuSO4 Cu+FeSO4(2)过滤 蒸发皿(3)避免有毒气体的产生(其他合理答案均可)
解析 (1)步骤①发生的是铁与硫酸铜的反应,化学方程式为Fe+CuSO4 FeSO4+Cu。(2)将固体和液体分开的操作是过滤;步骤②是从FeSO4溶液中得到硫酸亚铁晶体,其操作为蒸发,蒸发时必须用到的仪
器有铁架台(含铁圈)、酒精灯、玻璃棒和蒸发皿。(3)由于铁屑中含有硫、磷等杂质,与稀硫酸反应会
产生刺鼻、呛人的有毒气体,用硫酸铜溶液代替稀硫酸可避免有毒气体的产生。
解题关键 了解固液混合物的分离方法——过滤。从溶液中得到晶体的方法——蒸发以及操作中用到
的仪器,是解答本题的关键。
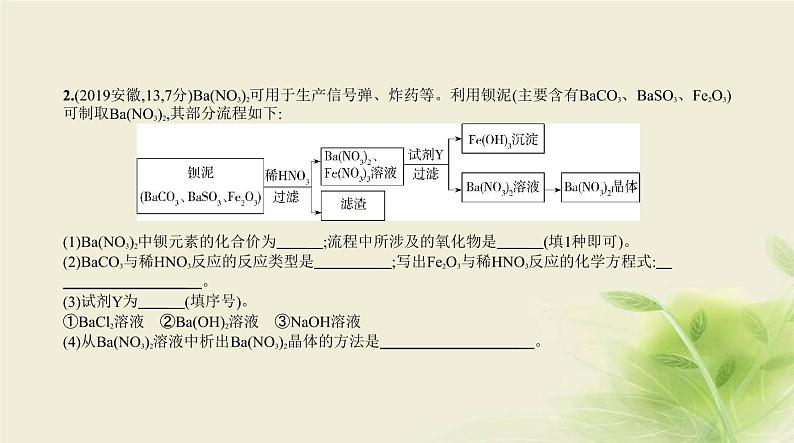
2.(2019安徽,13,7分)Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)
可制取Ba(NO3)2,其部分流程如下: (1)Ba(NO3)2中钡元素的化合价为 ;流程中所涉及的氧化物是 (填1种即可)。(2)BaCO3与稀HNO3反应的反应类型是 ;写出Fe2O3与稀HNO3反应的化学方程式: 。(3)试剂Y为 (填序号)。①BaCl2溶液 ②Ba(OH)2溶液 ③NaOH溶液(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是 。
答案 (7分)(1)+2 Fe2O3(合理即可)(2)复分解反应 Fe2O3+6HNO3 2Fe(NO3)3+3H2O(3)② (4)蒸发溶剂(合理即可)
解析 (1)Ba(NO3)2中钡元素的化合价为+2;流程中所涉及的氧化物有氧化铁、二氧化碳、水等。(2)
BaCO3与HNO3反应生成Ba(NO3)2、CO2和H2O,属于复分解反应;Fe2O3与HNO3反应的化学方程式为Fe2O3
+6HNO3 2Fe(NO3)3+3H2O。(3)根据反应物和生成物推出试剂Y是Ba(OH)2溶液。(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是蒸发溶剂。
解题关键 熟记常见元素的化合价,理解氧化物、复分解反应的概念是解答本题的关键。
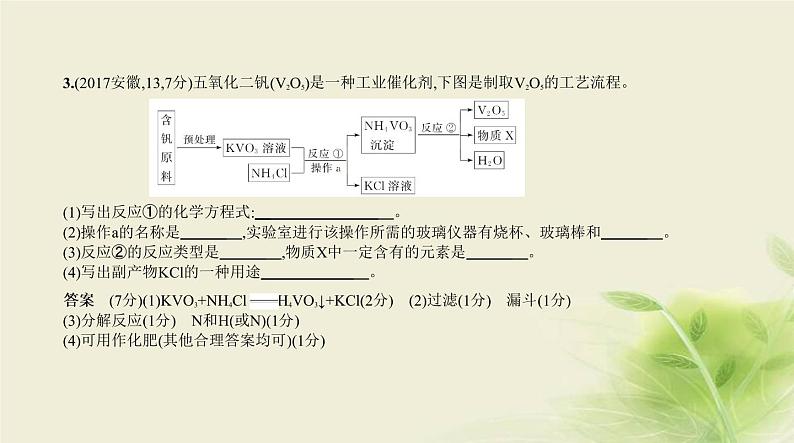
3.(2017安徽,13,7分)五氧化二钒(V2O5)是一种工业催化剂,下图是制取V2O5的工艺流程。 (1)写出反应①的化学方程式: 。(2)操作a的名称是 ,实验室进行该操作所需的玻璃仪器有烧杯、玻璃棒和 。(3)反应②的反应类型是 ,物质X中一定含有的元素是 。(4)写出副产物KCl的一种用途 。
答案 (7分)(1)KVO3+NH4Cl NH4VO3↓+KCl(2分) (2)过滤(1分) 漏斗(1分)(3)分解反应(1分) N和H(或N)(1分)(4)可用作化肥(其他合理答案均可)(1分)
解析 (1)根据工艺流程可知,反应的化学方程式为KVO3+NH4Cl KCl+NH4VO3↓。(2)操作a是把NH4VO3沉淀和KCl溶液分开,所以该操作为过滤;过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒。(3)根据工
艺流程可知,反应②是一种物质生成三种物质,所以是分解反应,根据反应前后元素的种类不变可知,物质
X中一定含有N元素。(4)氯化钾可用作钾肥。
4.(2016安徽,13,7分)高纯氧化锌广泛应用于电子工业,某研究小组设计如下流程制备高纯氧化锌。 (1)反应①的化学方程式为 。(2)反应②的基本反应类型是 。(3)反应②后进行的分离操作名称是 ,若得到的NH4Cl溶液有浑浊,原因可能是
(写出一种即可)。(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为 、 。
答案 (7分)(1)Zn+2HCl ZnCl2+H2↑(2分)(2)复分解反应(1分)(3)过滤(1分) 滤纸破损(1分,其他合理答案均给分)(4)CO2(1分) CO(1分)
解析 (1)锌与稀盐酸反应生成氯化锌和氢气,反应的化学方程式为 Zn+2HCl ZnCl2+H2↑。(2)氯化锌与(NH4)2C2O4反应生成NH4Cl和ZnC2O4沉淀,该反应属于复分解反应。(3)反应②后需将固体与液体分
离,故操作名称为过滤;得到的滤液浑浊,原因可能是滤纸破损或液面超过滤纸边缘等。(4)反应物为ZnC2O4,反应为分解反应,根据质量守恒定律,可知生成的气体为CO和CO2。
5.(2020新疆,14,5分)从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示: (1)图中“操作”的名称是 。(2)写出所得贵重金属中任意一种成分的化学式 。(3)写出①中发生的化学反应方程式 (任写一种);该反应的基本类
型为 。(4)写出②中发生的化学反应方程式 。
答案 (1)过滤 (2)Au(或Pt)(3)2Al+3H2SO4 Al2(SO4)3+3H2↑(或Fe+H2SO4 FeSO4+H2↑) 置换反应(4)2Cu+2H2SO4+O2 2CuSO4+2H2O
解析 (1)题图中“操作”的名称是过滤,通过过滤能够将固体和液体分离。(2)粗铜中加入稀硫酸,反应
后过滤得到的金属混合物是不溶于酸的铜、金、铂,再次加入稀硫酸,加热并通入氧气,铜会反应生成
CuSO4,所得贵重金属是金、铂,化学式分别是Au、Pt。(3)①中稀硫酸和铁反应生成硫酸亚铁和氢气,稀
硫酸和铝反应生成硫酸铝和氢气,发生反应的化学方程式分别为Fe+H2SO4 FeSO4+H2↑、2Al+3H2SO4 Al2(SO4)3+3H2↑,都是置换反应。(4)②中加热条件下稀硫酸和铜、氧气反应生成硫酸铜和水,发生的反应化学方程式为2Cu+2H2SO4+O2 2CuSO4+2H2O。
6.(2020云南昆明,25,6分)工业上利用氟碳铈矿(主要成分为CeFCO3)提取CeCl3的一种工艺流程如下: (1)流程中Ce(BF4)3转化成KBF4的基本反应类型是 。(2)在足量氧气中高温焙烧CeFCO3,化学方程式为 。(3)流程涉及的化合物中,铈元素的化合价为 价。(4)酸浸过程中,CeO2与盐酸反应有刺激性气味的气体单质生成,且化学方程式中CeO2与盐酸的化学计量
数之比为1∶4,则化学方程式为 。
答案 (1)复分解反应 (2)4CeFCO3+O2 3CeO2+CeF4+4CO2 (3)+3、+4(4)2CeO2+8HCl 2CeCl3+Cl2↑+4H2O
解析 (1)流程图中,Ce(BF4)3转化成KBF4的化学方程式为Ce(BF4)3+3KCl 3KBF4+ CeCl3,该反应属于复分解反应;(2)根据质量守恒定律,在氧气中高温焙烧CeFCO3时,除了生成CeO2和CeF4外,还有二氧化碳
气体生成;(3)CeO2和CeF4中铈元素的化合价均为+4,CeFCO3和CeCl3中铈元素的化合价均为+3;(4)根据质
量守恒定律,CeO2和盐酸反应生成的刺激性气味的气体单质是氯气,且CeO2和盐酸的化学计量数之比是
1∶4,则反应的化学方程式为2CeO2+8HCl 2CeCl3+4H2O+Cl2↑。
易错警示 第(2)和(4)问在解答时一定要将流程图和质量守恒定律相结合判断生成物,否则会漏写或错
写某种生成物。
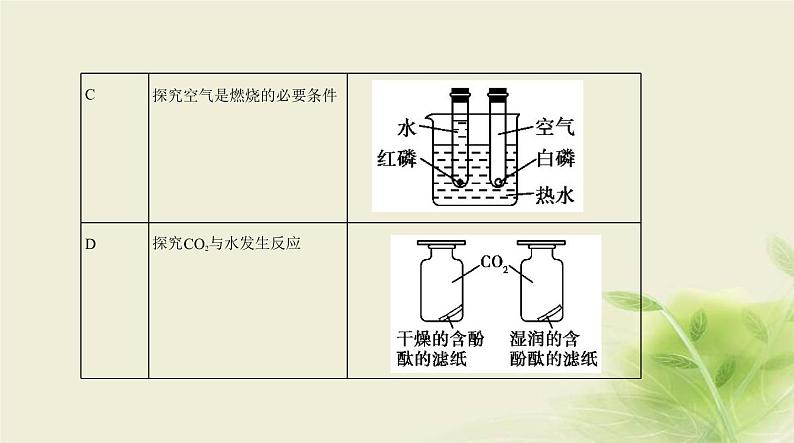
7.(2020江苏苏州,26,8分)硝酸钙可用于无土栽培等。一种利用石灰石制备硝酸钙晶体的流程如下: 已知:硝酸会挥发、受热会分解。(1)气体X为 (填化学式)。(2)“制浆”所得的混合物属于 (填字母)。a.溶液 b.悬浊液 c.乳浊液(3)写出“中和”步骤主要反应的化学方程式: 。(4)工业生产根据以下两项指标判断“中和”反应完全发生:容器内混合物基本变澄清和 。
(5)“制浆”时须控制好加入水的量。加入水量太少会导致制浆困难;加入水量太多会导致 。(6)若省去“制浆”步骤也可制得硝酸钙。但硝酸利用率会降低,同时会产生污染气体NOx。产生NOx的
原因是 。
答案 (1)CO2 (2)b(3)Ca(OH)2+2HNO3 Ca(NO3)2+2H2O(4)溶液的pH等于7(或溶液的pH略小于7)(5)结晶步骤能耗过多(6)CaO与HNO3反应放出大量热,HNO3受热分解产生NOx
解析 (1)煅烧石灰石生成二氧化碳和氧化钙,所以X是CO2。(2)向氧化钙中加水后得到的是氢氧化钙,
氢氧化钙微溶于水,因为反应生成的氢氧化钙部分溶于水,部分悬浮于液体中,所以“制浆”所得的混合
物属于悬浊液。(3)“中和”步骤主要反应是硝酸与氢氧化钙反应生成硝酸钙和水,化学方程式为Ca(OH)2+2HNO3 Ca(NO3)2+2H2O。(4)因为氢氧化钙微溶于水,如果氢氧化钙没有完全反应,液体中就有悬浮的颗粒物;另外氢氧化钙溶液呈碱性,如果氢氧化钙完全反应,溶液应该呈中性,pH=7,所以工业生
产常根据容器内混合物基本变澄清和溶液的pH等于7或略小于7两项指标判断“中和”反应完全发
生。(5)“制浆”时须控制好加入水的量。因为氢氧化钙微溶于水,加入水量太少会导致制浆困难;而如
果加入水量太多会使结晶时消耗过多能量来蒸发浓缩。(6)根据题中提供的信息可知硝酸受热会分解,
而氧化钙和硝酸反应放热,故此过程中产生NOx的原因是CaO与HNO3反应放出大量热,HNO3受热分解产
生NOx。
疑难突破 题中流程的基本原理是利用碳酸钙受热分解生成氧化钙,再将氧化钙制成氢氧化钙的悬浊
液,然后加入稀硝酸中和得到硝酸钙。不直接利用氧化钙与稀硝酸进行反应,是因为氧化钙与硝酸溶液
反应时会放热,使得硝酸分解产生有害气体NOx,同时使HNO3利用率降低。
8.(2020广西北部湾经济区,27,6分)广西蕴藏丰富的铝土资源,铝工业是广西传统优势产业。某工厂用铝
土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取Al2O3,提取流程如下图所示: 已知:Ⅰ.NaOH+Al(OH)3 NaAlO2+2H2OⅡ.NaAlO2+ CO2+2H2O Al(OH)3↓+NaHCO3(1)“酸浸”前,通常将铝土矿进行粉碎处理,“粉碎”的主要目的是 。(2)经检验,滤渣Ⅰ的主要成分是SiO2。由此可推知SiO2的性质有 (填序号)。A.难溶于水B.化学性质很活泼
C.不能与盐酸反应D.不能与NaOH溶液反应(3)滤液Ⅱ中含有的溶质是 (用化学式表示)。(4)滤渣Ⅲ加热时,生成Al2O3和一种常见的氧化物,请写出反应的化学方程式 ,
该反应属于 反应(填基本反应类型)。
答案 (1)增大反应物的接触面积,使反应更充分(或加快反应速率,合理即可)(2)A、C (3)NaOH、NaAlO2、NaCl(缺一不可)(4)2Al(OH)3 Al2O3+3H2O 分解
解析 (1)将铝土矿粉碎的目的是增大反应物的接触面积,加快反应速率,使反应进行得更充分。(2)“酸
浸”步骤中加入了过量的盐酸,滤渣Ⅰ中含有SiO2,说明SiO2不能与盐酸反应,并且难溶于水,故选AC。
(3)“酸浸”步骤中加入了过量的盐酸,Al2O3与盐酸反应生成AlCl3和水,Fe2O3与盐酸反应生成FeCl3和水,
且盐酸过量,则滤液Ⅰ中含有的溶质为AlCl3、FeCl3、HCl;在滤液Ⅰ中加入过量的NaOH溶液,发生反应:
HCl+NaOH NaCl+H2O、3NaOH+FeCl3 Fe(OH)3↓+3NaCl、3NaOH+AlCl3 Al(OH)3↓+3NaCl、NaOH+Al(OH)3 NaAlO2+2H2O,所以滤液Ⅱ中的溶质是NaCl、NaAlO2、NaOH。(4)由已知Ⅱ可知,二氧化碳与滤液Ⅱ中的NaAlO2反应会生成Al(OH)3沉淀,所以滤渣Ⅲ为Al(OH)3,根据质量守恒定律
可知,Al(OH)3受热分解生成的另一种常见的氧化物为H2O,反应的化学方程式为2Al(OH)3 Al2O3+3H2O,该反应属于分解反应。
解题技巧 解答(4)题时可根据已知Ⅱ、在滤液Ⅱ中通入过量二氧化碳,并结合滤渣Ⅲ受热分解得到Al2O3,推知滤渣Ⅲ为Al(OH)3。
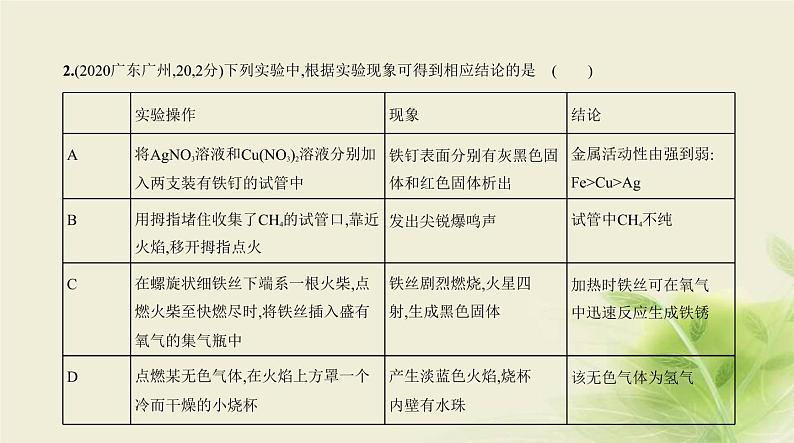
9.(2020山东青岛,29,6分)回收利用废旧金属具有重要意义。某机械厂金属废料的成分是Zn、Cu、ZnO
和CuO,某化学小组利用该金属废料回收铜并制取氧化锌和硫酸铜。请回答下列问题。【活动一】回收铜并制取氧化锌,实验方案如下: (1)步骤Ⅰ所得滤液a中溶质的成分是 (填写化学式)。(2)步骤Ⅲ加入试剂甲的名称是 。(3)步骤Ⅳ加入适量NaOH溶液的目的是 。【活动二】利用活动一回收的铜制取硫酸铜,设计方案如下:方案A:Cu CuO CuSO4
方案B:Cu CuSO4【信息】Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(4)方案A中氧化铜与稀硫酸反应的化学方程式为 。(5)小组同学从绿色化学的视角分析方案B不合理,理由是 (写出一条即可)。
答案 (1)ZnSO4、CuSO4、H2SO4 (2)稀硫酸(3)除去过量的稀硫酸,把硫酸锌转化为氢氧化锌(4)CuO+H2SO4 CuSO4+H2O(5)反应生成二氧化硫,污染空气
解析 (1)锌和稀硫酸反应生成硫酸锌和氢气,氧化锌和稀硫酸反应生成硫酸锌和水,氧化铜和稀硫酸反
应生成硫酸铜和水,还有过量的稀硫酸,所以滤液a中的溶质是ZnSO4、CuSO4、H2SO4。(2)从题图可知,滤液b的溶质是硫酸锌,滤渣是锌和铜,滤液b和滤液c中加入氢氧化钠溶液反应得到氢氧
化锌沉淀和硫酸钠溶液,说明滤液c的溶质含有硫酸锌,所以试剂甲是稀硫酸。(3)加入适量NaOH溶液的目的是除去过量的稀硫酸,把硫酸锌转化为氢氧化锌沉淀,用来制取氧化锌。(4)氧化铜和稀硫酸反应生成硫酸铜和水,化学方程式为CuO+H2SO4 CuSO4+H2O。(5)铜和浓硫酸反应生成的二氧化硫会污染空气。
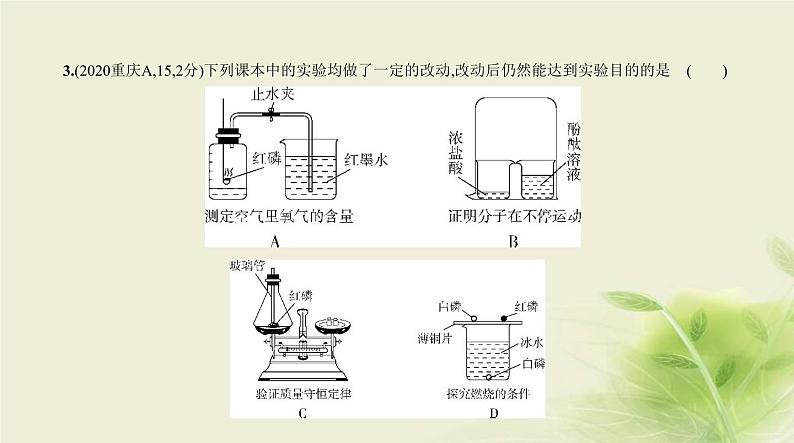
10.(2019广东,21,8分)某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的
机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:已知:Zn(OH)2溶于强碱形成可溶性盐。 (1)滤渣Ⅰ中一定有 。(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到
除铜作用,除铜的化学方程式为 ,此反应属 (填基本反应类型)。(3)调节pH可用NaOH,但不能过量,其原因是 。(4)焙烧Zn(OH)2发生分解反应的化学方程式为 。
答案 (8分)(1)铜(或Cu)(1分)(2)产生氢气容易引起爆炸(1分)Zn+CuSO4 ZnSO4+Cu(2分) 置换反应(1分)(3)Zn(OH)2与NaOH反应生成可溶性盐,导致产率降低(1分)(4)Zn(OH)2 ZnO+H2O(2分)
解析 (1)合金中的Cu不与稀硫酸反应,故加入稀硫酸过滤后,滤渣Ⅰ中一定有Cu。(2)Zn、Fe均能与稀
硫酸反应产生氢气,氢气为易燃气体,故必须通风且远离火源,防止氢气浓度达到爆炸极限并遇到明火而
引起爆炸;合金中的CuO能与稀硫酸反应生成CuSO4,Zn的金属活动性比Cu强,能置换出CuSO4中的Cu。
(3)根据题给信息可知NaOH过量会导致产物Zn(OH)2溶解。(4)由题给流程图可知,Zn(OH)2分解可得氧
化物ZnO和水。
11.(2019内蒙古呼和浩特,14,4分)下图是实验室模拟工业上用大理石(含少量Fe2O3和SiO2)为原料提纯碳
酸钙的实验流程。请回答下列问题:已知:①SiO2不溶于水也不溶于酸②氨水呈碱性,与盐酸反应的化学方程式为:NH3·H2O+HCl NH4Cl+H2O (1)稀盐酸不能用稀硫酸代替,原因是 。(2)操作a中需要用到的玻璃仪器有烧杯、玻璃棒和 。(3)写出滤液A中加氨水生成Fe(OH)3的化学方程式 。(4)滤液B中加入试剂X,恰好完全反应。若滤液C中只含有两种溶质,则试剂X的化学式为 。
答案 (1)硫酸与碳酸钙反应,生成微溶的硫酸钙,阻止反应继续进行(1分,合理即可)(2)漏斗(1分)(3)3NH3·H2O+FeCl3 Fe(OH)3↓+3NH4Cl(1分)(4)(NH4)2CO3(1分)
解析 (1)稀盐酸不能用稀硫酸代替,原因是大理石主要成分是碳酸钙,硫酸与碳酸钙反应,生成微溶的硫
酸钙,阻止反应继续进行。(2)大理石成分中,有不溶于水也不溶于酸的SiO2,加入过量盐酸时,一部分溶于
酸,一部分不溶,故操作a是过滤。过滤中需要用到的玻璃仪器有烧杯、玻璃棒和漏斗。 (3)滤液A的溶
质有FeCl3、CaCl2、HCl,加氨水生成Fe(OH)3。依据元素守恒,应该是氯化铁和氨水反应,化学方程式为
FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl。(4)滤液B的溶质有CaCl2、NH3·H2O、NH4Cl,加入试剂X恰好完全反应。若滤液C中只含有两种溶质,且其中一种产物是NH4Cl。依据元素守恒,则试剂X是(NH4)2CO3。
12.(2018福建,14,6分)以某矿山酸性废水(主要含硫酸、硫酸铁、硫酸铜和硫酸锌等)为原料,通过下述流
程可将废水中的铁、铜和锌分步沉淀,实现回收利用。 (1)步骤①中,加入Ca(OH)2有两个作用。一是中和废水中的硫酸,该反应的化学方程式为 。二是将硫酸铁转化为Fe(OH)3,该反应属于 (填基本反应类型)。(2)步骤③中,锌泥中最主要的含锌化合物的化学式为 。
(3)为分步回收铁、铜、锌等金属资源且直接得到铜单质,只需改变上述流程中的某步骤加入的试剂即可。该步骤和应加入的试剂分别是 。
答案 (1)H2SO4+Ca(OH)2 CaSO4+2H2O 复分解反应 (2)Zn(OH)2(3)步骤②、锌(或其他合理答案)
解析 (1)加入氢氧化钙的作用:一是中和废水中的硫酸生成硫酸钙和水,该反应的化学方程式为H2SO4+
Ca(OH)2 CaSO4+2H2O;二是与硫酸铁反应使其转化为氢氧化铁,该反应是两种化合物相互交换成分生成另外两种化合物的反应,属于复分解反应。(2)溶液2的主要成分是硫酸锌,加入氢氧化钙后,硫酸锌
与氢氧化钙反应生成氢氧化锌沉淀和硫酸钙,故锌泥中最主要的含锌化合物的化学式为Zn(OH)2。(3)只
需改变步骤②,将Na2S换成锌,即可直接得到铜单质。
13.(2018新疆乌鲁木齐,13,6分)CaCl2应用广泛,以石灰石(杂质主要是Fe2O3、MgSO4)为原料生产CaCl2的
流程如下:石灰石粉末 滤液1 滤液2 滤液3 …→产品(1)氧化铁和盐酸反应的化学方程式为 。(2)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 。(3)滤液1中的溶质有HCl、FeCl3、MgSO4和 。(4)写出滤液1中加入BaCl2发生反应的化学方程式: 。(5)滤液2中加入Ca(OH)2可以除去HCl、MgCl2和 。(6)滤液3呈碱性,为使溶液pH降低,可加入适量的 。
答案 (6分)(1)Fe2O3+6HCl 2FeCl3+3H2O(2)漏斗 (3)CaCl2(4)BaCl2+MgSO4 BaSO4↓+MgCl2(5)FeCl3 (6)HCl
解析 (1)氧化铁与盐酸反应生成氯化铁和水,化学方程式为Fe2O3+6HCl 2FeCl3+3H2O。(2)过滤时用到的玻璃仪器有烧杯、漏斗、玻璃棒。(3)石灰石粉末中含有Fe2O3和MgSO4杂质,加入过量的稀盐酸
后过滤,滤液1中的溶质有CaCl2、FeCl3、MgSO4和HCl。(4)滤液1中的MgSO4可与BaCl2反应,生成硫酸钡
沉淀和MgCl2,过滤后得到的滤液2中含有的溶质是HCl、FeCl3、MgCl2、CaCl2。(5)滤液2中加入过量的
Ca(OH)2可除去HCl、MgCl2和FeCl3。(6)由于加入的Ca(OH)2过量,因此滤液3呈碱性,为了使溶液的pH降
低,可加入适量的稀盐酸进行中和。
审题技巧 读懂流程图,根据金属氧化物、酸、碱、盐间反应的规律,联想有关反应的化学方程式;关注
加入的试剂是否过量或足量,根据反应情况,判断反应后滤液中含有的溶质。
1.(2020广东广州,25,8分)某工厂生产硼砂产生的固体废料,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2
O3等,其中MgCO3质量分数为63%。回收镁的工艺流程如下: (1)“酸浸”时MgCO3发生反应的化学方程式为 。(2)“调pH”前滤液Ⅰ的pH 7(填“>”或“
相关课件
这是一份中考化学总复习05第五部分科学探究PPT课件(安徽专用),文件包含13专题十三实验基本操作ppt、14专题十四常见气体的制取与净化ppt、15专题十五物质的检验分离和提纯ppt等3份课件配套教学资源,其中PPT共180页, 欢迎下载使用。
这是一份中考化学总复习02第二部分物质构成的奥秘PPT课件(安徽专用),文件包含07专题七微粒构成物质ppt、08专题八物质的组成和分类ppt等2份课件配套教学资源,其中PPT共120页, 欢迎下载使用。
这是一份中考化学总复习04第四部分化学与社会发展PPT课件(安徽专用),文件包含11专题十一化学与能源ppt、12专题十二化学与生活ppt等2份课件配套教学资源,其中PPT共120页, 欢迎下载使用。









