
高中化学第3节 电能转化为化学能——电解同步达标检测题
展开第三节电能转化为化学能--电解(二)
一、单选题,共15小题
1.某种氢氧燃料电池的电解质溶液为硫酸溶液,下列有关该电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中硫酸的物质的量不变
C.电解质溶液中H+向正极移动
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.2 mol电子转移
2.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是
A.测量原理示意图中,电流方向从Cu流向Ag2O
B.负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C.电池工作时,OH-向正极移动
D.2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
3.NCl3是一种黄色黏稠状液体,可用于制备新型消毒剂ClO2,其制备装置如图所示。下列说法正确的是
A.Pt极发生氧化反应,可用淀粉-KI试纸检验M
B.石墨极的反应式为
C.电解过程中,质子交换膜右侧溶液pH会增大
D.每生成1mol NCl3,会生成67.2L气体M
4.化学与生产、生活密切相关,下列说法不正确的是
A.医用口罩过滤层由聚丙烯熔喷布构成,熔喷布是天然高分子材料
B.地沟油经过加工处理后可用来制肥皂和生物柴油
C.新冠灭活疫苗可采用福尔马林灭活,原理是使蛋白质变性
D.氯气泄漏时,应向地势高处疏散撤离
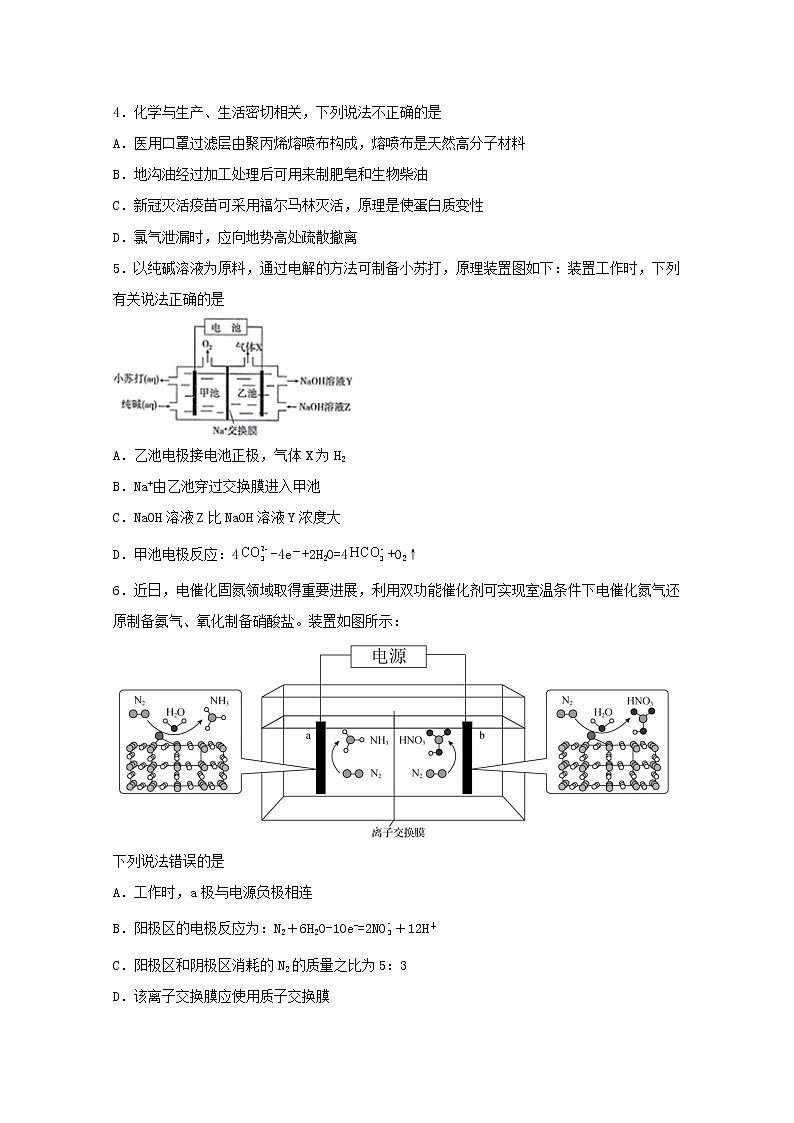
5.以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:装置工作时,下列有关说法正确的是
A.乙池电极接电池正极,气体X为H2
B.Na+由乙池穿过交换膜进入甲池
C.NaOH溶液Z比NaOH溶液Y浓度大
D.甲池电极反应:4-4e-+2H2O=4+O2↑
6.近日,电催化固氮领域取得重要进展,利用双功能催化剂可实现室温条件下电催化氮气还原制备氨气、氧化制备硝酸盐。装置如图所示:
下列说法错误的是
A.工作时,a极与电源负极相连
B.阳极区的电极反应为:N2+6H2O-10e-=2NO+12H+
C.阳极区和阴极区消耗的N2的质量之比为5:3
D.该离子交换膜应使用质子交换膜
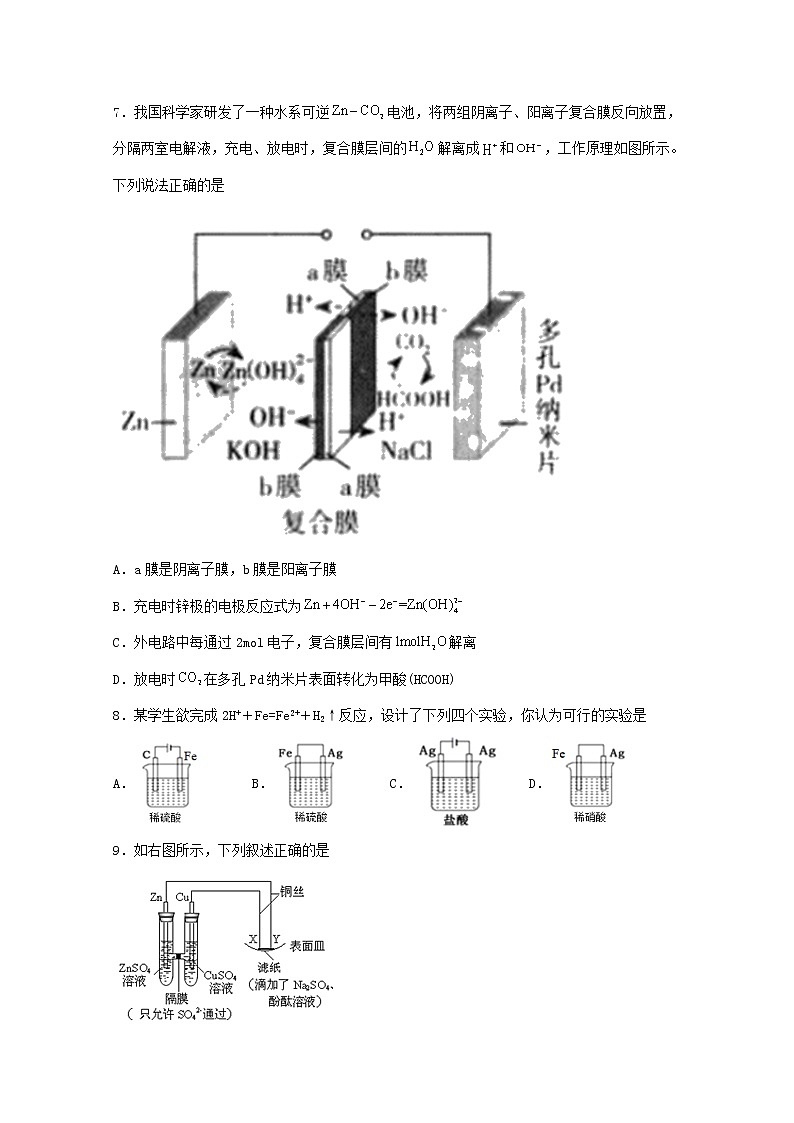
7.我国科学家研发了一种水系可逆电池,将两组阴离子、阳离子复合膜反向放置,分隔两室电解液,充电、放电时,复合膜层间的解离成和,工作原理如图所示。下列说法正确的是
A.a膜是阴离子膜,b膜是阳离子膜
B.充电时锌极的电极反应式为
C.外电路中每通过2mol电子,复合膜层间有解离
D.放电时在多孔Pd纳米片表面转化为甲酸(HCOOH)
8.某学生欲完成2H++Fe=Fe2++H2↑反应,设计了下列四个实验,你认为可行的实验是
A. B. C. D.
9.如右图所示,下列叙述正确的是
A.X为阴极,发生还原反应
B.电子沿ZnYXCu路径流动
C.Na+移向Y,与滤纸接触处有氧气生成
D.Y与滤纸接触处变红
10.500mLNaNO3和Cu(NO3)2的混合溶液中c(Na+)为0.2 mol·L-1,用Pt作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(NO3-)=0.4 mol·L-1
B.假设上述电解进行了5min,则通过的电量为0.2 ×NA×1.60×10-19C
C.电解得到的Cu的质量为12.8g
D.电解后溶液中pH=1,要想恢复原状,可加0.05mol的CuCO3
11.原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。下列关于下图所示原电池装置的说法中,不正确的是
A.Cu为原电池的正极
B.能将化学能转化为电能
C.电子从Cu经导线流向Zn
D.Cu上发生的反应为2H++ 2e-=H2↑
12.下列有关说法正确的是
A.反应NH3(g)+HCl(g)==NH4Cl(s)在室温下可自发进行,则该反应的∆H<0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH溶液加水稀释后,溶液中的值增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,水解程度减小,溶液的pH减小
13.关于如图所示装置的判断,叙述正确的是( )
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.电子流向:Cu→经过CuSO4溶液→Zn→b
D.当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L
14.能用于工业生产的是
A.钠在氯气中燃烧制氯化钠 B.二氧化锰和浓盐酸共热制氯气
C.氯气与消石灰反应制漂白粉 D.电解NaCl溶液制金属钠
15.以为原料,采用电解法制取的装置如图。下列说法中正确的是
A.电子由铅合金经溶液流到金属DSA电极
B.每转移1mole-时,阳极电解质溶液的质量减少8g
C.阴极主要电极反应式为+6e-+6H+→+2H2O
D.反应结束后阳极区pH增大
二、非选择题,共5小题
16.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
17.I.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:Cu+2AgNO3=2Ag+Cu(NO3)2
(1)请指出正极材料、负极材料、电解质溶液(写化学式)正极:_______,负极:_______,电解质溶液:_______。
(2)写出电极反应式:正极:_______负极:_______。
(3)溶液中Ag+向_______极移动,电子从_______极流向_______极。(填“正”或“负”)
II.某种甲烷然料电池的工作原理如下图所示:
(4)该装置的负极是电极_______(填“A”或“B”);c处通入的物质是_______(填“CH4”或“O2”)。
(5)甲烷燃料电池供电时的总反应方程式为_______,正极电极方程式:_______。
(6)当该装置转移电子的数目为0.4mol时,消耗CH4标准状况下_______L。
18.以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
(1)B极上的电极反应式为___________________________。
(2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,则电解时阳极的反应式为_______________________________________,当阳极收集到11.2L(标准状况)气体时,消耗甲醇的质量为__________克(保留两位有效数字),若要使溶液复原,可向电解后的溶液中加入的物质有 ___________。
(3)目前已开发出用电解法制取ClO2的新工艺。
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的________极(填A或B),写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
19.在右下图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g。
请回答下列问题:
(1)B电极发生反应的电极反应式________________。
C电极发生反应的电极反应式________________。
(2)甲池电解时反应的离子方程式________________。
(3)甲池电解后溶液的c(H+)为__________,要使电解后溶液恢复到电解前的状态,则需加入________,其质量为________g。(假设电解前后溶液的体积不变)
(4)请你设计实验确定甲池原溶液中可能含有的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤、实验现象和实验结论
①假设一:_______________;
②假设二:_______________。
(5)若再将K1断开,闭合K2,灵敏电流计中指针是否会发生偏转____________?理由是什么____________?
20.次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种一元中强酸,写出其电离方程式___________ 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为___________ 。
②NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___________(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式___________ 。
②分析产品室可得到H3PO2的原因 ___________ 。
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有PO等杂质,该杂质产生的原因是___________ 。
参考答案
1.A
【详解】
A.因为电解质溶液是酸性环境,故正极反应式是:,A错误;
B.因为总反应式是,不消耗硫酸,故电解质中硫酸的物质的量不变,B正确;
C.原电池中阳离子移向正极,阴离子移向负极,故H+向正极移动,C正确;
D.用该电池点解CuCl2溶液,阳极反应式:2Cl-—2e-=Cl2↑,氯气与电子之间的比例关系为1:2,2.24 L Cl2的物质的量n=,电子的物质的量=2n=0.2mol,D正确;
故本题选A。
2.B
【分析】
反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,据此分析可知,铜为负极,氧化银为正极,极反应分别为:2Cu+2OH--2e-=Cu2O+H2O,Ag2O+2e-+H2O=2Ag+2OH-,据以上分析解答。
【详解】
A.测量原理示意图中,铜为负极,氧化银为正极,所以电流方向从Ag2O流向Cu,故A错误;
B.铜为负极,失去电子,负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O,故B正确;
C.电池工作时,OH-向负极移动,故C错误;
D.该反应为放热反应,所以2molCu与1molAg2O的总能量高于1molCu2O与2molAg具有的总能量,故D错误;
故选B。
3.C
【分析】
由装置可知,石墨电极是阳极,该电极上发生失电子的氧化反应,Pt是阴极,在阴极上是氢离子得电子的还原反应,电极反应式为:2H++2e-=H2↑,气体M为氢气,质子交换膜只让氢离子通过,且向阴极移动,以此分析。
【详解】
A.Pt是阴极,在阴极上是氢离子得电子的还原反应,电极反应式为2H++2e=H2↑,不可用湿润的淀粉KI试纸检验氢气,故A不符合题意;
B.由图可知,石墨电极是阳极,该电极上发生失电子的氧化反应为,故B不符合题意;
C.电解过程中,质子交换膜右侧电极上发生的电极反应,每生产1molNCl3同时生成4molH+,理论上有6molH+经质子交换膜由右侧向左侧迁移,右侧溶液的c(H+)减小,pH增大,故C符合题意;
D.每生成1molNCl3,由于气体所处的状态未知,无法计算氢气的体积,故D不符合题意;
答案选C。
4.A
【详解】
A.医用口罩过滤层由聚丙烯熔喷布构成,丙烯发生加聚反应生成聚丙烯,熔喷布是合成高分子材料,故A错误;
B.地沟油的成分是高级脂肪酸甘油酯,经过加工处理后可用来制肥皂和生物柴油,故B正确;
C.福尔马林是甲醛的水溶液,甲醛能使蛋白质变性,故C正确;
D.氯气有毒,氯气的密度大于空气,氯气泄漏时,应向地势高处疏散撤离,故D正确;
选A。
5.D
【分析】
装置图分析可知放出氧气的电极为阳极,电解质溶液中氢氧根离子放电生成氧气,气流浓度增大,碳酸根离子结合氢离子生成碳酸氢根离子,出口为碳酸氢钠,则电极反应,4+2H2O-4e-=4+O2↑,气体X为阴极上溶液中氢离子得到电子发生还原反应生成氢气,电极连接电源负极,放电过程中生成更多氢氧根离子,据此分析判断。
【详解】
A.乙池电极为电解池阴极,和电源负极连接,溶液中氢离子放电生成氢气,A错误;
B.电解池中阳离子移向阴极,钠离子移向乙池,B错误;
C.阴极附近氢离子放电破坏了水的电离平衡,电极附近氢氧根离子浓度增大,NaOH溶液Y比NaOH溶液Z浓度大,C错误;
D.放出氧气的电极为阳极,电解质溶液中氢氧根离子放电生成氧气,氢离子浓度增大,碳酸根离子结合氢离子生成碳酸氢根离子,出口为碳酸氢钠,则电极反应为4+2H2O-4e-=4+O2↑,D正确;
故选D。
6.C
【分析】
该装置为电解池,a电极上N2被还原为氨气,所以a为阴极,b电极上N2被氧化为硝酸,所以b为阳极。
【详解】
A.工作时a为阴极,连接电源负极,A正确;
B.b为阳极,N2失电子结合水生成硝酸,电极反应为N2+6H2O-10e-=2NO+12H+,B正确;
C.阴极N2→NH3,N元素化合价降低3价,阳极N2→HNO3,N元素化合价升高5价,根据电子守恒可知阳极区和阴极区消耗的N2的质量之比为3:5,C错误;
D.阳极产生H+,阴极反应为N2+6e-+6H+=2NH3,为了能使氢离子顺利进入阴极区,离子交换膜应使用质子交换膜,D正确;
综上所述答案为C。
7.D
【详解】
A.由图示分析可知,放电时该装置为原电池,穿过a膜向右移动, 通过b膜向左移动,所以a膜是阳离子膜,b膜是阴离子膜,故A错误;
B.由图示分析可知放电时Zn为负极,发生氧化反应;充电时Zn为阴极发生还原反应,所以为放电时的电极反应,故B错误;
C.根据电子守恒可知,外电路通过2mol电子时,复合膜就有理解成氢离子和氢氧根离子,故C错误;
D.由图示分析可知,放电时在多孔Pd纳米片表面催化转化为甲酸(HCOOH),故选D。
答案选D。
8.B
【详解】
A. 该装置是电解池,C是阳极,电极反应为2H2O-4e-=4H++O2↑,Fe是阴极,电极反应为:2H++2e-=H2↑,故总反应为:2H2O2H2↑+O2↑,A不合题意;
B.该装置是原电池,Fe是负极,电极反应为:Fe-2e-=Fe2+,Ag是正极,电极反应为:2H++2e-=H2↑,故总反应为:2H++Fe=Fe2++H2↑,B符合题意;
C.该装置是电解池,左边Ag是阳极,电极反应为Ag-e-+Cl-=AgCl↓,右边Ag是阴极,电极反应为:2H++2e-=H2↑,故总反应为:2Ag+2H++2Cl- H2↑+ 2AgCl↓,C不合题意;
D.该装置是原电池,Fe是负极,电极反应为:Fe-2e-=Fe2+,Ag是正极,电极反应为:+4H++3e-=2H2O+NO↑,故总反应为:3Fe +8H++2=3Fe2++4H2O+2NO↑,D不合题意;
故答案为:B。
9.D
【解析】该装置中,左边装置是原电池,Zn易失电子作负极、Cu作正极,右边装置是电解池,X为阳极、Y为阴极,阳极上电极反应为Cu-2e-=Cu2+、阴极电极反应式为2H2O+2e-=2OH-+H2↑。A.X与原电池的正极相连为阳极,阳极失电子发生氧化反应,故A错误;B.电子从原电池负极锌流出经导线流向阴极Y,电子又从阳极X流出经导线流向正极铜,电子不能通过X与Y之间的电解质溶液,故B错误;C.通过以上分析知,Y是阴极,阳离子钠离子与氢离子都向阴极移动,氢离子先放电,在阴极上得电子发生还原反应产生氢气,故C错误;D.Y为阴极,电极反应式为2H2O+2e-=2OH-+H2↑,生成碱,所以Y和滤纸接触处变红,故D正确;故选D。
点睛:正确判断原电池和电解池是解题的关键。本题中左边装置是锌铜原电池,Zn易失电子作负极、Cu作正极,右边装置是电解池,电解硫酸钠溶液,X为阳极、Y为阴极。
10.A
【解析】石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=n(H2)==0.1mol,
阳极发生 4OH-- 4e- ═O2↑+2H2O,
0.4mol 0.1mol
阴极发生Cu2++2e- ═ Cu、 2H+ +2e- ═H2↑,
0.1mol 0.2mol 0.1mol 0.2mol 0.2mol 0.1mol
A.c(Cu2+)==0.2mol/L,由电荷守恒可知,原混合溶液中c(NO3-)为0.2mol/L+0.1mol/L×2=0.4mol/L,故A正确;B. 假设上述电解进行了5min,则通过的电量为0.4×5 ×NA×1.60×10-19C,选项B错误;C、由选项A分析可知,电解得到的Cu的质量为0.1mol ×64g/mol=6.4g,选项C错误;D、电解后溶液中pH=1,要想恢复原状,可加0.1mol的CuCO3,选项D错误。答案选A。
11.C
【详解】
A. 该装置为原电池,锌比铜活泼作负极、Cu为原电池的正极,A正确;
B. 原电池中氧化、还原分别在两极上进行,故能将化学能转化为电能,B正确;
C. 原电池中负极上还原剂失去电子,电子从负极流出,则电子从Zn经导线流向Cu,C不正确;
D. 正极上氧化剂得到电子被还原,则Cu上发生的反应为2H++ 2e-=H2↑,D正确;
答案选C。
12.A
【详解】
A.当△G=△H-T△S<0,反应能自发进行,已知反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,该反应为△G<0的反应,所以反应的△H<0,故A正确;
B.电解法精炼铜时,阳极逐渐溶解,则粗铜作阳极,阴极析出Cu,纯铜作阴极,故B错误;
C.加水稀释促进CH3COOH的电离,所以CH3COOH溶液加水稀释后,n(CH3COOH)减少,n(CH3COO-)增大,则溶液中的值减小,故C错误;
D.Na2CO3溶液中存在碳酸根的水解平衡,加入Ca(OH)2固体,钙离子与碳酸根离子结合生成碳酸钙沉淀,碳酸根的水解平衡逆移,CO32-水解程度减小,加Ca(OH)2固体溶液中氢氧根离子浓度增大,所以pH增大,故D错误;
故选A。
13.D
【分析】
根据图示装置可知,左侧装置为氢氧燃料电池,氢气为负极,发生氧化反应;氧气为正极,发生还原反应;右侧装置为电解池,铜与正极相连,为阳极,锌与负极相连,为阴极;据此进行分析。
【详解】
A. 左边的装置是原电池,右边的装置是电解池,故A错误;
B. 左边是氢氧燃料电池,为原电池,通入氢气的电极是负极,通入氧气的电极是正极,则锌是阴极,铜是阳极,故B错误;
C. 左边是原电池,通入氢气的电极是负极,通入氧气的电极是正极,则锌是阴极,铜是阳极,装置中电子从b沿着导线流向Zn,电子从Cu沿着导线流向a,电子不进入电解质溶液,故C错误;
D. 根据转移电子守恒得 ,当铜片的质量变化为12.8g时,a极上消耗的O2在标况下体积为,故D正确;
答案选D。
14.C
【详解】
A.钠在氯气中燃烧制氯化钠,可应用于实验室验证物质的性质,在工业上通过晒制方法从海水中提取NaCl,A错误;
B.二氧化锰和浓盐酸共热制氯气用于实验室制取氯气,在工业上用电解饱和食盐水制取氯气,B错误;
C.氯气与消石灰反应制漂白粉,由于原料容易获得,价格低廉,可应用于工业生产,C正确;
D.电解食盐水得到氢氧化钠和氯气、氢气,电解熔融NaCl制金属钠,D错误;
故选C。
15.C
【分析】
金属阳极DSA发生2H2O-4e-=O2+4H+,阴极的主要电极反应式为+6e-+6H+→+2H2O,据此答题。
【详解】
A.金属阳极DSA发生2H2O-4e-=O2+4H+,失去的电子由金属阳极DSA经导线流向直流电源的正极,由直流电源的负极经导线流向铅合金,故A错误;
B.由金属阳极DSA发生2H2O-4e-=O2+4H+知,每转移1mol e-时,消耗0.5mol水,以氧气形式放出的是8g,通过阳离子交换膜的氢离子1g,阳极电解质溶液的质量减少9g,故B错误;
C.阴极的主要电极反应式为+6e-+6H+→+2H2O,故C正确;
D.阳极区电极反应为2H2O-4e-=O2+4H+,硫酸的浓度增大,反应结束后阳极区pH减小,故D错误;
故选:C。
16.2H2O-4e-=4H++O2↑ a
【分析】
电解池阳极为稀硫酸溶液,电解质溶液显酸性,电解池阳极发生氧化反应,溶液中分隔各个室的膜为阳离子交换膜,只允许阳离子通过,阳离子向阴极移动,据此分析。
【详解】
电解池的阳极电解质为稀硫酸溶液,电解质溶液显酸性,电解池阳极上阴离子失去电子,发生氧化反应,溶液中含有的阴离子有OH-、SO42-,由于放电能力OH->SO42-,所以应为H2O电离产生的OH-放电,产生O2和H+,则电极反应为:2H2O-4e-=O2↑+4H+。溶液中分隔各个室的膜为阳离子交换膜,阳离子向阴极移动,H+向右移动,在b室发生反应:2H++2e-=H2↑,H+不断消耗,使c(H+)降低,所以b室较a室c(H+)有所降低,因此电解后,a室的NaHSO3浓度增加。
【点睛】
本题以焦亚硫酸钠Na2S2O5为背景,考查电解原理的应用,电极反应式的书写、离子浓度的变化,试题有助于培养综合分析问题的能力。
17.Ag或石墨 Cu AgNO3 Ag++e-=Ag Cu-2e-=Cu2+ 正 负 正 B CH4 CH4+2O2=CO2+2H2O O2+4H++4e-=2H2O 1.12
【分析】
【详解】
(1)分析反应方程式Cu+2AgNO3=2Ag+Cu(NO3)2可知,Cu的化合价升高,被氧化,故做负极,则正极材料需比铜更不活泼的金属电极或者惰性电极,电解质溶液为AgNO3溶液,故答案为:Ag或石墨;Cu;AgNO3;
(2)根据原电池中负极发生氧化反应,正极发生还原反应可知,电极反应式:正极:Ag++e-=Ag;负极:Cu-2e-=Cu2+,故答案为:Ag++e-=Ag;Cu-2e-=Cu2+;
(3)原电池电解质溶液中阳离子移向正极,阴离子移向负极,故溶液中Ag+向正极移动,电子从负极流向正极,故答案为:正;负;正;
(4)根据图示可知,电子由电极B移向电极A,故该装置的负极是电极B,燃料电池中通入燃料的一极是负极,通入氧气等氧化剂的是正极,故c处通入的物质是CH4,故答案为:B;CH4;
(5)根据燃料电池反应方程式的书写结合电解质溶液为稀硫酸,故甲烷燃料电池供电时的总反应方程式为CH4+2O2=CO2+2H2O,正极电极方程式为:O2+4H++4e-=2H2O,故答案为:CH4+2O2=CO2+2H2O;O2+4H++4e-=2H2O;
(6)根据电子守恒可知,当该装置转移电子的数目为0.4mol时,消耗CH4的物质的量为0.05mol,故其在标准状况下的体积为0.05mol×22.4L·mol-1=1.12L,故答案为:1.12。
18.3O2-+CH3OH-6e-=CO2+2H2O 2H2O-4e-=4H++O2 10.67 CuO或CuCO3 A 4OH-+Cl--5e- =ClO2+2H2O 0.01
【详解】
(1)由阴离子移动方向可知B为负极,负极发生氧化反应,甲醇被氧化生成二氧化碳和水,电极方程式为3O2-+CH3OH-6e-=CO2+2H2O,故答案为3O2-+CH3OH-6e-=CO2+2H2O;(2)用惰性电解硫酸铜溶液时,阳极为水电离的OH-放电,电极反应式为:2H2O-4e-=4H++O2,当阳极产生11.2L气体时,转移的电子为11.2L÷22.4L/mol×4=2mol,由电子守恒可得甲醇的质量为2mol÷6×32g/mol=10.67g,在电解硫酸铜溶液的过程中,阴极析出铜,阳极析出氧气,若要使溶液复原,根据原子守恒可知应向溶液中加入CuO或CuCO3,故答案为2H2O-4e-=4H++O2、10.67、CuO或CuCO3;(3)①根据钠离子的移动方向可知a极为电解池的阳极,与电源的正极相连接,故接A极,在阳极为氯离子放电,且生成物为ClO2,则电极反应为:4OH-+Cl--5e- =ClO2+2H2O,故答案为A、4OH-+Cl--5e- =ClO2+2H2O;②H+在阴极上放电产生氢气,转移电子的物质的量n(e-)=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,则在内电路中移动的电荷为0.01 mol,每个Na+带一个单位的正电荷,则通过的Na+为0.01 mol,故答案为0.01。
【点睛】
本题综合考查电化学知识,为高频考点,侧重于学生的分析、计算能力的考查,解答本题要注意把握原电池的工作原理,把握电极方程式的书写,题目难度中等。
19.4OH—-4e—=2H2O+O2↑ 2H++2e—=H2↑ 2Cu2++2H2O 2Cu+O2↑+4H+ 0.4mol/L CuO 8 假设原溶液中的酸根离子为SO42—。取电解后的溶液,向其中加入BaCl2溶液,若有白色沉淀产生,则原溶液中含SO42— 假设原溶液中的酸根离子为NO3—。取电解后的溶液,向其中加入Cu微热,若Cu溶解,并有无色气体生成,在空气中变为红棕色,则含有NO3— 偏转 打开K1,关闭K2,形成H2、O2燃料电池
【解析】
【分析】
A电极表面有红色的固态物质生成,所以A电极是阴极,B电极有无色气体生成,所以B是阳极,所以C是阴极,该电极产生的气体是氢气,D电极是阳极,该极上产生的是氧气,所以q是正极,p是负极,根据原电池原理和电解池原理分析解答。
【详解】
A电极表面有红色的固态物质生成,所以A电极是阴极,B电极有无色气体生成,所以B是阳极,所以C是阴极,该电极产生的气体是氢气,D电极是阳极,该极上产生的是氧气,所以q是正极,p是负极,
(1)电解过程中,B是阳极,电极反应式为4OH--4e-=2H2O+O2↑,乙池C电极是阴极,该电极发生反应的电极反应式为:2H++2e-=H2↑,故答案为4OH--4e-=2H2O+O2↑;2H++2e-=H2↑;
(2)电解硫酸铜生成硫酸、铜和氧气,甲池电解时反应的离子方程式为:2Cu2++2H2O2Cu+O2↑+4H+,故答案为2Cu2++2H2O2Cu+O2↑+4H+;
(3)取出A电极,洗涤、干燥、称量,电极质量增重6.4g,即生成金属铜的物质的量是0.1mol,根据2Cu2++2H2O2Cu+O2↑+4H+,生成硫酸中氢离子的物质的量是0.1mol,所以氢离子浓度是=0.4mol/L;电解质复原的方法:出什么加什么,要使电解后溶液恢复到电解前的状态,则需加0.1mol的氧化铜,质量是0.1mol×80g/mol= 8g,故答案为0.4mol/L;CuO;8;
(4)根据两极上的现象,可以推知电解的是可溶性的铜盐溶液,阴离子可以是SO42-或NO3 。
①硫酸根离子的检验方法:取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-,故答案为假设原溶液中的酸根离子为硫酸根离子,取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-;
②假设原溶液中的酸根离子为硝酸根离子,取少量待测液于试管中,滴加浓硫酸,再加入铜粉,若有红棕色气体产生,则证明含有硝酸根离子,故答案为硝酸根离子,取少量待测液于试管中,滴加浓硫酸,再加入铜粉,若有红棕色气体产生,则证明含有硝酸根离子;
(5)再将K1断开,闭合K2,电流计指针发生偏转,形成氢氧燃料电池,灵敏电流计中指针会发生偏转,故答案为偏转;打开K1,关闭K2,形成H2、O2燃料电池。
20.H3PO2H+ + H2PO +1 正盐 弱碱性 2H2O-4e-=4H++O2↑ 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2 H3PO2或H2PO被氧化
【详解】
(1)H3PO2是一种一元中强酸,电离出一个氢离子,其电离方程式H3PO2H+ + H2PO;故答案为:H3PO2H+ + H2PO;
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银;
①H3PO2中,H为+1价,O为−2价,根据化合价计算出P元素的化合价为+1价;故答案为:+1;
②H3PO2是一元酸,只能电离出一个氢离子,被NaOH反应,因此NaH2PO2为正盐,该盐为强碱弱酸盐,因此其溶液显弱碱性;故答案为:正盐;弱碱性;
(3)①阳极是水中的氢氧根失去电子变为氧气,其电极反应式2H2O-4e-=4H++O2↑;故答案为:2H2O-4e-=4H++O2↑;
②阳极是水中的氢氧根失去电子变为氧气,剩余的氢离子通过阳膜进入到产品室,阴极是水中的氢离子得到电子变为氢气,原料室的钠离子穿过阳膜进入阴极室,致使原料室负电荷多,因此原料室的H2PO穿过阴膜进入到产品室,与氢离子反应生成H3PO2;故答案为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2;
③阳极室与产品室合并,产品室中的产品中混有PO等杂质,主要是阳极产生氧气,H3PO2或H2PO被氧气氧化导致的;故答案为:H3PO2或H2PO被氧化。
鲁科版 (2019)选择性必修1第3节 电能转化为化学能——电解一课一练: 这是一份鲁科版 (2019)选择性必修1第3节 电能转化为化学能——电解一课一练,共18页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。
化学选择性必修1第3节 电能转化为化学能——电解课后测评: 这是一份化学选择性必修1第3节 电能转化为化学能——电解课后测评,共16页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第3节 电能转化为化学能——电解课后作业题: 这是一份鲁科版 (2019)选择性必修1第3节 电能转化为化学能——电解课后作业题,共17页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。













