



人教版 (2019)必修 第二册第二节 化学反应的速率与限度评课课件ppt
展开
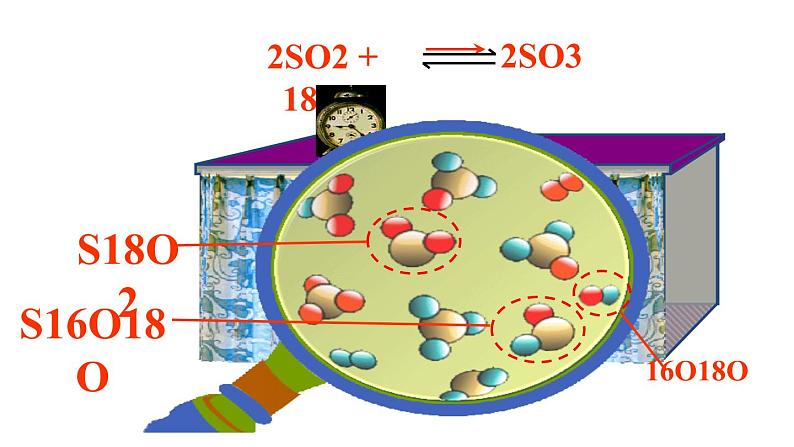
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度评课课件ppt,共23页。PPT课件主要包含了SO3,S18O2,S16O18O,O18O,可逆反应,反应开始时,反应速率,时间t,反应进行中,逐渐减小等内容,欢迎下载使用。
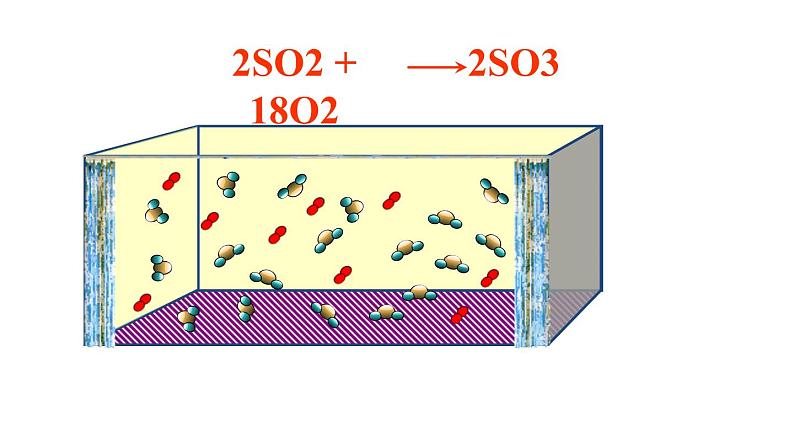
2SO2 + 18O2
2SO2 + 18O2
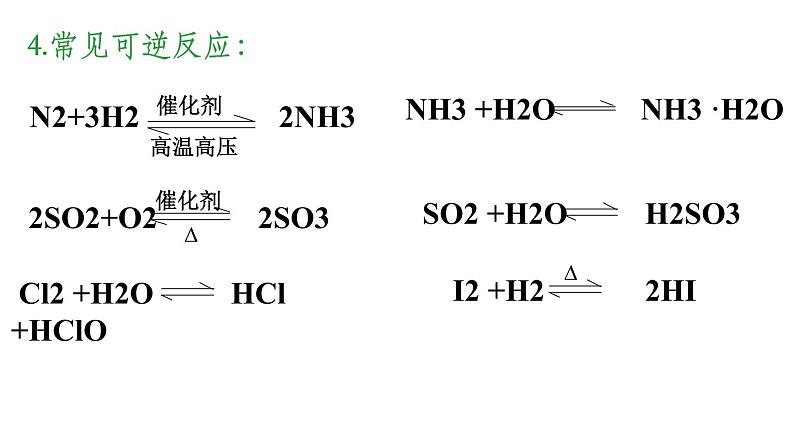
1.定义:在相同条件下,既能向正反应方向同时又能向逆反应方向进行的化学反应。
双同性:正、逆反应是在同一条件下同时进行的。双向性:正反应和逆反应是两个完全相反的不同反应。 共存性:反应物和生成物同时存在,可逆反应不能进 行到底,反应物的转化率不可能为100% 。
科学史话:炼铁高炉尾气之谜
C+O2===CO2C+CO2===2COFe2O3+3CO===2Fe+3CO2
炼制生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
启示:很多化学反应在进行时都具有可逆性,只是可逆的程度有所不同并且差异很大。并不能实现反应物到生成物的完全转化,即化学反应是有限度的。那么如何确定可逆反应的限度?
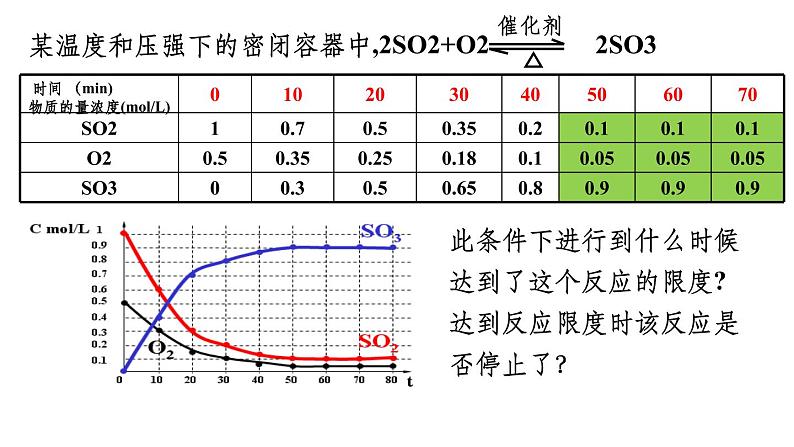
某温度和压强下的密闭容器中,2SO2+O2 2SO3
时间 (min)物质的量浓度(ml/L)
此条件下进行到什么时候达到了这个反应的限度?达到反应限度时该反应是否停止了?
(1)反应物浓度 ,正反应速率 ; 生成物浓度为 ,逆反应速率为 ;
1、化学平衡状态的建立
正逆反应都进行,v(逆) ≠0,v(正)> v(逆)
(2)反应物浓度 ,正反应速率 ; 生成物浓度 ,逆反应速率 ;
(3)正反应速率和逆反应速率 。反应物的浓度 ,生成物的浓度 。
反应一段时间(50min)后:
v(正)= v(逆) ≠0
达到一种表面静止的状态,我们称为“化学平衡状态”,简称化学平衡。
1.化学平衡建立的过程
正反应速率可表示为:v(SO2)消耗、v(O2)消耗、v(SO3)生成
逆反应速率可表示为:v(SO2)生成、v(O2)生成、v(SO3)消耗
v(SO2)消耗= v(SO2)生成
v(O2)消耗= v(O2)生成
v(SO3)生成= v(SO3)消耗
在一定条件下的可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再改变,达到一种表面静止的状态。
2、化学平衡状态的定义
化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大程度,即该反应的限度。
化学反应的限度决定了反应物在该条件下的最大转化率。任何可逆反应在给定条件下的进程都有一定的限度,只是不同反应的限度不同。改变反应条件可以在一定程度上改变一个化学反应的限度,亦即改变该反应的化学平衡状态。
4、化学平衡状态的特征
③动:动态平衡,反应仍在进行(v(正)= v(逆) ≠0)
②等:v(正)= v(逆) (内在本质)
④定:外界条件一定,混合体系中各组分百分含量保持一定、 浓度不变(外在标志)
⑤变:外界条件改变,原平衡可能被破坏,并在新的条件下建 立新的化学平衡,即发生化学平衡的移动。
①逆: 研究对象为可逆反应
5、化学平衡状态的判断方法
①V正=V逆(直接标志)②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于化学计量数之比;在化学方程式两边的不同物质的生成(或消耗)速率之比等于化学计量数之比③各组分浓度、物质的量、百分含量(质量、物质的量、体积)保持不变④体系的颜色不再发生改变⑤反应体系中的总压强、平均相对分子质量、密度不随时间的改变而变化⑥其他方法:一切变化的量从某一时刻开始不再发生改变,反应达到平衡状态
1、控制化学反应条件的意义
三、化学反应条件的控制
在生产和生活中,人们希望促进有利的化学反应(提高反应速率,提高反应物的转化率即原料的利用率),抑制有害的化学反应(降低反应速率,控制副反应的发生,减少甚至消除有害物质的产生),这就需要进行化学反应条件的控制。
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
2、影响煤燃烧效率的条件(1)煤的状态 (2)空气用量 (3)炉(灶)膛材料的选择 (4)燃烧后烟道废气中热量的利用。3、提高燃料燃烧效率的措施(1)尽可能使燃料 ,提高能量的转化率。关键是燃料与空气或氧气尽可能 ,且空气要 。(2)尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
现在,假设你是一名工程师,你要提高你工厂煤的燃烧效率,你认为应该从哪些方面进行分析?
煤的状态与燃烧的速率有何关系?与煤的充分燃烧有何关系?空气的用量对煤的充分燃烧有什么影响?原因是什么?应选用什么样的炉膛材料?如何充分利用煤燃烧后的废气中的热量?
1、煤被研得越细,粉末越小,与空气中O2的接触面积越大,燃烧越充分,反应速率越快。
2、空气充足,煤燃烧生成CO2越充分,放热越多;若空气不足,则煤燃烧部分生成CO,CO排到空气中造成污染,且生成CO时,放出的热量大大减少。
3、应选择保温隔热且耐热的炉膛材料;选用保温隔热材料的目的,正是为了防止热量散失。
4、可将燃烧后的废气通过交换装置,供其他方面使用。
1.某可逆反应达到平衡状态时,下列说法正确的是( )①正反应和逆反应同时进行,逆反应达到平衡状态时两者的速率完全相等 ②反应物和生成物同时存在,两者的浓度相同 ③混合物的组成比例不会因时间而改变A.① B.①③ C.② D.①②③
2.下列关于化学反应限度的说法中正确的是( )A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零C.平衡状态时,各物质的浓度保持相等D.化学反应的限度不可以通过改变条件而改变
相关课件
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度示范课课件ppt,共24页。PPT课件主要包含了S18O2,S16O18O,学习目标等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度备课课件ppt,共22页。PPT课件主要包含了看我的化学新魔术,S18O2,S16O18O,可逆反应,化学平衡状态等内容,欢迎下载使用。
这是一份2021学年第六章 化学反应与能量第二节 化学反应的速率与限度说课课件ppt,共21页。PPT课件主要包含了思考与交流,炼铁高炉尾气之谜,可逆反应,典型的可逆反应有,可逆反应的特点,交流与讨论,教师小结,反应开始时,反应进行中,反应到一定时间等内容,欢迎下载使用。










