
人教版 (2019)选择性必修1第三节 金属的腐蚀与防护导学案
展开
这是一份人教版 (2019)选择性必修1第三节 金属的腐蚀与防护导学案,共10页。学案主要包含了问题探究,知识归纳总结,易错提醒等内容,欢迎下载使用。
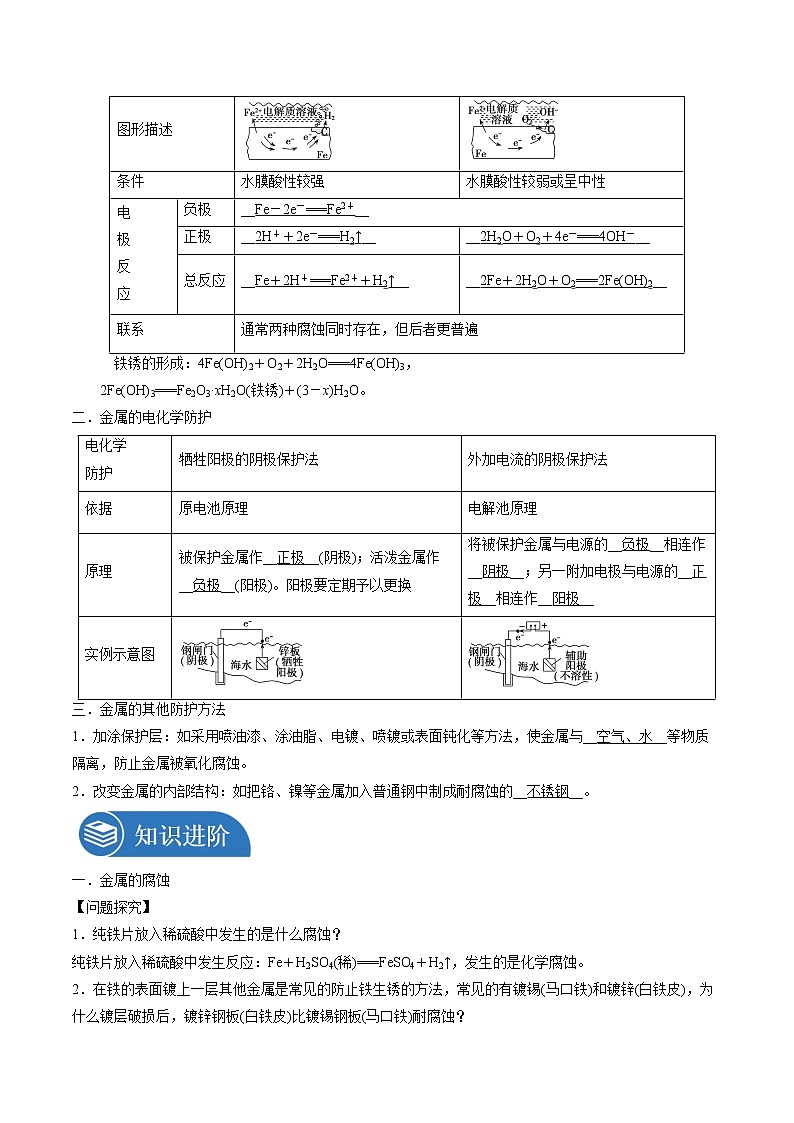
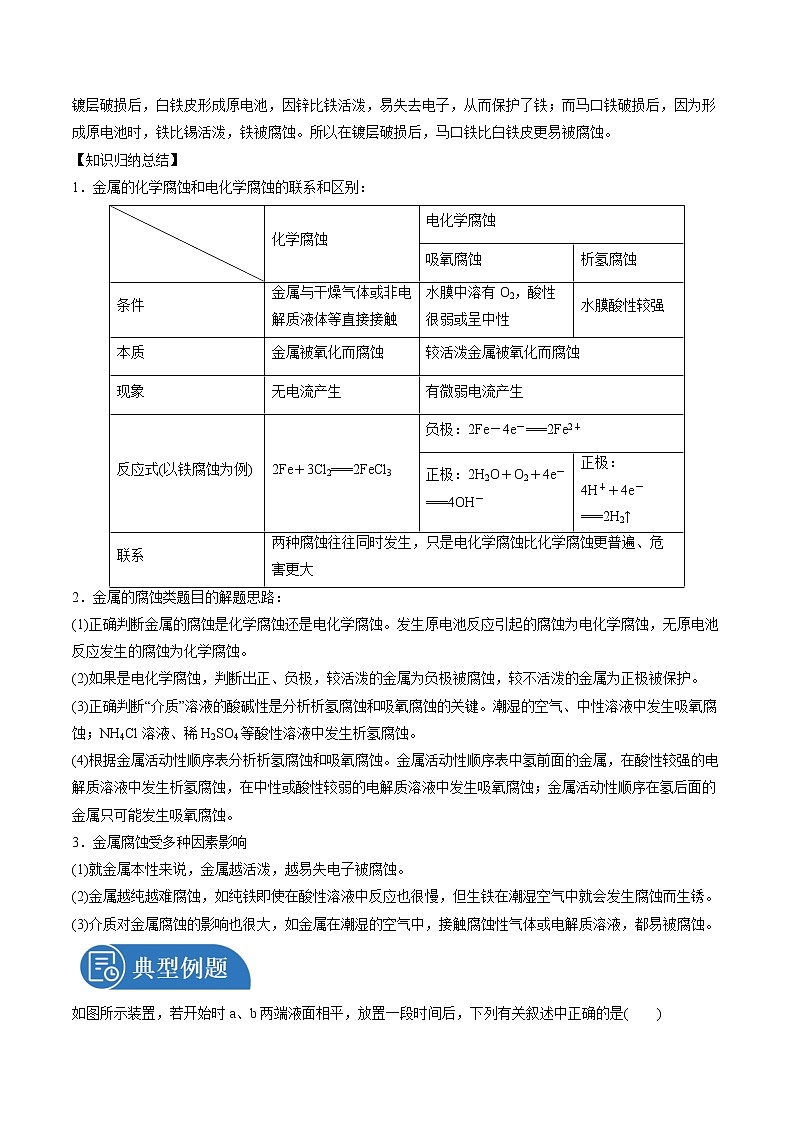
第四章化学反应与电能第三节金属的腐蚀与防护1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害。2.了解防止金属腐蚀的措施。1.通过实验科学探究金属腐蚀的本质及其原因,培养科学探究与创新意识。2.通过认识金属腐蚀产生的危害和影响,培养科学态度和社会责任意识。一.金属的电化学腐蚀1.金属腐蚀:金属原子失去电子变成金属阳离子,金属发生氧化反应。2.化学腐蚀和电化学腐蚀:类型化学腐蚀电化学腐蚀条件金属与接触到的物质直接反应不纯金属接触到电解质溶液发生原电池反应本质M-ne-===Mn+M-ne-===Mn+现象金属被腐蚀较活泼金属被腐蚀区别无电流产生有微弱电流产生联系电化学腐蚀比化学腐蚀普遍得多,腐蚀速率更快,危害也更严重3.钢铁的电化学腐蚀:(1)实质在钢铁表面形成无数微小原电池(2)析氢腐蚀和吸氧腐蚀 类别项目 析氢腐蚀吸氧腐蚀图形描述条件水膜酸性较强水膜酸性较弱或呈中性电极反应负极__Fe-2e-===Fe2+__正极__2H++2e-===H2↑____2H2O+O2+4e-===4OH-__总反应__Fe+2H+===Fe2++H2↑____2Fe+2H2O+O2===2Fe(OH)2__联系通常两种腐蚀同时存在,但后者更普遍 铁锈的形成:4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3·xH2O(铁锈)+(3-x)H2O。二.金属的电化学防护电化学防护牺牲阳极的阴极保护法外加电流的阴极保护法依据原电池原理电解池原理原理被保护金属作__正极__(阴极);活泼金属作__负极__(阳极)。阳极要定期予以更换将被保护金属与电源的__负极__相连作__阴极__;另一附加电极与电源的__正极__相连作__阳极__实例示意图三.金属的其他防护方法1.加涂保护层:如采用喷油漆、涂油脂、电镀、喷镀或表面钝化等方法,使金属与__空气、水__等物质隔离,防止金属被氧化腐蚀。2.改变金属的内部结构:如把铬、镍等金属加入普通钢中制成耐腐蚀的__不锈钢__。一.金属的腐蚀【问题探究】1.纯铁片放入稀硫酸中发生的是什么腐蚀?纯铁片放入稀硫酸中发生反应:Fe+H2SO4(稀)===FeSO4+H2↑,发生的是化学腐蚀。2.在铁的表面镀上一层其他金属是常见的防止铁生锈的方法,常见的有镀锡(马口铁)和镀锌(白铁皮),为什么镀层破损后,镀锌钢板(白铁皮)比镀锡钢板(马口铁)耐腐蚀?镀层破损后,白铁皮形成原电池,因锌比铁活泼,易失去电子,从而保护了铁;而马口铁破损后,因为形成原电池时,铁比锡活泼,铁被腐蚀。所以在镀层破损后,马口铁比白铁皮更易被腐蚀。【知识归纳总结】1.金属的化学腐蚀和电化学腐蚀的联系和区别: 化学腐蚀电化学腐蚀吸氧腐蚀析氢腐蚀条件金属与干燥气体或非电解质液体等直接接触水膜中溶有O2,酸性很弱或呈中性水膜酸性较强本质金属被氧化而腐蚀较活泼金属被氧化而腐蚀现象无电流产生有微弱电流产生反应式(以铁腐蚀为例)2Fe+3Cl2===2FeCl3负极:2Fe-4e-===2Fe2+正极:2H2O+O2+4e-===4OH-正极:4H++4e-===2H2↑联系两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍、危害更大2.金属的腐蚀类题目的解题思路:(1)正确判断金属的腐蚀是化学腐蚀还是电化学腐蚀。发生原电池反应引起的腐蚀为电化学腐蚀,无原电池反应发生的腐蚀为化学腐蚀。(2)如果是电化学腐蚀,判断出正、负极,较活泼的金属为负极被腐蚀,较不活泼的金属为正极被保护。(3)正确判断“介质”溶液的酸碱性是分析析氢腐蚀和吸氧腐蚀的关键。潮湿的空气、中性溶液中发生吸氧腐蚀;NH4Cl溶液、稀H2SO4等酸性溶液中发生析氢腐蚀。(4)根据金属活动性顺序表分析析氢腐蚀和吸氧腐蚀。金属活动性顺序表中氢前面的金属,在酸性较强的电解质溶液中发生析氢腐蚀,在中性或酸性较弱的电解质溶液中发生吸氧腐蚀;金属活动性顺序在氢后面的金属只可能发生吸氧腐蚀。3.金属腐蚀受多种因素影响(1)就金属本性来说,金属越活泼,越易失电子被腐蚀。(2)金属越纯越难腐蚀,如纯铁即使在酸性溶液中反应也很慢,但生铁在潮湿空气中就会发生腐蚀而生锈。(3)介质对金属腐蚀的影响也很大,如金属在潮湿的空气中,接触腐蚀性气体或电解质溶液,都易被腐蚀。如图所示装置,若开始时a、b两端液面相平,放置一段时间后,下列有关叙述中正确的是( )A.铁丝在两处的腐蚀速率:a>bB.a、b两端相同的电极反应式为Fe-3e-===Fe3+C.一段时间后,a端液面高于b端液面D.a处总反应为Fe+2H2O===Fe(OH)2+H2↑【答案】C【解析】左边试管中,生铁发生吸氧腐蚀,右边试管中,生铁发生析氢腐蚀。A项,生铁发生析氢腐蚀的速率比吸氧腐蚀的速率大,错误;B项,a处负极上铁失电子,正极上氧气得电子,b处负极上铁失电子,正极上氢离子得电子,所以a、b两处相同的电极反应式为Fe-2e-===Fe2+,错误;C项,a处发生吸氧腐蚀,b处发生析氢腐蚀,一段时间后,a处气体压强减小,b处气体压强增大,导致溶液从b处向a处移动,所以a处液面高于b处液面,正确;D项,a处发生吸氧腐蚀,其总反应为2Fe+O2+2H2O===2Fe(OH)2,错误。〔变式训练1〕下列说法不正确的是( )A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀B.原电池反应是导致金属腐蚀的主要原因,但人们可以利用原电池原理来减缓金属的腐蚀C.钢铁电化学腐蚀两种类型主要区别在于水膜的酸性不同,正极反应不同D.无论哪种类型的腐蚀,其实质都是金属被氧化【答案】A【解析】不锈钢和铝合金等耐腐蚀,A项错误;金属作原电池正极时被保护,B项正确;水膜酸性较强时,铁主要发生析氢腐蚀,水膜中性或弱酸性时发生吸氧腐蚀,C项正确;金属被腐蚀的实质是金属失电子,被氧化,D项正确。二.金属的防护【问题探究】1.为保护地下钢管不被腐蚀,可采取的电化学保护措施有哪些?将钢管与锌板相连,或将钢管与直流电源负极相连。2.铁制品在潮湿的环境中和在干燥环境中哪种环境更易生锈?其原因是什么?潮湿环境中更易生锈;铁制品中含有杂质碳,在潮湿环境下的电解质溶液中构成原电池,加快了铁被氧化的反应速率。【知识归纳总结】1.常见金属的防护措施:2.金属腐蚀快慢的判断方法:(1)对同一种金属来说,腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液。(2)活动性不同的两金属:活动性差别越大,活动性强的金属腐蚀越快。(3)对同一种电解质溶液来说:电解质溶液浓度越大,腐蚀越快,且氧化剂的浓度越高,氧化性越强,腐蚀越快。(4)不同原理引起的腐蚀的速率:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。(5)从防腐措施方面分析腐蚀的快慢:外加电流的保护法防腐<牺牲阳极的保护法防腐<有一般防护条件的防腐<无防护条件的防腐。【易错提醒】 不要因为“阳极”“阴极”而把牺牲阳极的保护法的工作原理当作电解原理。下列说法不正确的是( )A.一般来说,不纯的金属与电解质溶液接触时,会发生原电池反应B.溶液中Fe2+可以用K3[Fe(CN)6]溶液来检测C.铁锈覆盖在钢铁表面,阻止钢铁继续腐蚀D.在船身上装锌块来避免船体遭受腐蚀【答案】C【解析】不纯的金属,杂质和金属构成原电池的两个电极,与电解质溶液接触时,会发生原电池反应,故A正确;溶液中Fe2+遇到K3[Fe(CN)6]溶液可以产生蓝色沉淀,故B正确;铁锈的结构比较疏松,无法隔绝空气中的水分和氧气,所以无法阻止钢铁继续腐蚀,故C错误;在船身上装锌块,锌比较活泼,先被腐蚀,是利用原电池原理来避免船体遭受腐蚀,故D正确。据最近报道,中国生产的首艘国产航母已经下水。为保护航母、延长服役寿命可采用两种电化学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确的是( D )A.方法1叫外加电流的保护法B.方法2叫牺牲阳极的保护法C.方法1中金属块可能是锌、锡和铜D.方法2中舰体连接电源的负极【答案】D【解析】舰体上镶嵌活泼性比铁强的金属,如锌,该方法为牺牲阳极保护法,A、C错误;舰体与直流电源的负极相连,该法为外加电流保护法,B错,D正确,故选D。1.(2021·贵州·高二学业考试)下列不能有效防止钢铁锈蚀的措施是A.将钢铁与锌板相连 B.将钢铁置于潮湿的空气中C.在钢铁表面喷油漆 D.将钢铁与直流电源负极相连【答案】B【解析】A.由于金属活动性Zn>Fe,所以在钢铁中加入铬制成不锈钢,首先被腐蚀的是活动性强的Zn,Fe就得到了保护,所以能有效防止钢铁腐蚀,A不符合题意;B.钢铁只与潮湿空气中,会加速钢铁生锈,不能有效防止钢铁腐蚀,B符合题意;C.在钢铁表面喷涂油漆,起到隔绝空气和水作用,能有效防止钢铁腐蚀,C不符合题意;D.钢铁与电源的负极相连,钢铁为阴极,外加电流的阴极保护法,钢铁受到保护,D不符合题意;故选B。2.(2021·云南省玉溪第一中学高二期中)2017年4月26日,中国第一艘国产001A型航母顺利建成下水,有盐分的海水和空气会对船体造成腐蚀,因此船体的防腐处理非常重要。下列关于金属腐蚀和防腐的说法不正确的是A.可以在船舶外壳装上锌块,用牺牲阳极的阴极保护法防止金属腐蚀B.海上舰艇的腐蚀主要为金属的析氢腐蚀C.刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀D.外加电流,将需要保护的金属做阴极,可以起到保护金属的作用【答案】B【解析】A.锌比铁活泼,在船舶外壳装上锌块,形成原电池,锌为负极被氧化,该方法为牺牲阳极的阴极保护法防止金属腐蚀,A正确;B.海水显弱碱性,主要发生吸氧腐蚀,B错误;C.金属被腐蚀的过程即金属被氧气氧化的过程,且有水存在时易发生电化学腐蚀,所以刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀,C正确;D.电解池中阴极得电子被还原,外加电流,将需要保护的金属做阴极,可以防止金属被氧化,起到保护金属的作用,D正确;综上所述答案为B。3.(2021·河南南阳·高二期中)将金属M连接在钢铁设施表面构成原电池,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是A.钢铁设施上的电极反应式为 B.电子流向:金属M→水体→钢铁设施表面C.M的金属性比Fe的金属性强 D.钢铁设施在河水中的腐蚀速率比在海水中的快【答案】C【解析】A.由分析可知,钢铁设施中的铁做正极,水中的氧气在正极发生还原反应,电极反应式为O2+4e—+2H2O=4OH—,故A错误;B.原电池工作时,电子流向为:金属M→导线→钢铁设施表面,故B错误;C.由分析可知,金属M的金属性强于铁,故C正确;D.海水中电解质的浓度高于河水,导电性强于河水,则钢铁设施在海水中的腐蚀速率比在河水中的快,故D错误;故选C。4.(2021·福建省将乐县第一中学高二月考)如图各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是A.③②④① B.④②①③ C.②①③④ D.④②③①【答案】B【解析】根据图知,②、③装置是原电池,在②中,金属铁做负极,③中金属铁作正极被保护,做负极的腐蚀速率快,所以②>③,④装置是电解池,其中金属铁为阳极,加快腐蚀,腐蚀最快,所以腐蚀速率是:④>②>①>③。故选B。5.(2021·河南南阳·高二期中)下列与金属腐蚀有关的说法正确的是A.图a插入海水中的铁棒(含碳量为10.8%)越靠近烧杯底部发生电化学腐蚀就越严重B.图b开关由N改置于M时,金属铁的腐蚀速率减小C.图c为牺牲阳极的阴极保护法,钢闸门应与外接电源的负极相连D.图d在反应过程中能产生氢气【答案】D【解析】A.插入海水中的铁棒发生吸氧腐蚀时,接近水面部分氧气的浓度大,腐蚀程度就越严重,故A错误;B.当开关由N改置于M时,金属性强的铁做原电池的负极,腐蚀速率增大,故B错误;C.由图可知,该装置为外加直流电源的保护法,钢闸门应与外接电源的负极相连,故C错误;D.由图可知,铁丝开始阶段铁丝发生吸氧腐蚀,使左侧氧气物质的量减少,压强减小导致液面升高,铁丝与稀硫酸接触后发生析氢腐蚀,会有氢气生成,故D正确;故选D。6.(2021·山东·菏泽一中高二期中)下列事实不能用原电池原理解释的是A.白铁(镀锌)制品比一般铁器耐腐蚀B.铁片、铝片在冷的浓硫酸中钝化C.工程施工队在铁制水管外刷一层“银粉”D.纯锌与稀硫酸反应时,滴入少量溶液后反应速率加快【答案】B【解析】A.白铁中铁和锌组成原电池,由金属活泼性Zn>Fe,则Fe做正极被保护,所以白铁(镀锌)制品比一般铁器耐腐蚀,A不选;B.铁、铝常温下与冷的浓硫酸反应生成致密的氧化膜而钝化,不能用原电池原理解释,B选;C.铁外刷一层“银粉”,阻止与氧气接触,破坏了原电池的构成条件,保护铁不被腐蚀,C不选;D.锌与少量溶液反应置换单质Cu,形成Zn-Cu原电池,可加快反应速率,D不选;故选:B。7.(2021·山东·胶州市教育体育局教学研究室高二期中)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(一种厌氧微生物,适宜pH为7~8)的作用下,能被硫酸根离子腐蚀,原理如图。下列有关说法正确的是A.腐蚀过程中,土壤酸性逐渐增强B.输送暖气铁管道温度越高,越易发生此类腐蚀C.正极反应为D.管道壁镶嵌锌块或锡块都可保护管道不易被腐蚀【答案】C【解析】铁管道腐蚀过程中铁做负极,电极反应式为:Fe-2e-=Fe2+,正极是硫酸根离子发生还原反应,由题意可知为碱性环境,故正极电极反应式为:;【解析】A.由分析知,正极反应生成OH-,土壤酸性逐渐减弱,故A错误;B.正极的腐蚀需要硫酸盐还原菌这种微生物,若温度过高,使微生物失活,则腐蚀程度会减弱,故B错误;C.正极是硫酸根离子发生还原反应,生成硫氢根离子,所以电极反应式为:,故C正确;D.铁比锡活泼,管道壁镶嵌锡块,铁做负极,加快管道腐蚀,故D错误;故选:C。8.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。(1)如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵溶液(显酸性)和食盐水,各加入生铁块,放置一段时间均被腐蚀。①红墨水柱两边的液面变为左低右高,则_______(填“a”或“b”)试管内盛有食盐水。②a试管中铁发生的是_______(填“析氢”或“吸氧”)腐蚀,生铁中碳上发生的电极反应式为_______。(2)如图两个图都是金属防护的例子。①为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_______(填字母),此方法叫做_______保护法。A.铜B.钠C.锌D.石墨②图乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的_______(填“正”或“负”)极。③以上两种方法中,_______填“甲”或“乙”)方法能使铁闸门保护得更好。【答案】(1)b析氢(2)C牺牲阳极的阴极负乙【解析】(1)①红墨水柱两边的液面变为左低右高,则a发生析氢腐蚀,a中盛有氯化铵溶液,b发生吸氧腐蚀,b中盛有食盐水,故答案为b。②a试管中铁发生的是析氢腐蚀,生铁中碳为正极,正极上发生还原反应,故发生的电极反应式为。b试管中铁发生的是吸氧腐蚀,生铁中碳为正极,发生的电极反应式O2+2H2O+4e-=4OH-;铁为负极,电极反应式为:Fe-2e-=Fe2+。(2)①为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,钠能够与水反应,不能做电极材料,所以选锌,此方法叫做牺牲阳极的阴极保护法,故答案为C;牺牲阳极的阴极;②电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极,故答案为负。③因为电解池的保护比原电池保护更好,所以方法乙能使铁闸门保护得更好;故答案为乙。
相关学案
这是一份化学人教版 (2019)第三节 金属的腐蚀与防护精品导学案及答案,共2页。学案主要包含了金属的腐蚀,金属的防护等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护导学案及答案,共4页。学案主要包含了学习目标,重点难点,学习过程,实验目的,实验用品,实验方案,实验现象,实验结论等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护导学案,文件包含思维导图人教版高中化学选修一《43金属的腐蚀与防护》同步学习思维导图+学练解析版docx、思维导图人教版高中化学选修一《43金属的腐蚀与防护》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共15页, 欢迎下载使用。










