




所属成套资源:新人教版化学选择性必修2课件PPT全套
人教版 (2019)选择性必修2第四节 配合物与超分子评课ppt课件
展开
这是一份人教版 (2019)选择性必修2第四节 配合物与超分子评课ppt课件,共29页。PPT课件主要包含了常见的离子晶体,离子晶体的特性,晶胞类型,Cs+,Cl-,CsCl晶胞,3CaF2型晶胞,晶格能等内容,欢迎下载使用。
第四节 离 子 晶 体
⑴特征:无方向性和饱和性
⑵影响离子键强弱的因素:阴、阳离子半径越小,电荷数越多,离子键越强
强碱、活泼金属氧化物、绝大部分盐。
5、离子晶体中的配位数
指一个离子周围最邻近的异电性离子的数目
(1)离子晶体中无单个分子存在. 如: NaCl不表示分子(2)熔沸点较高,硬度较大,难挥发难压缩。(3)晶体状态不导电,水溶液或者熔融状态下均导电。(4)大多数离子晶体易溶于极性溶剂水,难溶于非极性溶剂
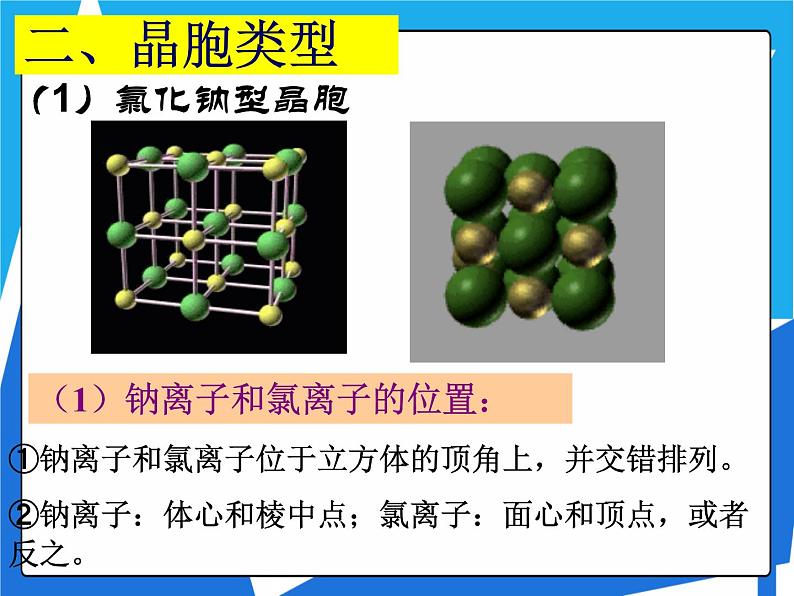
(1)钠离子和氯离子的位置:
①钠离子和氯离子位于立方体的顶角上,并交错排列。②钠离子:体心和棱中点;氯离子:面心和顶点,或者反之。
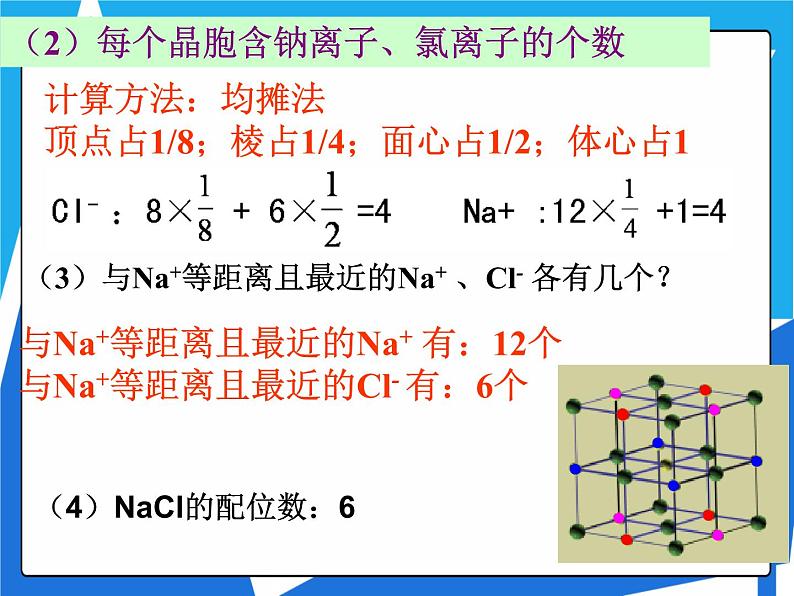
(3)与Na+等距离且最近的Na+ 、Cl- 各有几个?
计算方法:均摊法 顶点占1/8;棱占1/4;面心占1/2;体心占1
(2)每个晶胞含钠离子、氯离子的个数
与Na+等距离且最近的Na+ 有:12个与Na+等距离且最近的Cl- 有:6个
(4)NaCl的配位数:6
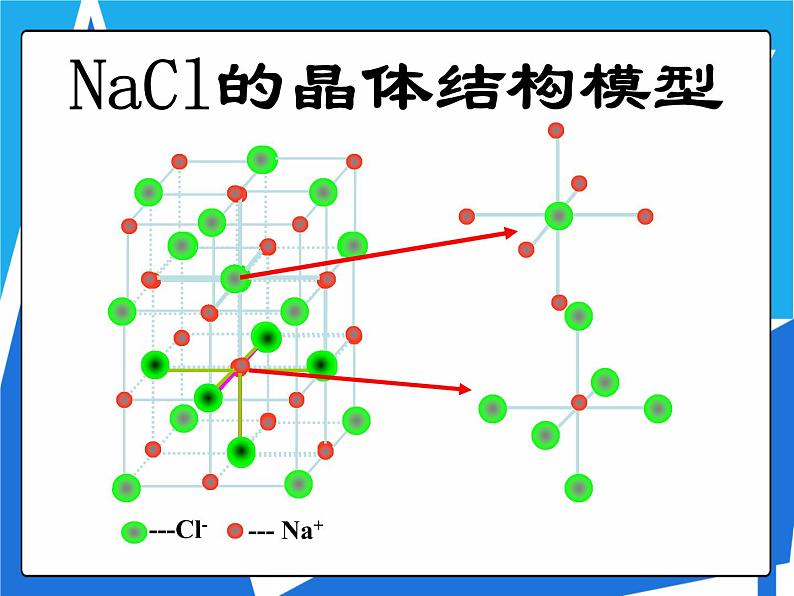
NaCl的晶体结构模型
NaCl晶体中阴、阳离子配位数
(2) CsCl 型晶胞
CsCl的晶体结构示意图
(1)铯离子和氯离子的位置:
铯离子:体心氯离子:顶点;或者反之。
(2)每个晶胞含铯离子、氯离子的个数
铯离子:1个 ;氯离子:1个
(3)与铯离子等距离且最近的铯离子、氯离子各有几个?
铯离子:6个 ;氯离子:8个
在CsCl晶体中每个Cs+周围同时吸引着8个Cl-每个Cl-周围同时吸引着8个Cs+
每个Cs+周围与它最近且距离相等的Cs+共有___个
每个Cl-周围与它最近且距离相等的Cl- 共有____个
③一个CaF2晶胞中含:
Ca2+在顶点和面心,F-在体内。
4个Ca2+和8个F-
③一个ZnS晶胞中含:
4个阳离子和4个阴离子
[阅读思考] 碳酸盐热分解的实质是什么? 表3-7的有关数值说明了什么?
组成碳酸盐中阳离子的金属的金属性越弱,金属阳离子的半径越小,碳酸盐的热稳定性越差,反之越好。
1.定义:气态离子形成1摩离子晶体时释放的能量。
仔细阅读表3—8,分析晶格能的大小与离子晶体的熔点有什么关系?离子晶体的晶格能与哪些因素有关?
2.晶格能的大小与阴、阳离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比。
简言之,晶格能的大小与离子带电量成正比,与离子半径成反比.
3.规律:晶格能越大形成的离子晶体越稳定;(离子键越强)熔点越高;硬度越大。
实质:一般情况下,离子晶体中阴、阳离子半径越小,电荷数越多,离子键越强,熔沸点越高,硬度越大。
请思考:NaF,NaCl,NaBr,NaI晶体其熔沸点的高低顺序?
NaF>NaCl>NaBr>NaI
各类型离子晶体晶胞的比较
KBr AgCl、MgO、CaS、BaSe
ZnS、AgI、 BeO
CsCl、CsBr、CsI、TlCl
碱土金属卤化物、碱金属氧化物。
【总结归纳】物质的熔点与晶体类型的关系1、若晶体类型不同,一般情况下:原子晶体>离子晶体>分子晶体。2、若晶体类型相同,则有:⑴离子晶体中,结构相似时,离子半径越小,离子电荷越高,晶格能越大,离子键就越强,熔点就越高。⑵原子晶体中,结构相似时,原子半径越小,共价键键长越短,键能越大,熔点越高。⑶分子晶体中(不含氢键时),分子组成和结构相似时,相对分子质量越大,范德华力就越强,熔点就越高。⑷金属晶体中,原子半径越小,价电子越多,金属键就越强,熔点就越高。合金的熔点比它的各成分金属的熔点低。
范德华力(有的有氢键)
固态不导电,熔融状态或水溶液中导电
固态和熔融状态下不导电
一般导电性差 (有的导电)
练习1、判断下列离子晶体熔点的高低。(1) NaF NaCl NaBr (2) MgO SrS (3) MgO KCl
2.下列物质的晶体,按其熔点由低到高的排列 顺序正确的是( ) A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2 C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO 3.比较下列离子晶体熔点的高低。 ⑴.MgO、KCl ⑵.MgO、SrS ⑶.NaF、NaCl、NaBr
相关课件
这是一份化学选择性必修2第3章 晶体结构与性质3.2离子晶体完美版ppt课件,文件包含32离子晶体教学课件pptx、32离子晶体分层作业原卷版docx、32离子晶体分层作业解析版docx等3份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
这是一份高中第三节 金属晶体与离子晶体精品习题ppt课件,共22页。PPT课件主要包含了离子键,离子晶体,离子晶体的性质,氯化钠晶体,CsCl晶体,归纳小结等内容,欢迎下载使用。
这是一份人教版 (新课标)选修5 有机化学基础第四节 有机合成说课课件ppt,共24页。PPT课件主要包含了什么是有机合成,消除和保护,有机合成,维生素C,水杨酸,乙酸酐,乙酰水杨酸,卤代烃,①引入碳碳双键,②引入卤原子X等内容,欢迎下载使用。










