
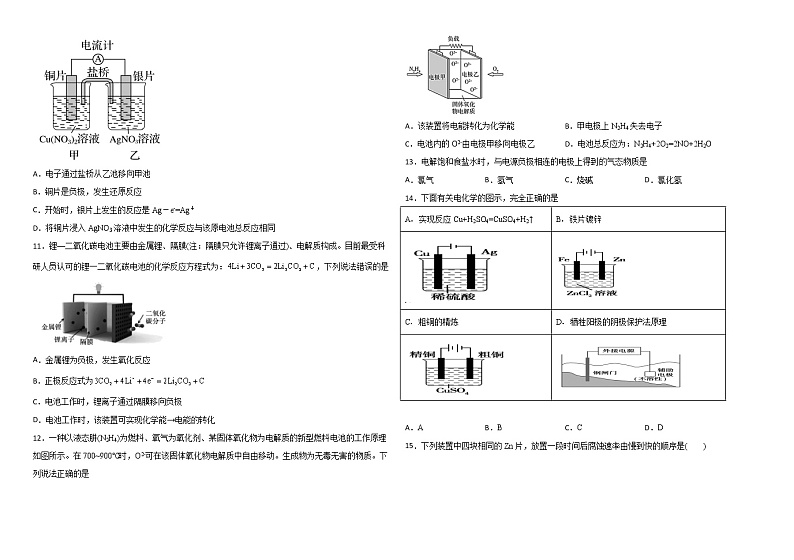
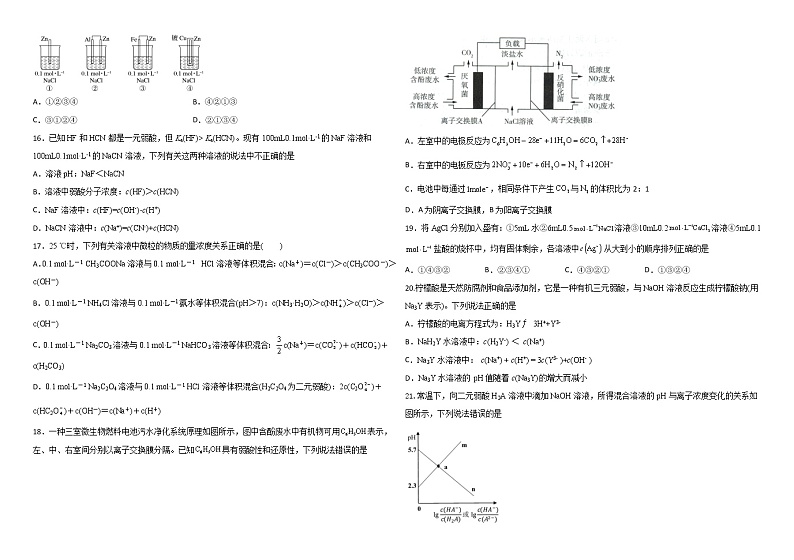
黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高二10月月考化学试题
展开
这是一份黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高二10月月考化学试题,共7页。试卷主要包含了下列说法正确的是,已知如下物质的溶度积常数,铅蓄电池是最早使用的充电电池等内容,欢迎下载使用。
选择题(每小题2分,共42分,每小题只有一个正确答案)
1.下列物质的水溶液因水解而呈碱性的是
A.Na2CO3B.AlCl3C.Ca(OH)2D.NaNO3
2.在K2S溶液中,c(K+)与c(S2-)的关系正确的是
A.c(K+)=c(S2-)B.c(K+):c(S2-)=2:1
C.c(K+):c(S2-)>2:1D.c(K+):c(S2-) Ka(HCN)。现有100mL0.1ml·L-1的NaF溶液和100mL0.1ml·L-1的NaCN溶液,下列有关这两种溶液的说法中不正确的是
A.溶液pH:NaF<NaCN
B.溶液中弱酸分子浓度:c(HF)>c(HCN)
C.NaF溶液中:c(HF)=c(OH-)-c(H+)
D.NaCN溶液中:c(Na+)=c(CN-)+c(HCN)
17.25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 ml·L-1 CH3COONa溶液与0.1 ml·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 ml·L-1 NH4Cl溶液与0.1 ml·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH)>c(Cl-)>c(OH-)
C.0.1 ml·L-1 Na2CO3溶液与0.1 ml·L-1 NaHCO3溶液等体积混合:c(Na+)=c(CO)+c(HCO)+c(H2CO3)
D.0.1 ml·L-1 Na2C2O4溶液与0.1 ml·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O)+c(HC2O)+c(OH-)=c(Na+)+c(H+)
18.一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用表示,左、中、右室间分别以离子交换膜分隔。已知具有弱酸性和还原性,下列说法错误的是
A.左室中的电极反应为
B.右室中的电板反应为
C.电池中每通过,相同条件下产生与的体积比为2:1
D.A为阴离子交换膜,B为阳离子交换膜
19.将AgCl分别加入盛有:①5mL水②6mL0.5溶液③10mL0.2溶液④5mL0.1盐酸的烧杯中,均有固体剩余,各溶液中从大到小的顺序排列正确的是
A.①④③②B.②③④①C.④③②①D.①③②④
20.柠檬酸是天然防腐剂和食品添加剂,它是一种有机三元弱酸,与NaOH溶液反应生成柠檬酸钠(用Na3Y表示)。下列说法正确的是
A.柠檬酸的电离方程式为:H3Y3H++Y3-
B.NaH2Y水溶液中:c(H2Y-) < c(Na+)
C.Na3Y水溶液中: c(Na+) + c(H+) = 3c(Y3- )+c(OH- )
D.Na3Y水溶液的 pH值随着c(Na3Y)的增大而减小
21.常温下,向二元弱酸H2A溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列说法错误的是
A.曲线n表示pH与lg
B.Ka1(H2A)=10-2.3
C.交点a的溶液中:c(H2A)>c(A2-)
D.NaHA溶液中:c(HA-)>c(A2-)>c(H2A)
二.填空题(共58分)
22.电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为___________。
② Y电极上的电极反应式为_________
③该反应的总反应方程式是:_________
(2)如要用电镀方法铁上镀铜,电解液a选用CuSO4溶液,则
① X电极的材料是_______,电极反应式是__________。
② Y电极的材料是_______,电极反应式是__________。
23.化学平衡移动原理同样也适用于其它平衡,已知在氨水中存在下列平衡:
NH3·H2O NH4++OH-
(1)向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),
c(OH-)____(填“增大”或“减小”或“不变”)。
(2)向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”), c(NH4+)____(填“增大”或“减小”或“不变”)
(3)常温下,将pH=8的氨水和pH=6的盐酸等体积混合,混合后C(H+)___c(OH-)(填“大于”.“小于”或“等于”)
(4)用物质的量分别为的HCN和NaCN配成1L混合溶液,已知其中小于,则溶液中c(H+) _____. c(OH-)(填“大于”.“小于”或“等于”),_____.ml/L
(5)室温下将aml/L的HCN与0.1ml/L的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显___________性(填“酸”“碱”“中”),用a 的代数式表示HCN的电离平衡常数Ka= ___________
24.常温下,有浓度均为的下列4种溶液:
①溶液 ②溶液 ③溶液 ④溶液
(1)这4种溶液由大到小的顺序是________(填序号),其中②由水电离的浓度为________。
(2)①中各离子浓度由大到小的顺序是________。
(3)④的水解平衡常数________。
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③________④(填“”“”或“”)。
(5)时,测得和的混合溶液的,则约为________(保留1位有效数字)。向溶液中通入少量,则发生反应的离子方程式为________________。
25.化学电源在日常生活和工业生产中有着重要的应用。
Ⅰ.如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极的电极反应式为________________________________。
(2)C极的电极反应式为________________________________________。
(3)若有2.24 L(标准状况下)氧气参加反应,则乙装置中铁极上生成的气体体积为________L(标准状况下);丙装置中阴极析出铜的质量为________g。
Ⅱ.“新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示,则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为___。
参考答案
1.A2.C3.C4.A5.D6.B7.D8.D9.C10.D11.C12.B13.B14.A
15.B16.B17.A18.C19.A20.B21.C
22. 2H++2e−=H2↑或2H2O+2e- = H2↑ + 2OH- 2Cl−−2e−=Cl2↑ 铁 Cu2++2e−═Cu 铜 Cu−2e−═Cu2+
23.(1) 向左 减小
(2) 向右 增大
(3)小于
(4) < 0.2ml/L
(5) 中
24. ②>①>④>③ (不写单位不扣分) 0.02
25.CH4-8e‒+10OH‒=+7H2O 2Cl‒-2e‒=Cl2↑ 4.48 12.8
负 N2O4+2HNO3-2e-=2N2O5+2H+
A.实现反应Cu+H2SO4=CuSO4+H2↑
B.铁片镀锌
C.粗铜的精炼
D.牺牲阳极的阴极保护法原理
相关试卷
这是一份黑龙江省哈尔滨师范大学青冈实验中学2023-2024学年高二上学期期中考试化学试题含答案,共7页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份黑龙江省哈尔滨师范大学青冈实验中学校2023-2024学年高三上学期12月份考试化学试题Word版含答案,文件包含黑龙江省哈尔滨师范大学青冈实验中学校2023-2024学年高三上学期12月份考试化学试题Word版docx、高三化学试题答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
这是一份2021-2022学年黑龙江省哈尔滨师范大学附属中学高二上学期开学考试化学试题 PDF版,共9页。








