




高中化学第2节 共价键与分子的空间结构说课ppt课件
展开1.了解常见分子的空间构型。2.理解杂化轨道理论的主要内容,并能用杂化轨道理论解释或预测某 些分子或离子的空间构型。
二、典型分子的空间结构
1.杂化轨道理论的提出研究证实,甲烷分子空间结构为 ,键角为 ,而根据价键理论,碳原子的价电子中只有两个未成对电子。若碳原子与氢原子结合,应形成 ,而不是CH4;即使碳原子的一个2s轨道受外界条件影响跃迁到2p空轨道,使碳原子具有四个未成对电子,但这四个价电子的原子轨道是3个相互垂直的 轨道与1个球形的 轨道,它与四个氢原子形成的分子也不应当具有规则的正四面体形结构。为了解决这一矛盾,鲍林提出了 理论。
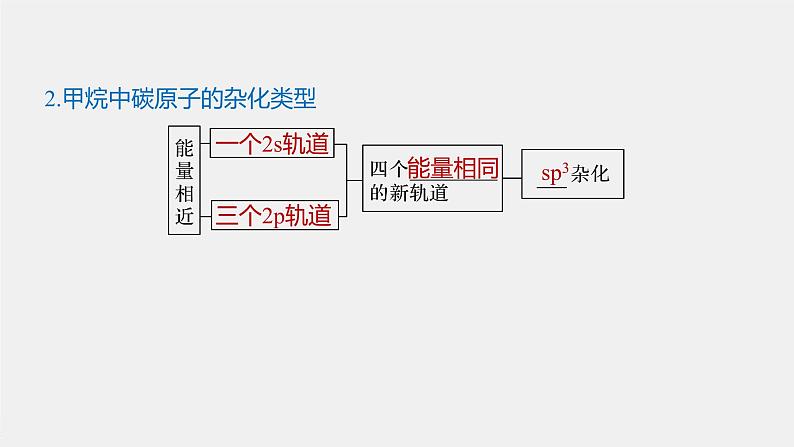
2.甲烷中碳原子的杂化类型
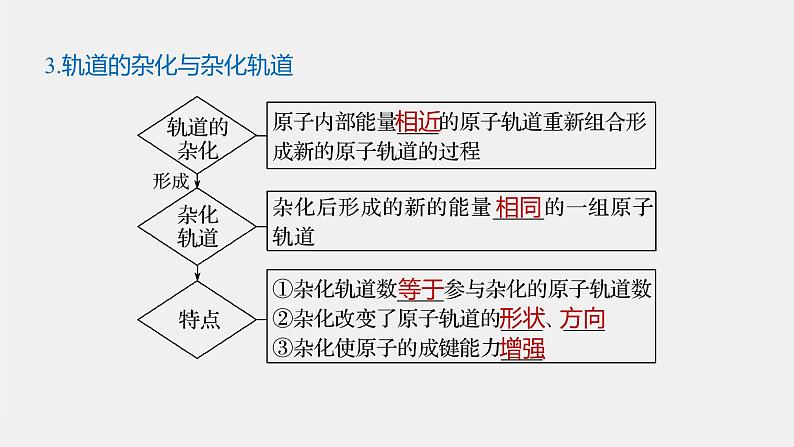
3.轨道的杂化与杂化轨道
(1)任意能级的s轨道和p轨道都可以形成杂化轨道( )(2)有多少个原子轨道发生杂化就形成多少个杂化轨道( )(3)杂化轨道能量相同( )
1.能正确表示CH4中碳原子的成键方式的示意图为
解析 碳原子的2s轨道与2p轨道形成4个等性的杂化轨道,因此碳原子4个价电子分占在4个sp3杂化轨道上,且自旋状态相同。
2.ns轨道和np轨道杂化的类型不可能有A.sp杂化 B.sp2杂化C.sp3杂化 D.sp4杂化
解析 p能级只有3个轨道,不可能有sp4杂化。
杂化轨道理论四要点(1)能量相近原子在成键时,同一原子中能量相近的原子轨道可重新组合成杂化轨道。(2)数目不变形成的杂化轨道数与参与杂化的原子轨道数相等。(3)成键能力增强杂化改变原有轨道的形状和伸展方向,使原子形成的共价键更牢固。(4)排斥力最小杂化轨道为使相互间的排斥力最小,故在空间取最大夹角分布,不同的杂化轨道伸展方向不同。
1.CH4分子的空间结构CH4分子中碳原子的杂化过程如下图:
四个杂化轨道的未成对电子与四个氢原子的1s电子配对形成 键。因为四个共价键的键长、键角相同,所以CH4分子的空间结构为 。
2.乙烯分子的空间结构乙烯分子中碳原子的杂化过程如下图:
乙烯分子中每个碳原子的杂化轨道中含一个未成对电子,两个碳原子各用一个sp2杂化轨道形成一个 键,每个碳原子的另外两个sp2杂化轨道分别与两个氢原子的1s轨道形成一个 键,剩下的一个未参与杂化的2p轨道以 的方式重叠,形成一个 键。
3.乙炔分子的空间结构乙炔分子中碳原子的杂化过程如下图:
乙炔分子中碳原子的杂化轨道中各含一个未成对电子,两个碳原子各用一个sp杂化轨道形成一个 键,再用另外一个sp杂化轨道分别与氢原子的1s轨道形成一个 键,剩下的两个未参与杂化的2p轨道以 的方式重叠,形成 个 键。
4.苯分子的空间结构与大π键
5.NH3分子的空间结构
6.杂化轨道类型与分子空间结构的关系(1)当杂化轨道全部用于形成σ键时
(2)当杂化轨道中有未参与成键的孤电子对时,由于孤电子对的排斥作用,会使分子的空间结构与杂化轨道的形状不同,如H2O和NH3,O与N的杂化类型都为 杂化,孤电子对数分别为 、 ,分子空间结构分别为 、 。
(1)第ⅠA族元素成键时不可能有杂化轨道( )(2)孤电子对有可能参加杂化( )(3)杂化轨道只能用来形成σ键( )
1.NH3分子空间结构是三角锥形,而CH4是正四面体形,这是因为A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3 杂化B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道C.NH3分子中有一对未成键的孤对电子,它对成键电子对的排斥作用较强D.NH3分子中有3个σ键,而CH4分子中有4个σ键
解析 NH3和CH4的中心原子均是sp3杂化,但NH3分子中有一对孤电子对,CH4分子中没有孤电子对,由于孤电子对与成键电子对之间的排斥作用大于成键电子对与成键电子对之间的排斥作用,NH3分子进一步被“压缩”成三角锥形,甲烷则呈正四面体形。
2.下列有关NCl3分子的叙述正确的是A.NCl3分子中的N原子采取sp2杂化B.NCl3分子为平面三角形C.NCl3分子中Cl—N—Cl键角小于109°28′D.NCl3分子中含有非极性键
解析 NCl3分子的中心原子N原子有一对孤电子对,N原子的杂化类型为sp3,其中1个杂化轨道含有一对孤电子对,对成键电子对具有排斥作用,使键角小于109°28′,NCl3分子为三角锥形,分子中N—Cl键为极性键。
3.下列有关苯分子中的化学键描述正确的是A.每个碳原子的sp2杂化轨道中的其中一个形成大π键B.每个碳原子的未参加杂化的2p轨道形成大π键C.碳原子的三个sp2杂化轨道与其他原子形成三个π键D.碳原子的未参加杂化的2p轨道与其他原子形成σ键
解析 苯分子中每个碳原子的三个sp2杂化轨道分别与两个碳原子和一个氢原子形成σ键。同时每个碳原子还有一个未参加杂化的2p轨道,它们均有一个未成对电子,这些2p轨道相互平行,以“肩并肩”方式相互重叠,形成一个多电子的大π键。
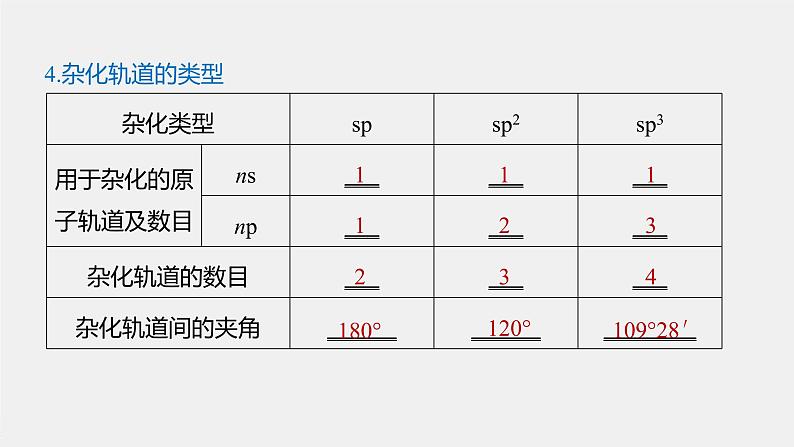
1.杂化轨道类型的判断方法(1)杂化轨道类型与轨道夹角的关系
sp3→109°28′sp2→120°sp→180°
(2)根据分子(或离子)的空间结构判断
(3)对于ABm型分子,中心原子A的杂化方式判断方法:
说明:①n为中心原子杂化轨道数目,n=2时,为sp杂化,n=3时,为sp2杂化,n=4时,为sp3杂化。②配位原子B为氧原子或硫原子时,成键电子数为0;配位原子为氢原子或第ⅦA族元素时,每个配位原子有一个成键电子。
2.有机物中碳原子的杂化类型(1)根据碳原子形成的σ键数目判断有机物中,碳原子杂化轨道形成σ键,未杂化轨道形成π键。(2)由碳原子的饱和程度判断①饱和碳原子采取sp3杂化;②双键上的碳原子或苯环上的碳原子采取sp2杂化;③三键上的碳原子采取sp杂化。
1.有关杂化轨道的说法不正确的是A.杂化轨道全部参与形成化学键B.杂化前后的轨道数不变,但轨道的形状发生了改变C.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°D.四面体形、三角锥形的结构可以用sp3杂化轨道解释
2.下列对于NH3和CO2的说法中正确的是A.都是直线形结构B.中心原子都采取sp杂化C.NH3为三角锥形结构,CO2为直线形结构D.N原子和C原子上都没有孤电子对
解析 NH3和CO2分子的中心原子分别采取sp3杂化、sp杂化的方式成键,但NH3分子的N原子上有1对孤电子对来参与成键,根据杂化轨道理论,NH3的空间结构应为三角锥形,CO2的空间结构为直线形。
3.下列关于原子轨道的说法正确的是A.凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合 起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的1个s轨道和3个p轨道重新组 合而形成的一组能量相同的新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化成键
解析 中心原子采取sp3杂化,但如果中心原子还有孤电子对,分子的空间结构则不是正四面体;CH4分子中的sp3杂化轨道是C原子的一个2s轨道与三个2p轨道杂化而成的;AB3型的共价化合物,A原子可能采取sp2杂化或sp3杂化。
解析 中碳原子形成了3个σ键,无未成键价电子对,需要形成3个杂化轨道,采用的杂化方式是sp2。两边的碳原子各自形成了4个σ键,无未成键电子对,需要形成4个杂化轨道,采用的是sp3杂化。
4.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是A.sp2 sp2 B.sp3 sp3C.sp2 sp3 D.sp sp3
5.下列关于杂化轨道的叙述正确的是A.杂化轨道可用于形成σ键,也可用于形成π键B.杂化轨道可用来容纳未参与成键的孤电子对C.NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H原子的1个s轨道 杂化而成的D.在乙烯分子中1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形 成3个C—H σ键
解析 杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对,不能用来形成π键,故B正确,A不正确;NH3中N原子的sp3杂化轨道是由N原子的1个s轨道和3个p轨道杂化而成的,C不正确;在乙烯分子中,1个碳原子的3个sp2杂化轨道中的2个sp2杂化轨道与2个氢原子的s轨道重叠形成2个C—H σ键,剩下的1个sp2杂化轨道与另一个碳原子的sp2杂化轨道重叠形成1个C—C σ键,D不正确。
一、单项选择题1.下列关于杂化轨道的说法错误的是A.所有原子轨道都参与杂化B.同一原子中能量相近的原子轨道参与杂化C.杂化轨道能量集中,有利于牢固成键D.杂化轨道中不一定有电子
解析 参与杂化的原子轨道,其能量不能相差太大,如1s与2s、2p能量相差太大,不能形成杂化轨道,即只有能量相近的原子轨道才能参与杂化,故A项错误,B项正确;杂化轨道一头大一头小,成键时利用大的一头,可使原子轨道重叠程度更大,形成的化学键更牢固,故C项正确;并不是所有的杂化轨道中都有电子,可以是空轨道,也可以有孤电子对(如NH3、H2O),故D项正确。
2.下列有关杂化轨道的说法不正确的是A.原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道B.轨道杂化前后轨道数目可以相等,也可以不等C.杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理D.杂化轨道可分为sp、sp2、sp3杂化等
解析 A项,原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道,轨道数不变,轨道形状发生变化,正确;B项,杂化轨道的数目与杂化前的轨道数目相等,但轨道形状发生变化,错误;C项,杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理,这样形成的分子才能最稳定,正确;D项,杂化轨道可分为sp、sp2、sp3杂化等,正确。
3.下列关于杂化轨道的叙述中,不正确的是A.分子中的中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角 形结构B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对C.N2分子中N原子没有杂化,分子中有1个σ键、2个π键D.H3PO4分子中三种原子均以杂化轨道成键
解析 分子中的中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构,可能呈六边形,A正确;杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对,B正确;N2分子中N原子没有杂化,2p能级的3个电子其中一个是“头碰头”式,形成σ键,其余2个2p电子以“肩并肩”式形成2个π键,C正确;H3PO4分子中三种原子不都是以杂化轨道成键,H与O原子之间是以共用电子对形成的共价键,D错误。
解析 CH4中碳原子为饱和碳原子,采用sp3杂化。A项,亚甲基碳原子为饱和碳原子,采用sp3杂化;B、C项,C==C中的不饱和碳原子采用sp2杂化;D项,C≡C中的不饱和碳原子采用sp杂化。A项符合题意。
5.下列关于丙烯(CH3—CH==CH2)的说法正确的是A.丙烯分子有8个σ键,1个π键B.丙烯分子中3个碳原子都是sp3杂化C.丙烯分子不存在非极性键D.丙烯分子中3个碳原子不在同一平面
6.(2019·山西沁县中学月考)据报道,大气中存在一种潜在的温室气体SF5—CF3,下列关于SF5—CF3的说法正确的是A.分子中既有σ键又有π键B.所有原子在同一平面内C.C的杂化方式为sp3杂化D.0.1 ml SF5—CF3分子中含8 ml电子
解析 SF5—CF3分子中只有共价单键,则分子中只有σ键,没有π键,故A项错误;C原子形成4个σ键,没有孤电子对,为sp3杂化,所有原子不可能共面,故B项错误,C项正确;0.1 ml SF5—CF3分子中含有的电子数为0.1 ml×(16+9×8+6)=9.4 ml,故D项错误。
7.乙炔的结构式为H—C≡C—H,有关乙炔分子中化学键的描述不正确的是A.两个碳原子均采用sp杂化方式B.两个碳原子均采用sp2杂化方式C.每个碳原子都有两个未杂化的2p轨道形成π键D.两个碳原子均形成两个π键
解析 乙炔分子中两个碳原子均以1个s轨道和1个p轨道形成sp杂化轨道,两个碳原子采用sp杂化,每个碳原子以两个未杂化的2p轨道形成2个π键构成碳碳三键,B项不正确。
8.苯分子不能使酸性KMnO4溶液褪色的原因是A.分子是平面结构B.分子中只存在σ键C.苯不具有还原性D.分子中存在6电子大π键,结构稳定
解析 苯分子中碳碳原子之间的键不是单纯的单键或双键,而是介于单、双键之间的独特的键,即存在6个电子的大π键,结构稳定,不能使酸性高锰酸钾溶液褪色,所以选D。
9.(2019·衡水高二检测)有关原子杂化的说法正确的是A.空间结构是正四面体的分子,中心原子都是以sp3杂化B.苯分子中的碳原子以sp2杂化轨道形成π键、未杂化的2p轨道也形成σ键C.乙烯分子的碳原子以sp2杂化,其中,C—H之间是以sp2杂化轨道形成 的σ键,C—C之间除了以sp2杂化轨道形成σ键外,未参加杂化的2p轨 道形成π键D.只要分子的中心原子的杂化类型相同,分子的键角就一定相同
解析 A项,比如白磷分子虽然为正四面体结构,却不发生杂化;B项,苯分子中的碳原子发生sp2杂化,碳原子之间以sp2杂化轨道形成σ键,每个碳原子上的未杂化的2p轨道重叠形成π键;D项,分子的中心原子的杂化类型相同,比如都是以sp3杂化的分子,由于中心原子上的孤电子对不同,对杂化轨道的排斥能力不同,导致分子的键角不同。
二、不定项选择题10.下列分子的空间结构可用sp2杂化轨道来解释的是
①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥
解析 ①BF3为平面三角形结构且B—F键夹角为120°,B原子为sp2杂化;②C2H4分子中C原子采取sp2杂化,且未杂化的2p轨道形成π键;③苯分子中C原子采取sp2杂化;④乙炔分子中的C原子采取sp杂化;⑤NH3分子中N原子采取sp3杂化;⑥CH4分子中的碳原子采取sp3杂化。
11.下列分子的空间结构是正四面体形的是①CH4 ②NH3 ③CF4 ④SiH4 ⑤C2H4A.①②③ B.①③④C.②④⑤ D.①③⑤
12.下列说法正确的是A.H2SO4分子中S原子以杂化轨道成键
B. 的电子式为 ,该离子呈平面正方形
C.CH4分子中的4个C—H键都是由氢原子的1s轨道与碳原子的2p轨道重叠 形成的D.CH4分子中碳原子的sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成 4个C—H键
解析 H2SO4分子中H、O原子没有发生轨道杂化,A项正确; 呈正四面体形,B项错误;CH4分子中碳原子的2s轨道与2p轨道进行杂化形成4个sp3杂化轨道,然后碳原子的sp3杂化轨道与氢原子的1s轨道重叠形成C—H σ键,C项错误,D项正确。
13.sp3杂化形成的AB4型分子的空间结构是A.平面四边形 B.正四面体形C.四角锥形 D.平面三角形
三、非选择题14.(2019·山西省实验中学月考)已知下列微粒:①CH4 ②CH2==CH2 ③CH≡CH ④NH3 ⑤ ⑥BF3 ⑦H2O ⑧H2O2。试回答下列问题。(1)微粒的空间结构为正四面体形的是_____(填序号,下同)。(2)中心原子为sp3杂化的是___________,中心原子为sp2杂化的是_____,中心原子为sp杂化的是___。(3)所有原子共平面(含共直线)的是_________,共直线的是_____。
解析 ①CH4中C原子采取sp3杂化,CH4的空间结构为正四面体形;②CH2==CH2中C原子采取sp2杂化,CH2==CH2中所有原子共平面;③CH≡CH中C原子采取sp杂化,CH≡CH的空间结构为直线形;④NH3中N原子采取sp3杂化,NH3的空间结构为三角锥形;⑤ 中N原子采取sp3杂化, 的空间结构为正四面体形;⑥BF3中B原子采取sp2杂化,BF3的空间结构为平面三角形。
15.小明同学上网查阅了如下资料:
请运用该方法计算下列微粒的n值,并判断中心原子的杂化类型。(1)NH3:n=____,_____杂化。
(4)SO2:n=____,_____杂化。
高中鲁科版 (2019)第2节 共价键与分子的空间结构授课ppt课件: 这是一份高中鲁科版 (2019)第2节 共价键与分子的空间结构授课ppt课件,共17页。PPT课件主要包含了一手性分子,手性异构体,CHBrClF分子,看图整理,手性分子,有手性异构体的分子,手性碳原子,乳酸分子两种异构体,手性分子的判断方法,不能重合是手性分子等内容,欢迎下载使用。
2020-2021学年第2节 共价键与分子的空间结构授课ppt课件: 这是一份2020-2021学年第2节 共价键与分子的空间结构授课ppt课件,共51页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
苏教版 (2019)选择性必修2第一单元 分子的空间结构课文课件ppt: 这是一份苏教版 (2019)选择性必修2第一单元 分子的空间结构课文课件ppt,共55页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。













